Узорчатая текстура древесины карельской березы (Betula pendula Roth var. carelica) создается за счет темноокрашенных включений паренхимной ткани. Их формирование связано с нарушением дифференцировки производных камбия и индуцируется появлением в проводящей флоэме избытка сахарозы [1, 7]. Утилизацию сахарозы в растительных тканях осуществляют два фермента – инвертаза (Инв) и сахарозосинтетаза (СС). Изменение программы развития клеток камбиальной зоны карельской березы, ведущее к повышению степени паренхиматизации проводящих тканей, происходит на фоне пониженной активности СС в ксилеме и сопровождается интенсивным расщеплением сахарозы инвертазой, локализованной в клеточной стенке (апопластная инвертаза, АпИнв) [1]. Гексозы, образующиеся при расщеплении сахарозы с участием АпИнв, представляют собой субстраты для дыхания и синтетических процессов. Наряду с этим они являются звеньями сигнальных систем, в связи с чем оказывают влияние на экспрессию многих генов ([5, 8] и др.).
Камбиальный рост древесных растений обеспечивается поступлением в ткани ствола не только сахарозы, но и азотистых соединений. Эксперименты с внесением экзогенного нитрата продемонстрировали возможность регуляции активности СС и АпИнв в ходе ксилогенеза карельской березы [2]. В данном случае действие нитратов приводило к снижению активности СС и АпИнв в зоне роста и дифференциации ксилемы. Это способствовало уменьшению прироста ксилемы и содержания в ней клеток паренхимы, т.е. подавляло формирование узорчатой текстуры древесины. Вместе с тем, сахароза, поступающая из листьев, интенсивно расщеплялась во флоэме под действием АпИнв этой ткани. Гексозы, образующиеся в ходе реакции, использовались в реакциях запасного метаболизма, что поддерживало жизнедеятельность существующих и образование новых клеток запасающей паренхимы. Вероятно поэтому отличительной особенностью берез, произрастающих на плодородных почвах, является более толстая кора; максимальным выражением этих тенденций становится появление грубокорых форм березы.
В период активной деятельности камбия донорами сахарозы выступают фотосинтезирующие листья. Дополнительное азотное питание растения должно находить отражение в фотосинтетической активности листового аппарата, и, следовательно, влиять на метаболический статус листа.
Целью работы было исследовать влияние экзогенного нитрата на ряд метаболических показателей листа обычной березы повислой (B. pendula var. pendula) и карельской березы в период активного камбиального роста. В статье приведены данные по активности сахарозосинтазы и апопластной инвертазы, содержанию пигментов, сахарозы и крахмала в листьях контрольных растений и растений, обработанных нитратами.
Материалы и методы исследования
Объектами исследования были 6-летние деревья обычной березы повислой (Betula pendula Roth var. pendula) с нормальным строением тканей ствола и карельской березы (B. pendula var. carelica) с признаками структурных аномалий. Растения произрастали в одинаковых почвенно-климатических условиях на Агробиологической станции Карельского научного центра РАН в 2 км от Петрозаводска (61 ° 45' с.ш., 34 ° 20' в.д.).
Эксперимент проводили в период активного камбиального роста (2-4 июля 2012 года). Деревья разделили на две группы: (1) опытные, подвергшиеся обработке нитратом калия (KNO3), и (2) контрольные, без внесения нитратов. Под каждое опытное растение вносили 20 л 50 мМ раствора KNO3, под контрольные деревья – 20 л воды. Через двое суток после внесения нитратов с каждого растения отбирали корни и листья с удлиненных (ауксибласты) и укороченных (брахибласты) побегов. Растительные ткани фиксировали жидким азотом и хранили в низкотемпературной морозильной камере при – 75 °С.
Содержание нитратного (NO3) азота в почве, корнях и листьях каждого дерева определяли потенциометрическим методом (рН-метр Анион А4100, Россия). Содержание нитрата в почве выражали в мг N от NO3 на 100 г сухой массы почвы, в корнях и листьях – в мкмоль NO3 на г сухой ткани.
Определение содержания пигментов проводили спектрофотометрическим методом (спектрофотометр СФ 2000, Россия). Хлорофилл экстрагировали из свежих листьев 80 % ацетоном, полученный экстракт анализировали в диапазоне длин волн 410 – 700 нм. Расчет пигментов проводили по формулам H.K. Lichtenthaler (1987). Расчет доли хлорофиллов в светособирающем комплексе (ССК) от их суммы производили с учетом того, что весь хл в находится в ССК [6].
Для определения ферментативной активности растительные ткани растирали в жидком азоте до однородной массы и гомогенизировали при 4 °С в буфере следующего состава: 50 мМ Hepes (pH = 7.5), 1мМ ЭДТА, 1 мМ ЭГТА, 3 мМ ДТТ, 5 мМ MgCl2, 0.5 мМ PMSF. После 20-минутной экстракции гомогенат центрифугировали при 10000 g в течение 20 минут (центрифуга Sigma 2-16PK, Германия). Осадок троекратно промывали буфером. Объединенный супернатант и осадок диализовали при 4 °С в течение 18-20 часов против буфера для гомогенизации, разбавленного в 10 раз. В осадке определяли АпИнв, в супернатанте – СС. Активность АпИнв определяли по количеству образовавшейся глюкозы глюкозооксидазным методом. Активность СС определяли в направлении синтеза сахарозы по количеству образовавшейся фруктозы спектрофотометрически (спектрофотометр СФ-2000, Россия) [2]. Активность ферментов выражали в мкмоль распавшейся сахарозы на г сырой ткани (мкмоль/г сырой ткани).
Содержание сахарозы определяли хроматографически на ВЭЖХ системе серии «Стайер» (Аквилон, Россия), как описано ранее [1] и выражали в мг на г сухой ткани.
Крахмал извлекали хлорной кислотой по методу Пьючера, его содержание определяли по количеству образованной в результате кислотного гидролиза глюкозы глюкозооксидазным методом.
Обработку данных проводили с использованием общепринятых методов статистической обработки с использованием пакетов программ Microsoft Excel и StatGraphics для Windows. В эксперименте было задействовано 12 растений, по 3 в каждой группе.
Все исследования проведены на оборудовании ЦКП «Аналитическая лаборатория» ИЛ КарНЦ РАН.
Результаты исследования и их обсуждение
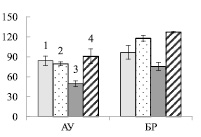
Увеличение нитратного азота в почве примерно в 100 раз приводило к возрастанию его содержания в корнях опытных растений березы (рис. 1, А) в 8 – 9 раз, по сравнению с контрольными деревьями (рис. 1, Б), что свидетельствует об активном поступлении нитратов из почвы в корни. Иная картина наблюдалась в листьях. Достоверное возрастание нитратов (в 1,6 раза) было отмечено только у карельской березы в листьях ауксибластов (рис. 1, В). Накопление нитратов только в листьях удлиненных побегов может быть вызвано тем, что рост ауксибластов, в отличие от брахибластов, продолжается в течение всего вегетационного периода, в связи с чем в побег поступает большее количество воды с нитратами из корней.
В период активного роста фотосинтезирующие листья являются основным донором ассимилятов в растении. Одним из важных показателей фотосинтетической активности листового аппарата считается содержание фотосинтетических пигментов, от их количества и эффективности работы во многом зависит продуктивность целого растения.
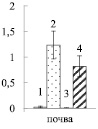

А Б В
Рис. 1. Содержание нитратного азота в почве (мг нитратного азота на 100 г почвы) (А), корнях (Б) и листьях (В) ауксибластов (АУ) и брахибластов (БР) (мкмоль нитратов на г сухой ткани) контрольных (1, 3) и опытных (2, 4) растений обычной (1, 2) и карельской (3, 4) березы. Представлены средние значения десяти повторностей и их стандартные ошибки
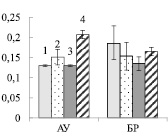
А Б
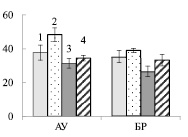
Рис. 2. Содержание хлорофилла (мг/г сырой ткани) (А) и размер светособирающего комплекса ( %) (Б) в листьях ауксибластов (АУ) и брахибластов (БР) контрольных (1, 3) и опытных (2, 4) растений обычной (1, 2) и карельской (3, 4) березы. Представлены средние значения шести повторностей и их стандартные ошибки
В листьях АУ суммарное содержание хлорофилла у контрольных растений карельской березы было в 1,2 раза выше, по сравнению с обычной березой (рис. 2. А). В хлоропластах основная масса хлорофилла входит в состав светособирающего комплекса (ССК), выполняющего роль антенны и передающего энергию к реакционному центру фотосистем I или II. Размер ССК определяет способность листа к светопоглощению. У карельской березы на фоне большего содержания пигментов количество их в ССК было в 1,4 раза выше, по сравнению с обычной березой (рис. 2, Б). В обоих случаях добавление нитрата калия не приводило к изменению в содержании пигментов в листьях АУ (рис. 2, А). При этом содержание хлорофилла в ССК снизилось в 1,2 и 1,3 раза у обычной и карельской березы соответственно (рис. 2, Б).
В листьях БР содержание хлорофилла у двух форм березы не отличалось между собой. Внесение в почву экзогенного нитрата сопровождалось увеличением количества пигментов в 1,3 и 1,4 раза у обычной и карельской березы соответственно (рис. 2, А). Рост уровня хлорофилла в листьях БР сопровождался увеличением его доли в ССК (рис. 2, Б).
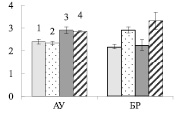
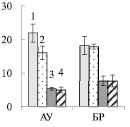
Можно ожидать, что изменение содержания пигментов в листьях будет оказывать влияние на синтез сахарозы в ходе фотосинтеза. У исследуемых форм березы сахароза представляет собой основную транспортную форму фотоассимилятов [3]. У контрольных деревьев карельской березы, по сравнению с обычной березой, содержание сахарозы в листьях АУ и БР было меньше в 4 и 2 раза соответственно (рис. 3, А). При этом в листьях карельской березы накапливался крахмал, количество которого было выше в 4 раза в листьях ауксибластов и в 1,2 раза в листьях брахибластов, по сравнению с обычной березой (рис. 3, Б). Крахмал представляет собой резервный полисахарид. Его содержание в хлоропластах листьев карельской березы скорее всего возрастает в результате более высокой, чем у обычной березы, интенсивности фотосинтеза.
Внесение нитратов в почву не привело к существенному изменению количества сахарозы в листьях изучаемых растений (рис. 3, А), но отрицательно сказалось на содержании крахмала. У обычной березы его количество снизилось в 1,4 раза в листьях БР, а у карельской березы в листьях АУ и БР – в 2,6 и 3,1 раза соответственно (рис. 3, Б). Причиной такого эффекта может быть влияние нитратов на синтез крахмала. Установлено, что после двухчасовой обработки растений табака 12 мМ раствором нитрата калия снижается концентрация мРНК, кодирующих АДФ-глюкозопирофосфорилазу – фермента, участвующего в синтезе крахмала [9]. Поскольку в листьях березы снижение содержания крахмала не сопровождалось накоплением сахарозы, можно заключить, что действие нитратов привело к возрастанию оттока сахарозы в ткани ствола и/или увеличению использования дисахарида в листе.
А Б
Рис. 3. Содержание сахарозы (А), крахмала (Б) (мг/г сухой ткани) в листьях ауксибластов (АУ) и брахибластов (БР) контрольных (1, 3) и опытных (2, 4) растений обычной (1, 2) и карельской (3, 4) березы. Представлены средние значения пяти повторностей и их стандартные ошибки
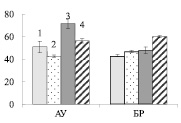
А Б
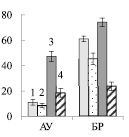
Рис. 4. Активность апопластной инвертазы (А) и сахарозосинтазы (Б) (мкмоль сахарозы на 1 г сырой ткани) в листьях ауксибластов (АУ) и брахибластов (БР) контрольных (1, 3) и опытных (2, 4) растений обычной (1, 2) и карельской (3, 4) березы. Представлены средние значения трех повторностей и их стандартные ошибки
Для понимания процессов, происходящих в листе, рассмотрим два пути метаболизации сахарозы – с участием сахарозосинтазы и инвертазы. В период активного роста сахарозосинтазная активность в листе смещена в сторону синтеза сахарозы, которая поступает во флоэму и по ней оттекает к акцепторным тканям [4, 10]. Утилизация сахарозы по инвертазному пути приводит к образованию глюкозы и фруктозы, которые не могут загружаться во флоэму, и расходуются в метаболизме клеток листа.
У обычной березы активность СС преобладала над активностью АпИнв в 2,2 и 2,8 раз в листьях АУ и БР соответственно (рис. 4). Из этого можно заключить, что отток сахарозы из листьев к акцепторным тканям был выше, чем использование дисахарида в листе. Действие нитрата калия приводило к снижению активности СС и увеличению активности АпИнв в листьях АУ, и, следовательно, к снижению оттока сахарозы.
Подавление оттока ассимилятов из листьев-доноров к потребляющим органам в условиях усиленного азотного питания было показано ранее [4]. Авторы связывали это с включением экзогенного нитрата в метаболизм: за счет увеличения метаболизации сахарозы по инвертазному пути осуществляется субстратное обеспечение реакций гликолиза, пентозофосфатного пути и цикла Кребса и в итоге ускоренный синтез С-акцепторов для утилизации поглощенного нитрата.
У контрольных растений карельской березы, как и у обычной березы, активность СС, по сравнению с активностью АпИнв, была выше в 1,6 раз в листьях АУ и в 2,8 раз в листьях БР. Действие нитрата калия приводило к существенному возрастанию активности СС в листьях, при этом активность АпИнв не изменялась (рис. 4). Из этого можно заключить, что в листьях АУ карельской березы внесение KNO3 не приводило к мобилизации углерода в органические кислоты – акцепторы для утилизации нитрата, результатом чего было накопление нитрат аниона (рис. 1, В).
Таким образом, в условиях повышения уровня нитратов в почве у карельской березы, в отличие от обычной березы, в листьях происходит увеличение активности СС, что свидетельствует о возрастании синтеза сахарозы – основной транспортной формы сахаров и, следовательно, об усилении ее оттока к акцепторным органам.
Исследование выполнено в рамках государственного задания Института леса КарНЦ РАН (№ гос. регистрации 0220-2014-0001).
Библиографическая ссылка
Галибина Н.А., Новицкая Л.Л., Софронова И.Н. ВНЕСЕНИЕ НИТРАТНОГО АЗОТА УВЕЛИЧИВАЕТ ДОНОРНУЮ ФУНКЦИЮ ЛИСТЬЕВ КАРЕЛЬСКОЙ БЕРЕЗЫ // Международный журнал прикладных и фундаментальных исследований. – 2016. – № 10-4. – С. 582-586;URL: https://applied-research.ru/ru/article/view?id=10393 (дата обращения: 19.04.2024).

