Новообразования, особенно злокачественные опухоли, устойчиво занимают второе место в структуре заболеваемости и смертности населения [1]. Развитие злокачественных образований сопровождается нарушением функционированию ряда систем организма. Опухоль, в первую очередь, оказывает негативное воздействие на иммунное состояние организма [2, 3]. Известно, что при развитии злокачественных новообразований происходит нарушение равновесия в системе свободно радикального перекисного окисления липидов, антиоксидантной защиты [4].
Несмотря на расширяющийся ассортимент противоопухолевых препаратов, которые становятся все более специфичными, для создания высокой концентрации лекарственных веществ в опухолевой ткани и получения стойкого терапевтического эффекта требуется введение высоких доз лекарственных препаратов, что вызывает проявление системной токсичности.
Одним из путей преодоления недостатков химиотерапии является термическое разрушение опухолей с использование термосенсибилизаторов. В качестве последних используются наночастицы металлов, лидирующую роль среди которых занимают наночастицы благородных металлов, в частности, золота. Идея нагрева золотых наночастиц лазерным излучением ИК-диапазона с целью локального термического повреждения клеток была предложена в 2003 году К. Питсиллидисом и соавторами [5]. В этом же году показана возможность применения данного метода в онкологии [6]. Одним из преимуществ использования НЧ золота в экспериментальной онкологии является их химическая стабильность, биосовместимость, уникальные адсорбционные и хелатообразующие свойства.
Принципиально важным с точки зрения применения НЧ Au в живых системах имеет вопрос об их токсичности. В аналитических обзорах Дыкмана Л.А. и соавторов собрана наиболее исчерпывающая информация о синтезе, стабилизации и свойствах НЧ Au для применения их в биосистемах [7]. Авторы отмечают, что многочисленные опыты не выявили заметной токсичности у НЧ золота размером 3–100 нм, причем частицы с верхней границей размера 15–20 нм способны проникать через гематоэнцефалический барьер. В то же время НЧ Au диаметром 1– 2 нм имеют высокую токсичность за счет необратимого связывания с биополимерами клеток [8, 9]. Токсичность отсутствует при кратковременном (около недели) введении НЧ Au в суточной дозе 0.5 мг/кг [8].
Использование наночастиц золота в качестве термосенсибилизатора дало возможность снизить мощность лазерного излучения и обеспечить локальность воздействия при термосенсибилизационной терапии. Кроме того, НЧ Au обладают антиангиогенным действием – они угнетают сосудообразование, подавляя VEGF165 – индукцированную пролиферацию эндотелиальных клеток сосудов [10].
Практически во всех работах, обобщенных в обзоре [11], использовали инъекционное введение НЧ, стабилизированных различными природными и синтетическими полимерами – белками, полиэтиленгликолем и его производными, полиамидами, мальтодекстринами, гуммиарабиком [12]. При этом функционализация поверхности наночастиц существенно влияет на их биораспределение в организме.
Применение НЧ Au в живых системах требует использования стабилизатора, выполняющего одновременно функцию транспортного средства. С этой точки зрения перспективным представляется использование в качестве экранирующего агента природного полимера хитозана – 1,4-поли(2-дезокси-2-амино-D-глюкозы), продукта деацетилирования полисахарида хитина [13]. Интерес к хитозану (ХТЗ) связан с уникальными физиологическими и экологическими свойствами, такими как биосовместимость, биодеструкция, гипоаллергенность, физиологическая активность при отсутствии токсичности, доступность сырьевых источников [14]. Катионная природа ХТЗ обеспечивает его способность раздвигать плотные контакты эпителия кишечника и проникать в сосудистое русло [15]. Кроме того, ХТЗ способен выполнять функцию иммуномодулятора, носителя лекарственных средств, что приводит к более длительной их циркуляции в организме. Создание такого препарата позволит использовать его как при инъекционном, так и при пероральном введении.
Целью работы явилось изучение количественного распределения по органам и опухолевой ткани лабораторных животных наночастиц золота при пероральном и перитуморальном введении водной дисперсии НЧ золота, стабилизированных хитозаном.
Материалы и методы исследования
В работе использовали водные дисперсии НЧ золота, стабилизированных хитозаном («ХТЗ – НЧ Au») [16] с молекулярной массой 1.3/105 и степенью деацетилирования 80 – 82 % (ЗАО «Биорогресс» ВНИТИБП, Московская область). НЧ Au получали в растворе ХТЗ при УФ-индуцированном восстановлении HAuCl4. Методом рассеяния рентгеновских лучей под малыми углами доказано, что условиях синтеза концентрация золота в наночастицах полностью соответствует его содержанию в HAuCl4, а средний размер НЧ меняется в пределах от 5 до 10 нм [17].
Исследования по пероральному и инъекционному применению нанодисперсий проводили на белых нелинейных крысах самках массой 150 – 200 г с перевитой опухолью штамма РС-1, содержащихся в условиях вивария. Штамм альвеолярного рака печени РС-1 был получен из банка опухолевых штаммов ГУ РОН им. Блохина РАМН. Перевивку опухоли (0,5 мл 30 % взвеси опухолевых клеток в растворе Хенкса) осуществляли подкожно в паховую область справа [18].
Было выполнено две серии экспериментов. В первой серии животным-опухоленосителям раствор препарата вводили перорально помощью зонда, пятикратно с периодичностью 1 раз в 2 суток объемом 0,25 мл на животное, что соответствовало дозам: ХТЗ – 100 мг/ кг, золота – 0,5 мг/кг. Через сутки после окончания введения препарата исследовали распределение золота по органам и в опухоли животного. Для этого под эфирным наркозом осуществляли их декапитацию и забор опухолевой ткани, головного мозга, сердца, легких, селезенки, почек и печени. Определение содержания золота в органах проводили методом атомно-эммисионного анализа согласно методическим указаниям МУК 41.985-00 после автоклавной минерализации проб тканей. Возбуждение спектра проб, переведенных предварительно в устойчивую аналитическую форму и размещенных в кратере графитовых электродов, осуществлялось с применением дугового разряда постоянного тока с помощью генератора УГЭ-4. Для регистрации их спектра использовался спектрограф со сканирующей дисперсией СТЭ-1.
Во второй серии опытов введение препарата осуществляли инъекционно – перитуморально. Животные были разделены на 2 группы по 10 особей в каждой: 1) контроль (животные-опухоленосители без лечения); 2) животные-опухоленосители, которым вводили дисперсию «ХТЗ – НЧ Au». Препарат вводили спустя 2 недели после перевивки опухоли путем подкожных инъекций в область здоровой ткани на расстоянии не менее 0,5 см от периферии опухоли, пятикратно, через день, в объеме 0,25 мл на животное (доза ХТЗ – 100 мг/ кг, золота – 0,5 мг/кг) (терапия в течение 10 дней). Для отслеживания изменений в микроструктуре биотканей было использовано ОКТ устройство кроссполяризации, произведенное в Институте прикладной физики РАН (Нижний Новгород, Россия) [19], что позволило определить границу опухолевой и здоровой ткани. На следующие сутки после окончания инъекций у пяти животных в каждой группе забирали опухоль для определения содержания в ней золота. На 28-е сутки после окончания курсового введения препарата у оставшихся животных каждой группы определяли массу опухоли путем ее взвешивания. Одновременно на гистологических срезах опухолевой ткани с помощью морфометрических методик замеряли площади (S, %), занимаемые в плоскости гистологического среза паренхимой опухоли, ее стромы и кровеносных сосудов.
Все процедуры над лабораторными животными осуществляли в соответствии с требованиями «Европейской конвенции о защите позвоночных животных, используемых для экспериментов или иных научных целях» (Страсбург, 18 марта, 1985 г); «Международными рекомендациями по проведению медико-биологических исследований с использованием животных» (1993 г); «Правилами лабораторной практики в Российской Федерации» (приказ МЗ РФ № 267 от 19. 06. 2003) и «Правилами проведения работ с использованием экспериментальных животных» (МЗ 3 755 от 12.03.1977).
Результаты исследования и их обсуждение
В результате проведенного анализа распределения золота по органам при курсовом пероральном введении дисперсии НЧ Au,стабилизированных хитозаном установлено наличие золота в печени, почках, легких, селезенке, причем максимальное его количество определяется через 10 суток после окончания процедуры (табл. 1).
В головном мозге, сердце, опухолевой ткани в пределах чувствительности метода атомно-эмиссионного анализа содержание золота не обнаружено.
Принципиально важным положительным результатом этого этапа исследования является установление факта полного выведения золота из организма спустя 28 суток после окончания введения препарата при размерах НЧ меньше 30 нм. Отсутствие диффузии НЧ Au в опухолевую ткань при пероральном применении препарата послужило основанием проведения второй серии экспериментов по инъекционному введению дисперсии НЧ Au в непосредственной близости от новообразования. Необходимо отметить, что согласно врачебной практике введение препаратов в ткань опухоли может стимулировать процесс метастазирования [20]. Поэтому введение дисперсии НЧ Au проводили инъекционно в здоровую ткань на определенном расстоянии от границы воспаленной ткани, сопровождающейся опухолью (не менее 5 мм).
Область границы здоровой и опухолевой ткани определяли с помощью томографа (рис. 1). Опухоль подкожная и границы ее четко не определялись, но опухолевый процесс сопровождался воспалением, который ОКТ позволял четко отслеживать по водонаполнению тканей.
Таблица 1
Распределение наночастиц золота, стабилизированных хитозаном в органах экспериментальных животных
|
Время после окончания введения крысам препарата ХТЗ-НЧ золота*, сутки |
Количество золота в органах (мкг/г или мг/кг) |
||||||
|
почки |
печень |
мозг |
легкие |
селезенка |
сердце |
опухоль |
|
|
1 |
0.25 |
0.16 |
не обнаружено |
не обнаружено |
0.06 |
не обнаружено |
не обнаружено |
|
10 |
2.56 |
0.56 |
не обнаружено |
0.06 |
0.13 |
не обнаружено |
не обнаружено |
|
15 |
2.56 |
0.19 |
не обнаружено |
0.10 |
0.16 |
не обнаружено |
не обнаружено |
|
20 |
1.28 |
0.13 |
не обнаружено |
0.06 |
не обнаружено |
не обнаружено |
не обнаружено |
|
28 |
0.05 |
не обнаружено |
не обнаружено |
не обнаружено |
не обнаружено |
не обнаружено |
не обнаружено |
* доза НЧ Au – 0.5 мг/кг, доза ХТЗ – 100 мг/кг.
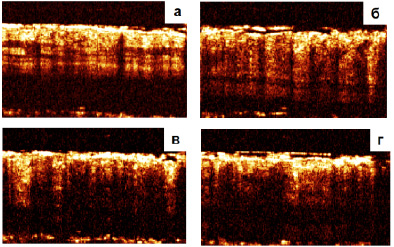
Рис. 1. Определение границы опухоли и границы воспаленной ткани: а – ближе к центру опухоли, на поверхности признаки воспаления; б – предполагаемая граница опухоли по экзофитному вздутию; в – граница воспаленной ткани к норме; г – нормальная ткань
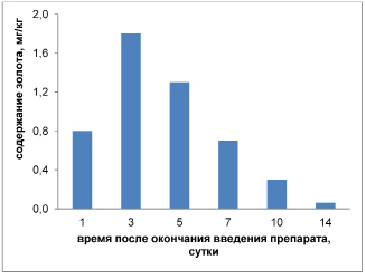
Рис. 2. Изменение содержания золота в опухолевой ткани во времени после перитуморального введения дисперсии НЧ Au, стабилизированных ХТЗ. Препарат вводили 5 раз через сутки в дозе 0.5 мг/кг по золоту и 100 мг/кг по ХТЗ
В противоположность результатам введения дисперсии через рот при перитуморальной процедуре происходило проникновение золота в опухолевую ткань. Динамика изменения содержания золота в опухолевой ткани после окончания курса инъекций представлена на рис. 2.
Существенно не только проникновение золота, но и пролонгированное его присутствие в опухоли с максимумом на 3 сутки. Мы полагаем, что этот эффект обеспечивается хитозаном, способным не только связываться с белковыми молекулами, но и пролонгировано удерживать НЧ Au в тканях опухоли.
Обнаруженный эффект выгодно отличает препарат «НЧ Au – ХТЗ» от других препаратов НЧ Au с другими стабилизаторами, в частности [21], имеющих кратковременный эффект. Длительное присутствие наночастиц золота в новообразовании может обеспечить надежное, выверенное термооблучение опухоли, провести анализ результатов воздействия и при необходимости выполнить повторные процедуры.
Обращает на себя внимание, что дисперсия «НЧ Au – ХТЗ», проникая в опухоль, сам по себе проявляет определенную противоопухолевую активность. Гистологические исследования выявили тенденцию к снижению васкуляризации опухолевой ткани у животных опытной группы. Морфометрические показатели гистологических срезов опухолей представлены в табл. 2.
При применении наноструктурированной системы «НЧ Au – ХТЗ» на животных с перевиваемой опухолью штамма РС-1 в опытных группах зафиксированы статистически значимые уменьшения массы опухолей относительно контрольных животных. Применение нанопрепарата приводит к более высокому проценту дистрофичных клеток и меньшему количеству опухолевых клеток у животных опытной группы по сравнению с контрольной.
Таблица 2
Масса и морфологические изменения в опухолях штамма РС-1 у лабораторных животных на 28 сутки после окончания введения нанопрепарата
|
Группа животных |
Масса, г |
Клетки, % |
Сосуды, % |
Соединительная ткань, % |
|
Контроль |
66,04 ± 7,56 |
84,62 ± 1,71 |
1,10 ± 0,21 |
14,42 ± 1,59 |
|
«НЧ Au – ХТЗ» |
20,89 ± 5,16* |
88,20 ± 1,25 |
0,95 ± 0,26 |
10,73 ± 1,15 |
Примечание. Статистически значимые отличия: * – р < 0.05 по отношению к контрольным животным.
Заключение
Исследования, проведенные на экспериментальных животных с перевитой опухолью штамма РС-1 по доставке частиц золота в ткань новообразования, показали, что в противоположность пероральному применению перитуморальное введение дисперсии наночастиц золота, стабилизированных хитозаном, обеспечивает эффективное проникновение наночастиц золота в опухоль и пролонгированное нахождение в ней с максимальной концентрации наночастиц на 3 сутки.
Дополнительно установлено, что композиция наночастиц золота, стабилизированных хитозаном, проявляет определенную противоопухолевую активность, значимо уменьшая массу опухоли и ее васкуляризацию.
Совокупность полученных результатов указывает на перспективность перитуморального применения дисперсии наночастиц золота, стабилизированных хитозаном, для контролируемого локального гипертермического воздействия на опухоль.
Работа выполнена при финансовой поддержке гранта Министерства образования и науки Российской Федерации (ГК № 4.1537.2014К).
Библиографическая ссылка
Корягин А.С., Дыдыкина В.Н., Саломатина Е.В., Каменский В.A., Зайцев С.Д., Смирнова Л.А. ПЕРИТУМОРАЛЬНОЕ ВВЕДЕНИЕ ДИСПЕРСИЙ НАНОЧАСТИЦ ЗОЛОТА, СТАБИЛИЗИРОВАННЫХ ХИТОЗАНОМ, – ПЕРСПЕКТИВНЫЙ МЕТОД КУМУЛЯЦИИ НАНОЧАСТИЦ ПРИ ПРОТИВООПУХОЛЕВОЙ ГИПЕРТЕРМИИ // Международный журнал прикладных и фундаментальных исследований. – 2016. – № 12-1. – С. 89-94;URL: https://applied-research.ru/ru/article/view?id=10780 (дата обращения: 18.04.2024).

