Атеросклероз и связанные с ним сердечно-сосудистые заболевания, в том числе ишемические болезни сердца, занимают одно из первых мест в смертности и инвалидности среди населения планеты. В атеросклерозе и сердечно-сосудистых заболеваниях большое значение имеет нарушение липидного обмена (холестерин и жирные кислоты).
В последние годы, к сожалению, эти заболевания молодеют, и это объясняется малоподвижным образом жизни и питанием некачественными продуктами, содержащими ГМО и прочие вредные вещества.
В настоящее время в нашей республике сильно увеличилось количество больных с нарушением функции печени, это гепатиты различных форм. Это объясняется тем, что в некоторых отдаленных горных районах республики население испытывает недостаток в чистой воде и пользуется водой из открытых источников. Вирусный гепатит передается с водой, продуктами питания, через предметы домашнего обихода, а также из-за некачественного медицинского обслуживания. Заболевания печени также связаны с употреблением в пищу генетически модифицированных продуктов и повышенным содержанием нитратов и пестицидов в сельхозпродукции.
Создание целебных продуктов на основе лекарственных и полезных растений антиатеросклеротического и гепатопротекторного действия является актуальной проблемой [1].
В научной литературе отмечается 92 научных названия растений видов для рода Dipsacus. Из них 28 являются достоверно признанными названиями видов [2]. В Кыргызской Республике встречается всего 2 вида растений рода Dipsacus: D. Dipsacoides – Ворсянка ворсянковидная, D. Laciniatus – Ворсянка разрезная [3].
Некоторые виды рода Dipsacus издавна применяются в народной и традиционной медицине. В работе [4] указывается, что полисахарид, выделенный из корней Dipsacus asperoides, обладает антиоксидантной и цитотоксической активностью, а Dipsacus silvestris использовался в качестве анальгетика при лечении ревматизма и подагры. То, что растения Dipsacus обладают антиатеросклеротическими свойствами, отмечается в работе Ya-Min Zhao и Yan-Ping Shi, 2011 [5].
Лекарственное средство «Radix Dipsaci – Xuduan», производимое в Китае на основе корней Dipsacus asperoides (ворсянки гималайской), применяют для улучшения кровообращения, работы почек и печени [6].
Настойки из корней ворсянки гималайской, «Teasel Root Tincture Extract Xu Duan», применяют при заболеваниях опорно-двигательного аппарата [7].
Корни ворсянки лазоревой богаты присутствием тритерпеновых гликозидов, содержание которых в фазе относительного покоя 31,8 %.
Из суммы сапонинов выделены три индивидуальных гликозида: дипсакозид А, дипсакобиозид и дипсакозид В. Дипсакозид А имеет строение 3-0-[а]-L-рамнопиранозид- (1 > 2)-L-L] арабопиранозида хедерагенина.
Дипсакобиозид является структурным изомером дипсакозида А, их различие заключается в том, что в дипсакозиде А рамноза соединена с арабинозой через гидроксильную группу при С-2, а в дипсакобиозиде – через С-4.
Дипсакозид В является основным гликозидом ворсянки лазоревой и является бисдесмозидом, т.е. сахара находятся и по гидроксильной, а также карбоксильной группе генина, и имеет строение, представленное на рис. 1.
При щелочном гидролизе из дипсакозида В получается дипсакозид А [8]. Из суммы тритерпеновых гликозидов был разработан способ получения сапонина дипсакозид, обладающего гиполипидемической активностью [9]. Позже препарат дипсакозид был изучен на желчегонную и гепатопротекторную активность [10].
В литературе имеется упоминание, что ворсянка лазоревая в традиционной медицине применяется при ревматизме, язве и раке желудка [11].
Сапонин дипсакозид [12] получают следующим способом: измельченные. высушенные корни растения экстрагируют 80–85 % метанолом в соотношении 1х4 с последующим сгущением экстракта до объёма 8–10 % от первоначального, разбавлением водой, подкислением серной кислотой до РН 2,5–3, экстракцией н-бутанолом, после чего бутанольное извлечение промывают, упаривают досуха, растворяют в этаноле и осаждают диэтиловым эфиром.
Основным недостатком предложенного способа является его трудоемкость и применение дорогостоящих и вредных химических реактивов (метанол, серная кислота), недостатком данного метода также является то, что в состав препарата помимо сапонинов переходят полифенольные вещества, которые легко растворимы в бутаноле.
В связи с этим нами разработан новый усовершенствованный способ получения более очищенного препарата дипсакозид. Сущность предложенного способа состоит в том, что измельченные высушенные корни экстрагировали 96 %-ным этанолом в аппарате непрерывного действия или Сокслета. Полученный этанольный экстракт сгущали до сиропообразной массы, затем сапонины осаждали ацетоном. Осадок высушивали в сушильном шкафу под вакуумом. Выход составил 40 % [12].
Затем суммы сапонинов растворяли в небольшом количестве этилового спирта и вносили в колонку с силикагелем. Элюаты, содержащие дипсакозид, обьединяли и упаривали до сиропообразной массы. После охлаждения сапонины осаждали ацетоном. Затем препарат высушивали под вакуумом. Дипсакозид, полученный предложенным способом, – аморфный порошок белого цвета с желтоватым оттенком, хорошо растворяется в воде, образуя прозрачный раствор.
С целью определения выхода агликона-хедерагенина мы провели кислотный гидролиз обоих препаратов, для этого брали по 1 г препаратов, в отдельности и растворяли в 30 мл водного этанола (1:1), добавляли 30 мл 6 %-ного раствора серной кислоты и нагревали на кипящей водяной бане в течение 8 ч при непрерывном перемешивании. Образовавшийся осадок отделяли, промывали водой до нейтральной реакции, высушивали, растворяли в этаноле и кипятили с активированным углем в течение 1,5 ч, затем отфильтровывали раствор и при сгущении этанольного раствора выпадал кристаллический осадок. При хроматографировании на пластинке «Silufol» в различных системах проявлялось лишь одно пятно, идентичное хедерагенину-свидетелю. По выходу агликона полученный старым способом дипсакозид составляет 20,1 %, а у препарата полученного новым способом составляет 21 %, что указывает, что дипсакозид-2 является более очищенным препаратом.
Нами разработан биокомпозит гепадип, основой которого является дипсакозид-2 выделенный из подземных органов ворсянки лазоревой. В состав гепадипа, кроме дипсакозида-2, входят плоды шиповника используемые при холецистите, гепатитах снижая содержание холестерина в крови; плоды облепихи положительно влияющие на функции печени, снижающие содержание жира и холестерина; цветки бессмертника, которые применяют при хронических холециститах и гепатитах, уменьшают содержание билирубина и холестерина в крови. Биокомпозит Гепадип (гранулы) желтого цвета с приятным слабоароматным запахом облепихи и сладким вкусом, содержит влаги не более 7 %, золы 1,5 %, нерастворимых в воде веществ 10 % и полностью отвечает поставленной цели [12].
Предварительное изучение общефармакологических свойств гепадипа
При изучении общей токсичности на линейных мышах (самцы, весом до 20 г, в количестве 40 особей) установлено, что при однократном внутривенном введении водного раствора гепадипа в дозах от 0,02 до 0,1 мг/ кг на особь выявлено, что гепадип в данных дозах не вызывал токсических явлений.
Установлено, что гепадип в исследуемых дозах не токсичен. Все мыши, получившие однократно гепадип в больших дозах, выжили, оставаясь здоровыми в течение длительного периода наблюдения (3 месяца).
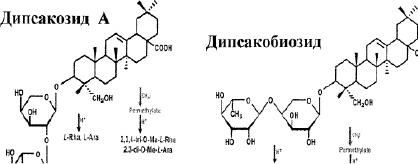
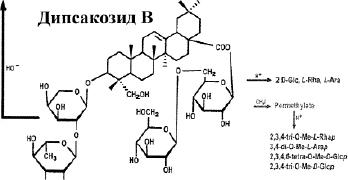
Рис. 1. Строение гликозидов: дипсакозид А, дипсакобиозид и дипсакозид В. Примечание: В дальнейшем дипсакозид-1 – препарат, полученный старым способом [9], дипсакозид-2 – полученный новым способом [12]
Это подтверждается также при изучении морфофункционального состояния органов кроветворения, нервной системы, сердечно-сосудистой и пищеварительной систем при воздействии биокомпозита Гепадип. Для этого было проведено исследование влияния биокомпозита Гепадип на организм экспериментальных животных – половозрелых крыс (самцов) весом 140–160 гр. Биокомпозит Гепадип вводили перорально из расчета 1 мл на 1 кг веса.
Эксперимент проводили в динамике в течение 30 календарных дней. Крысы были разделены на 2 группы – опытную и контрольную (n = 30). В ходе эксперимента не выявлено летальных исходов. Животные проявляли активность, не отказывались от еды. Поведение животных в обеих группах не отличалось. Из этого можно заключить что биокомпозит Гепадип не проявляет токсического действия. В опытной группе к концу эксперимента вес животных составлял 260–270 г, в контрольной группе 205–210 г. Отмечается увеличение массы тела за экспериментальный период.
При морфологическом изучении периферической крови не было выявлено отрицательного влияния на форменные элементы крови, кроме повышения количества лейкоцитов за счет содержания моноцитов и лимфоцитов (рис. 2, 3).
При гистологическом изучении тканей печени, почек, мозга, сердца выявлены морфофункциональные признаки активизации гепатоцитов, нефроцитов, нейронов и кардиомиоцитов в виде увеличения размеров ядер и ядрышек, увеличения количества митохондрий, рибосом.
Эти исследования показали, что биокомпозит гепадип практически не токсичен и обладает иммунопротекторным действием.
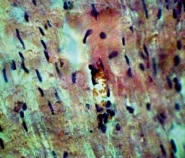
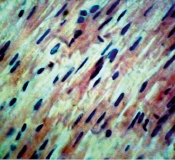
Рис. 2. Миокард крысы, получавшей гепадип. Видны кардиомиоциты с четко выраженными миофибриллами и увеличенными ядрами. Окраска гематоксилин – эозин. Ув. 400×80
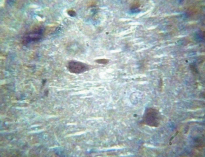
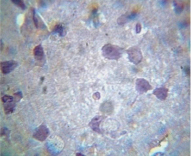
Рис. 3. Ткань мозга крысы, получавшей гепадип. Клетки ткани мозга хорошо выражены, отчетливо видны отростки. Окраска гематоксилин – эозин. Ув. 400?80
Сравнительное изучение гепадипа и дипсакозида
|
Группы, показатели n = 10 |
Контроль СС14 |
Введение СС14, гепадипа, дипсакозида-1, дипсакозида-2 (50 мг/кг) |
||
|
СС14 + гепадип |
СС14 + дипсакозид-1 |
СС14 + дипсакозид-2 |
||
|
желчь мл/100 г |
0,5 ± 0,07 |
1,06 ± 0,073 |
0,7 ± 00,8 |
0,8 ± 0,1 |
|
билирубин мл/100 г |
51,1 ± 4,5 |
90,05 ± 3,43 |
79,8 ± 8,4 х |
80,0 ± 10,6 |
|
желчные кислоты |
2,9 ± 0,3 |
6,01 ± 0,39 |
3,7 ± 0,4 |
3,8 ± 0,7 |
|
холестерин мл/100 г |
0,10 ± 0,01 |
0,154 ± 0,013 |
0,14 ± 0,01 |
0,13 ± 0,02 |
Сравнительное изучение гипохолестеринемических свойств дипсакозида-1, дипсакозида-2 и гепадипа
При проведении этих исследований использовали методики, описанные в авторской работе [12]. Задачей этих исследований является действие дипсакозида-1, дипсакозида-2 и гепадипа на обменные процессы в печени у крыс при экспериментальном гистотоксическом гепатите, вызванном введением четыреххлористого углерода, а также на модели при холестериновой нагрузке. Влияние изучаемых препаратов изучалось на 40 белых крысах смешанной популяции с исходным весом 200 ± 0,2 г, которые были разделены на 4 группы по 10 голов в каждой, 1-я группа контрольная, получает только четыреххлористый углерод, 2-я – четыреххлористый углерод + дипсакозид-1, 3-я группа – четыреххлористый углерод + дипсакозид-2, 4-я группа – четыреххлористый углерод + гепадип.
Лечение гепатита начинают через 24 часа после введения яда, препараты вводят через рот, один раз в день натощак в дозе 10 и 50 мг/кг в течение 6 дней. Желчь собирали в течение 4 часов под этаминоловым наркозом (50 мг/кг) при помощи канюли из полиэтилена, вставленной в желчный проток. Во всех опытах учитывали общее количество желчи, полученной за 4 часа, затем определяли концентрацию (мг/ %) и общее количество (мг на 100г массы тела животных) билирубин по методу Н.П. Скакуна, 1956 [13], суммарное содержание желчных кислот и холестерин по методу В.П. Мирошниченко и др., 1973 [14]. В динамике изучают желчеотделение, содержание билирубина желчных кислот и холестерина, которые являются маркерами функционального состояния печени. При введении СС14 (четыреххлористый углерод) происходит нарушение экстрактной функции печени: интенсивность секреции желчи через 4 часа после введения СС14 снижается в 1,3 раза, через сутки в 1,2 раза. Изменяется и химический состав желчи: содержание желчных кислот снижается в 1,3 раза, билирубина в 1,1 раз, холестерина в 1,2 раза.
На 6 сутки эксперимента после введения СС14 содержание билирубина, желчных кислот и холестерина остается без существенных изменений и происходит достоверное уменьшение секреции желчи, что говорит о выраженном нарушении экскреторной функции печени и химического состава желчи при остром гистотоксическом гепатите, вызванном введением четыреххлористого углерода. Пероральное введение дипсакозида-1, дипсакозида-2 и гепадипа в дозе 50 мг/кг животным с острым гистотоксическим гепатитом способствует нормализации секреторной функции печени и химического состава желчи, что говорит о гепатопротекторном действии. Результаты проведенных исследований приведены в таблице.
Эти данные показывают, что у гепадипа гипохолестеринемическая активность по сравнению с дипсакозидами выше почти на 10 %, а выделение желчных кислот превышает почти в полтора раза, и высокое выделение билирубина объясняется тем, что в рецептуру гепадипа входят цветки бессмертника.
Заключение
Проведенные исследования показали, что препарат гепадип является практически нетоксичным препаратом. Гепадип у крыс с острым экспериментальным гепатитом способствует нормализации экскреторной и желчевыделительной функции печени, увеличивает секрецию желчи, выделение холестерина и билирубина, общих желчных кислот, нарушенного при гепатите, т.е. препарат обладает антиатеросклеротической, гепатопротекторной и желчегонной активностью.
Библиографическая ссылка
Жумалиева Н.Ж., Кадыралиев Т.К., Акималиев А.А., Шалпыков К.Т., Курманов Р.А. ЭКСПЕРИМЕНТАЛЬНОЕ ИССЛЕДОВАНИЕ, ХАРАКТЕРИЗУЮЩЕЕ СПЕЦИФИЧЕСКУЮ АКТИВНОСТЬ ДИПСАКОЗИДА И ГЕПАДИПА // Международный журнал прикладных и фундаментальных исследований. – 2017. – № 12-1. – С. 63-68;URL: https://applied-research.ru/ru/article/view?id=11964 (дата обращения: 26.04.2024).

