На сегодняшний день остается актуальной проблема разработки эффективных методов лечения больных наркоманией. Это связано в первую очередь с большой распространенностью заболевания и трудностью его излечивания [1, 2]. Проблема эффективного лечения наркомании не решена ни в нашей стране, ни за рубежом. Задача усложняется высокой частотой возникновения рецидивов болезни [3]. Из 7-миллиардного населения планеты, по данным ВОЗ, злоупотребляют наркотиками 3 % людей, что составляет 210 миллионов человек [4]. Поэтому столь актуально создание эффективных и безопасных лекарственных препаратов для лечения наркозависимости. Существует два подхода в противорецидивном лечении наркомании. Первый – это традиционный с использованием препаратов блокаторов опиатных рецепторов (при опиоидной зависимости). Второй подход включает заместительную терапию (бупренорфин, метадон) [5]. Лечение блокаторами опиатных рецепторов является недостаточно эффективным в долгосрочной перспективе и имеет много побочных эффектов на ЦНС. Заместительная терапия требует длительного, порой пожизненного лечения. Она сопровождается побочными эффектами, связанными с высокой аддиктивностью препаратов. Разработка вакцин, снижающих патологию зависимости к наркотическим веществам – это принципиально новый подход в лечении наркомании [6, 7]. Принцип действия вакцин против наркомании основан на образовании антител, связывающих психоактивные вещества, попадающие в кровоток человека. Такие молекулы способны действовать в организме на периферическом уровне. Они препятствуют проникновению наркотиков сквозь ГЭМ барьер в мозг, снижая при этом их токсическое действие. Новая терапия безопаснее, чем существующие способы противорецидивного лечения наркомании. К настоящему моменту учеными ряда мировых научных школ активно проводятся исследования в этой области. Так, известны разработки по созданию вакцин против различных групп наркотиков, главным образом опиатов [8] и кокаина [9]. Отличительная особенность разработанных препаратов заключается в использовании различного вида инновационных адъювантов для усиления иммунного ответа и повышения эффективности препарата [10].
Целью данного исследования являлась разработка технологии получения и оценка активности субстанции иммуногена терапевтической вакцины для противорецидивного лечения зависимости от наркотических веществ группы опия.
Материалы и методы исследования
Для проведения биохимических и иммунохимических исследований применяли следующие материалы и методы. Кроличья сыворотка против морфина, конъюгаты антител овцы против Ig кролика, меченых ферментом, ТМБ, пироксид водорода 10 %, детергентТV-20, водорастворимый карбодиимид (1-циклогексил-3-(2-морфолинодиэтил)-карбодиимида–мета-N-толуол-сульфокислоты) «Sigma» (США). Гамма-глобулин, альбумин сыворотки крови человека ФГУП НПО Микроген (Россия). Иммуноферментный анализ проводили на высокосорбционных планшетах «Nunc» (Дания). Результаты иммуноферментного анализа измеряли спектрофотометрически при 450 нм. Выделение синтетического иммуногена проводили хроматографией на колонке (2x50 см) с Sephadex G-25 в хроматографической системе Pharmacia (Швеция). Элюирование выполняли двукратно фосфатным буфером рН 7,2 со скоростью 50 мл/ч. Контроль хроматографического процесса осуществляли путем измерения концентрации белка при длине волны 280 нм в спектрофотометре Genesys 10UV (ThermoFisherScientific, США). Количество молекул гаптена, присоединенных к белку, определяли по методу разработанному ранее [4]. Белок в растворах определяли методом Бредфорда с использованием реагента фирмы «Sigma» (США).
Получение конъюгата морфина с гамма-глобулином человека (М-ГГЧ). К раствору 15 мг (1,3х10-3 ммоль) гамма-глобулина в 3 мл дист. воды прибавили в жидком виде 3,9 мг (0,01 ммоль) 6-о-гемисукцинат морфина, полученного по методу [8], в 1 мл ДМФА, охладили реакционную смесь до 0 °С и при перемешивании прибавили 5 мг водорастворимого карбодиимида. Реакционную смесь выдерживали в течение 12 час в холодильнике, фильтровали выпавший осадок и хроматографировали на Сефадексе G-25 полученный конъюгат. Количество связанного морфина определяли сравнением УФ-спектров белка и полученного конъюгата при 280 нм. По данным УФ-спектров в полученном конъюгате было 9 молей морфина на моль белка.
Получено 13 мг (90 %) конъюгата морфина с гамма-глобулином (М-ГГЧ), содержащего 9 молей морфина на моль белка.
Для получения М-ГГЧ, содержащего 17 молей морфина на моль белка, синтез проводили аналогично описанному выше, однако. к раствору 30 мг (2,5х10-3 ммоль) гамма-глобулина в 10 мл дист. воды прибавили в жидком виде 15,1 мг (0,04 ммоль) вещества производного 6-О-гемисукцинат морфина в 1,5 мл ДМФА, далее аналогично. Получено 27 мг (91 %) конъюгата морфина с гамма-глобулином (М-ГГЧ), содержащего 17 молей морфина на моль белка.
Получение конъюгата морфина с сывороточным альбумином человека (М- ЧСА). Синтез конъюгата морфина с сывороточнымальбумином человека (М-ЧСА) проводят аналогично описанному выше. При этом используют раствор 50 мг (0,08 ммоль) сывороточного альбумина человека (ЧСА) в 15,0 мл дист. воды приливали 3,1 мл ДМФА, содержащего 25 мг (0,063 ммоль) 6-о-сукцинилморфина. Далее по каплям в охлажденном состоянии добавляли раствор 18,9 мг (0,054 ммоль) карбодиимда растворенного в 3 мл дист. воды. Смесь продуктов реакции выдерживали 5 час при 4 °С. Образовавшийся конъюгат хроматографировали на колонке с сефадексом G-25 и лиофильно высушивали. Получено 42 мг (85 %) конъюгата (М-ЧСА), содержащего 15 молей морфина на моль белка.
Получение комплекса синтетического иммуногена М-ГГЧ с полимерным носителем-(4-нитрофенил)акрилатом (ПНФА). К раствору 6 мг ПНФА (м.в. 40 000) в 1,5 мл диметилформамида (ДМФ) добавляют по каплям при перемешивании раствор 3,8мг конъюгата М-ГГЧ (соотношение белок :гаптен 1:9) в 500 мкл фосфатно-солевого буфера, рН 7,2. Реакционную смесь выдерживают в течении суток при 20 °С, добавляют 20 мкл 25 %NH3. Проводят выпаривание в вакууме растворителя и промывку эфиром остатка. В результате проведенного синтеза получают комплекс, имеющий замещение 10:1 полимерной матрицы конъюгатом морфина гамма-глобулин человека. Контроль за степенью замещения полимерной матрицы осуществляют спектрофотометрически по количеству образовавшегося в процессе реакции п-нитрофенола.
Получено 5,5 мг (90 %) комплекса с конъюгатом морфин гамма-глобулин человека (М-ГГЧ соотношение белок: гаптен 1:9) с замещением полимер- (М-ГГЧ) 1:10.
Аналогично описанному выше проводят синтез, используя в качестве исходного соединения 5 мг поли-(4-нитрофенил)акрилата в 1 мл ДМФ и 4 мг конъюгата М-ГГЧ (соотношение белок: гаптен 1:17) в 800 мкл фосфатно-солевого буфера, рН 7,2. Получено 4,2 мг (94 %) комплекса с конъюгатом морфин гамма-глобулин человека (М-ГГЧ соотношение белок: гаптен 1:17) с замещением полимер-(М-ГГЧ) 1:10.
Получение комплекса синтетического иммуногена М-ЧСА с полимерным носителем ПНФА. Аналогично описанному выше проводят синтез, используя в качестве исходного соединения 10 мг ПНФА в 4 мл ДМФ и 4 мг конъюгата М-ЧСА (соотношение белок: гаптен 1:15) в 1 мл фосфатно-солевого буфера, рН 7,2. Получено 8,7 мг (89 %) комплекса с конъюгатом морфина с сывороточным альбумином человека (М-ЧСА соотношение белок: гаптен 1:15) с замещением полимер – (М-ЧСА) 1:4.
Аналогично описанному выше проводят синтез, используя в качестве исходного соединения 12 мг поли-(4-нитрофенил)акрилата (м.в. 40 000) в 4 мл ДМФ и 8 мг конъюгата М-ЧСА (соотношение белок: гаптен 1:15) в 1,5 мл фосфатно-солевого буфера, рН 7,2. Получено 10,7 мг (90 %) комплекса с конъюгатом морфина с сывороточным альбумином человека (М-ЧСА соотношение белок: гаптен 1:15) с замещением полимер- (М-ЧСА) 1:10.
Оценку активности и специфичности полученных синтетических иммуногенов проводили методом ИФА. По результатам ИФА проводили индивидуальную оценку взаимодействия каждого из указанных выше иммуногенов с антиморфиновыми антителами. Далее строили кривые зависимости значения оптической плотности (OD450) в ИФА от концентрации для каждого варианта конструкции полученного иммуногена. Полученные данные обработали статистически с оценкой достоверности результатов, применяя t-критерий Стьюдента. Диапазон выбранных концентраций, в котором наблюдается прямо пропорциональная зависимость оптической плотности в ИФА от концентрации иммуногена, представлен в табл. 1.
Иммуногенная активность и способность продуцировать специфические антитела была изучена в опытах на крысах породы Wistar, самцы, в возрасте 6–7 недель. Иммуноген и конъюгат М-ГГЧ, используемый в качестве контроля сравнения, вводили по 4 раза, на 0, 7, 14 и 21 день, внутримышечно, в объеме 0,2 мл на крысу. Забор крови проводили непосредственно перед вакцинацией на 0, 7, 14, 21 и 35 дни путем иссечения подъязычной вены в объеме 1–1,5 мл. Титр анти-морфиновых антител и их специфичность определяли методом ИФА. Строили кривые титрования для каждой порции сыворотки – зависимость оптической плотности от разведения сыворотки. Рассчитывали при этом титр сыворотки, принимая разведение, при котором достигается 50 % сигнала (ОПmax – ОПmin)/2. Для каждой группы были рассчитаны средние геометрические обратных титров антител (1/титр) и доверительные интервалы их значений при 95 % вероятности.
Результаты исследования и их обсуждение
Принципиальная новизна конструирования вакцин состоит не только в создании искусственных макромолекул, обладающих необходимыми антигенными детерминантами, но и в возможности регулировать активность этих молекул. Иммуногенность вакцинного препарата зависит от ряда параметров, в первую очередь от антигенной структуры субстанции, а для низкомолекулярных антигенов (гаптенов) – от их эпитопной плотности. Конструкция разработанного синтетического иммуногена представляет комплекс, состоящий из конъюгата низкомолекулярного наркотического соединения группы опия (гаптена морфина) присоединенного к природному белку, который в свою очередь связан с матрицей полимера (4-нитрофенил)акрилатом (ПНФА). Макромолекулярный носитель конъюгата – это сывороточный белок крови человека. А именно, гамма-глобулин человека ГГЧ и человеческий сывороточный альбумин ЧСА. Их использование минимизирует побочные реакции при вакцинации. При выборе конструкции синтетического иммуногена изучено связывание различных комбинаций перечисленных выше конъюгатов и полимерной матрицы. Первоначально осуществлено получение карбоксилсодержащего производного морфина путем взаимодействия с янтарным ангидридом в абсолютированном растворителе [4]. Далее в присутствии водорастворимого карбодиимида проведено ковалентное связывание спейсер-содержащего морфина с указанными макромолекулярными носителями. В полученных конъюгатах соотношение морфина и макромолекулярного носителя составляет 9–17 молей гаптена на 1 моль носителя. Следующей стадией синтеза иммуногена являлось присоединение полученного конъюгата к полимерной матрице – ПНФА с последующей деактивацией п-нирофенильных групп путем введения раствора аммиака. Присоединение конъюгата к полимеру соответствовало 4–10 молям макромолекулы на моль ПНФА. Схема синтеза комплекса иммуногена на примере конъюгата с ГГЧ приведена на рис. 1.
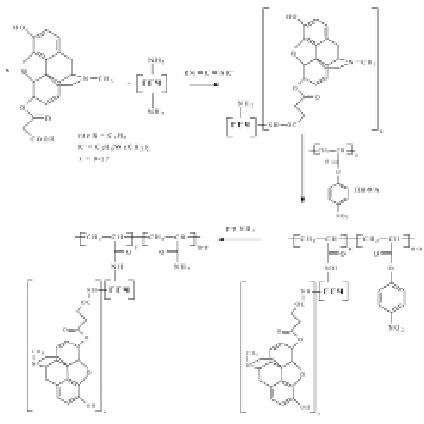
Рис. 1. Схема синтеза комплекса синтетического иммуногена М-ГГЧ с полимерным носителем ПНФА
В синтезированных иммуногенах, являющихся прототипом субстанции вакцины, проводили оценку антигенных участков связывания с точки зрения их специфичности и доступности. Для этого использовали метод иммуноферментного анализа (ИФА). В качестве инструмента выбрана иммунная сыворотка, содержащая антитела к опиатам. Для каждого варианта конструкции синтетического иммуногена выбирали диапазон концентраций, при котором наблюдается прямо пропорциональная зависимость изменения OП450 в ИФА от разведения антигена, иммобилизованного на планшете (таблица).
Иммуноферментный анализ специфических антител для различных вариантов синтезированных иммуногенов
|
№ п/п |
КМНГ – конъюгат макромолекулярного носителя с гаптеном |
Соотношение гаптен: носитель |
Соотношение полимер: КМНГ |
Оптимальные концентрации комплекса синтетического иммуногена в ИФА, мкг/мл |
|
1 |
М-ГГЧ |
17:1 |
1:10 |
1–8 |
|
2 |
М-ГГЧ |
9:1 |
1:10 |
1–5 |
|
3 |
М-ЧСА |
5:1 |
1:10 |
1–3 |
|
4 |
М-ЧСА |
15:1 |
1:10 |
1–4 |
|
5 |
М-ЧСА |
15:1 |
1:4 |
1–2 |
Для иммуногенов, состоящих из конъюгатов ГГЧ, содержащих гаптен в соотношении 9–17 молей морфина на моль ГГЧ, установлен оптимальный диапазон концентраций 1–8 мкг/мл для комплекса № 1 и 1–5 мкг/мл для комплекса № 2. Установлено, что антигенные детерминанты доступны для взаимодействия с антителами и не экранируются при получении комплекса с синтетическим полимерным носителем при соотношении 1:10 соответственно. Наиболее важное значение в этом случае имеет исходное насыщение гаптеном ГГЧ. Так при сравнении результатов ИФА, полученных при выборе диапазона концентраций для комплексов (№ 1 и № 2), в состав которых входят конъюгаты ГГЧ с содержанием морфина в соотношении 9 и 17 молей гаптена на моль белка, наблюдается сужение диапазона концентраций (1–5 мкг/мл). Эти факты свидетельствуют о снижении доступности антигенных детерминант для связывания с антителами. Аналогичные исследования выполнены для комплексов № 3, 4 и 5, состоящих из конъюгатов ЧСА, содержащих в своем составе 5 и 15 молей гаптена на моль ЧСА. Для комплекса № 3 отмечено сужение интервала концентраций в ИФА по сравнению с иммуногеном № 4. Исследованы комплексы, различающиеся соотношением связывания с синтетическим полимером (1:10 для комплекса № 4 и 1:4 для комплекса № 5). Установлен оптимальный диапазон концентраций в ИФА, составляющий 1–4 мкг/мл и 1–2 мкг/мл соответственно. Полученные результаты показывают сужение диапазона концентраций в два раза при более низком связывании с полимером, что свидетельствует об изменении доступности антигенных детерминант.
Иммуногенная активность и способность продуцировать специфические антитела была изучена в опытах на животных (крысы) для комплекса конъюгата (М-ГГЧ в соотношении 17:1) с замещением 1:10 полимерной матрицы. Сравнивали способность конъюгатов М-ГГЧ и комплексов М-ГГЧ-полимер вызывать выработку антител у животных. Обратные титры антител, полученные при иммунизации конъюгатами и комплексами в двух дозах, представлены на рис. 2.
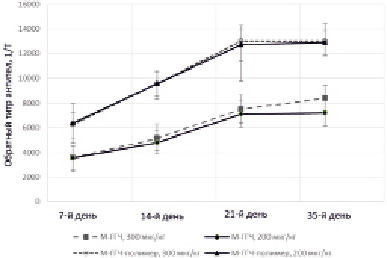
Рис. 2. Обратный титр антител при иммунизации комплексом М-ГГЧ-полимер и конъюгатом М-ГГЧ (средняя геометрическая обратного титра антител ± 95 % доверительный интервал)
Установлено, что иммунизация животных комплексом полимера и конъюгата, обеспечивает более высокий титр антител при меньших дозах введения. Титр антисыворотки на 35-й день при дозе М-ГГЧ 300 мкг/кг составил в среднем 1/8280, а при введении 200 мкг/кг М-ГГЧ-полимер титр достиг большего значения (в среднем 1/12350) уже на 21-й день от начала иммунизации. Использование разработанного иммуногена позволяет снизить вводимую дозу и достичь высокого титра антител, применяя меньшее количество иммунизаций.
Таким образом, при разработке синтетического иммуногена вакцины для лечения опиоидной наркозависимости выбраны и оптимизированы основные параметры конструкции иммуногена. Установлены соотношения гаптена, который является эпитопом выработки специфических антител, макромолекулярного носителя и полимерной матрицы. По результатам ИФА определена доступность и специфичность эпитопов синтетических иммуногенов. Оптимальный диапазон взаимодействия белка и гаптена (морфин) при получении иммуногена находятся в соотношения 9–17 (для гамма-глобулина человека) и 5–15 (для сывороточного альбумина человека) молей гаптена на моль белка. При этом связывание полимера с конъюгатом составило от 1:4 до 1:10. Комплексы данного состава будут использоваться в дальнейшей разработке лекарственного средства при проведении доклинических исследований.
Библиографическая ссылка
Мягкова М.А., Петроченко С.Н., Орлова Е.А. ТЕХНОЛОГИЯ СИНТЕЗА СУБСТАНЦИИ ИММУНОГЕНА ДЛЯ ПРОТИВОПИАТНОЙ ВАКЦИНЫ // Международный журнал прикладных и фундаментальных исследований. – 2018. – № 5-2. – С. 400-405;URL: https://applied-research.ru/ru/article/view?id=12277 (дата обращения: 19.04.2024).

