В нашей работе осуществлены поиск и видоидентификация термофильных бактерий в Псекупском месторождении минеральных вод.
Псекупское месторождение минеральных вод находится в южной части территории г. Горячий ключ. Город расположен в 65 км к юго-востоку от краевого центра г. Краснодара в предгорье Кавказского хребта в долине реки Псекупс. Местность в районе месторождения имеет сложное геологическое строение и находится на стыке предгорий Кавказа и Прикубанской низменности. Источниками сульфатных вод Псекупского месторождения являются высокотермальные воды нижнемеловых отложений, разгружающиеся по отдельным тектонически ослабленным зонам. Смешение этих вод с более холодными поверхностными водами в различных соотношениях приводит к большому разнообразию состава вод в различных скважинах данного месторождения [1]. Данная ситуация является уникальным случаем и представляет собой очень интересную для исследований нестабильную и динамически меняющуюся экологическую нишу, где экстремальные термофилы, преимущественно анаэробы, попадают в аэробные и значительно менее минерализованные условия с пониженной до 50–60 °С температурой, а преимущественно аэробы из холодных поверхностных вод попадают в условия нехарактерных для них высоких температур и минерализации. На выходе минерального источника имеется совершенно новое, активно расселяющееся по опустевшей экологической нише микробиологическое сообщество, оптимизированное под создавшиеся в процессе смешивания вод условия.
Потребление минеральной воды Псекупского источника благотворно сказывается на здоровье человека при различных заболеваниях. Принято считать, что полезные свойства минеральной воды обусловлены исключительно её минеральным составом, однако мы предположили, что микробиологический состав воды также может влиять на профилактические и терапевтические свойства воды. На пути к проверке этой гипотезы было принято решение изучить максимально представленные аэробные виды, способные некоторое время поддерживать жизнеспособность в условиях ЖКТ человека.
Цель исследования: поиск и видоидентификация умеренно термофильных аэробных бактерий в Псекупском месторождении минеральных вод.
Материалы и методы исследования
В работе использовались: вода из Псекупского месторождения минеральных вод г. Горячий Ключ (Россия, Краснодарский край) (рис. 1).
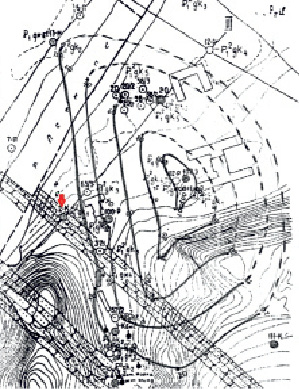
Рис. 1. Схема Псекупского месторождения [2] и расположение места пробоотбора – источника «2-к» (красная стрелка)
Вода из источника «2-к» была собрана 15.08.2015 в стерильную посуду и доставлена в место проведения эксперимента.
Непосредственно перед экспериментом была приготовлена среда LB [3] с модификациями, оптимизированная для роста умеренно термофильных аэробов (О.К. Кабоев, устное сообщение).
Образцы воды из источника были пропущены через бактериальную мембрану размером пор 25 µm c использованием максимального давления фильтрации до 67 psi для концентрирования бактерий. На каждые 150 мл воды был использован один фильтр. Мембрана с микроорганизмами была перенесена на питательную среду и далее микроорганизмы выращивались в термостате на температуре 60 °С. Эта температура сходна с температурой в горячем источнике и позволяет подавить рост других бактерий и грибов, которые могут попасть в образец в результате его возможного загрязнения.
Далее образцы колоний были расштрихованы для получения чистой культуры (рис. 2).
Соскоб культуры размером со спичечную головку ресуспендировали в 300 мкл дистиллированной воды, замораживали при температуре –70 °С, а затем нагревали до 96 °С в течение 15 мин. Остатки клеток и свернувшиеся белки удаляли центрифугированием (10 мин, *10000 g).
Постановка ПЦР: объем реакционной смеси – 20 мкл на пробирку. Состав реакционной смеси для ПЦР с праймерами к последовательности 16S рДНК: 1х буфер для Taq-полимеразы, 2,5 мМ магния хлорид, 0,125 мМ трифосфаты нуклеотидов 0,25 мкМ праймер прямой, 0,25 мкМ праймер обратный, 0,125 е.а./мкл Taq-полимераза, 0,2 % БСА.
Использовали праймеры 16SF: GTGCCAGCMGCCGCGGTAA; 16SR: GGACTACVSGGGTATCTAAT [4].
Реакцию проводили по программе: начальная денатурация – 94 °С (5 мин), далее 45 циклов: 94 °С (18 с), 50 °С (40 с), 72 °С (40 с), финальная элонгация – 72 °С (5 мин). Анализ результатов ПЦР произведен методом электрофореза в агарозном геле. Продукты ПЦР-реакции были секвенированы. Обработка сиквенсов производилась с использованием программы «Mega5». Последовательность праймера длиной 19 нуклеотидов из сиквенса вычиталась и в дальнейшем анализе не использовалась.
Анализ сиквенса производился путем поиска гомологичных последовательностей с помощью базы данных NCBI.
В случае, если полученный сиквенс был одинаково похож на последовательности бактерий разных видов, определение производилось только до рода. Такое ограничение связано с малой длиной ампликона, из-за чего у достаточно близкородственных бактерий может не быть различий в последовательности 16S рДНК в пределах участка-мишени.
Результаты исследования и их обсуждение
В ходе выполнения работы получены концентрированные образцы природных организмов, обитающих в Псекупском месторождении минеральных вод. После высева образцов на культуральную среду были получены одиночные колонии, позже расштрихованные для получения чистой культуры (рис. 2).
Была проведена ПЦР с праймерами к таксономически значимыми районам 16S рДНК, ПЦР продукты были секвенированы.
Рис. 2. Расштрихованные образцы с колоний
В ходе исследования были обнаружены термофильные бактерии следующих таксономических единиц:
Ureibacillus thermosphaericus, Geobacillus sp., Bacillus licheniformis, Bacillus borbori, Streptomyces sp
На рис. 3 и 4 сиквенсы, представленные ниже (Query), получены в ходе работы.
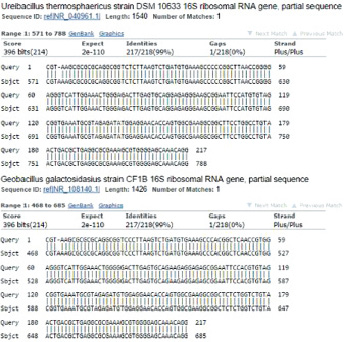
Рис. 3. Результаты поиска гомологичных последовательностей в базе данных NCBI. Выявлена гомология последовательностей к 16S рДНК Ureibacillus и Geobacillus

Рис. 4. Результаты поиска гомологичных последовательностей в базе данных NCBI. Выявлена гомология последовательностей к 16S рДНК Bacillus и Streptomyces
Sbjct – последовательность из базы.
Bacillus licheniformis – грамположительная мезофильная спорообразующая бактерия. Широко представлена в разнообразных сообществах, в частности в почве. Выделялась также и из вод разнообразных горячих источников. Данные бактерии являются продуцентами высокоэффективных антибиотиков, в частности бацитрацина – циклопептидного антибиотика, эффективно действующего на грамположительную патогенную микрофлору, в частности на стрептококки и стафилококки.
Еще одной интересной особенностью этих бактерий является способность продуцировать ферменты, разрушающие внеклеточную ДНК (extracellular DNA, eDNA) [5]. Внеклеточная ДНК является важным компонентом внеклеточного матрикса, участвующего в построении биопленок различных видов бактерий, включая патогенные штаммы. Одним из примеров подобного рода является зубной налет [5]. В экспериментах in vitro фермент, выделенный из Bacillus licheniformis, разрушал существующие биопленки бактерий, вызывающих появление зубного налета, а также препятствовал образованию новых. Бактерии рода Bacillus довольно характерны для горячих источников, в частности они обнаружены в водах источников Горячий ключ (Приморский край, Россия) и Чистоводное (Приморский край, Россия) [6].
Из бактерий вида Streptomyces globisporus рода Streptomyces выделяют аминогликозидный антибиотик стрептомицин. Этот антибиотик используется для лечения туберкулеза в различных локациях, венерической гранулемы, туляремии, бруцеллеза, чумы, кишечных инфекций, инфекций мочевыводящих путей и бактериального эндокардита [7].
Интересно отметить, что очень похожий состав бактериальных сообществ получен для высокотемпературных компостов [8]. Важно подчеркнуть, что эти бактерии (Bacillus sp., Ureibacillus sp. и др.) в указанной работе обнаружены в среде, в которой температура почти на 20 °С превышает максимальные для роста данных бактерий температуры.
Как и предполагалось, экстремальных термофилов обнаружено не было. Подтверждена высокая биологическая активность обнаруженных микроорганизмов, многие из них являются источниками высокоэффективных антибиотиков и обладают активностью к разрушению биопленок. Таким образом, микробиота минеральных вод Псекупского источника проявляет выраженные антимикробные свойства и не исключено, что профилактические и терапевтические её свойства связаны с микробиологическим составом. В случае дальнейшего подтверждения этого тезиса необходимо будет пересматривать способы подготовки, сроки и варианты использования бутилированной минеральной воды и рассматривать минеральную воду в качестве пробиотического препарата. На настоящий момент максимальный титр жизнеспособных бактериальных клеток в минеральной воде для внутреннего применения жестко нормируется ГОСТ Р 54316-2011 «Воды минеральные природные питьевые. Общие технические условия», а для выполнения этих требований производителями нередко применяются жесткие методики обеззараживания (включая обработку ультрафиолетом) и глубокую фильтрацию.
Все идентифицированные бактерии выделены в виде чистых культур и поставлены на хранение, что дает возможности для их дальнейшего изучения.
Выводы
В Псекупском месторождении минеральных вод обнаружены термофильные микрорганизмы родов Ureibacillus, Geobacillus, Bacillus, Streptomyces. Показана потенциальная антимикробная активность минеральной воды, в том числе к патогенным бактериям формирующим биопленки.
Авторы работы выражают искреннюю благодарность В.Ю. Богомаз и П.В. Фомину за помощь в получении материала, а также за всестороннюю помощь и поддержку.
Библиографическая ссылка
Богомаз О.Д., Владимиров И.А., Павлова О.А., Богомаз Д.И. ИЗУЧЕНИЕ РАЗНООБРАЗИЯ ТЕРМОФИЛЬНЫХ БАКТЕРИЙ ИЗ ПСЕКУПСКОГО МЕСТОРОЖДЕНИЯ ТЕРМАЛЬНЫХ ВОД // Международный журнал прикладных и фундаментальных исследований. 2019. № 5. С. 9-14;URL: https://applied-research.ru/ru/article/view?id=12729 (дата обращения: 18.11.2025).
DOI: https://doi.org/10.17513/mjpfi.12729

