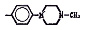
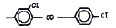В настоящем сообщении приводятся экспериментальные данные поиска радиопротекторов (РП), эффективных при защите лабораторных животных от ионизирующего γ-излучения в сублетальных и летальных дозах 6–11 Гр. За период эволюции живые организмы Земли адаптировались к действию радиации в малых дозах природного радиационного фона, и для нормальной жизнедеятельности им даже необходимо такое постоянное фоновое облучение [1], но высокие дозы γ-излучения вызывают быстрые и существенные нарушения на различных уровнях организации живого организма и приводят к его старению и гибели. Облучению γ-радиацией в высоких дозах подвергаются космонавты при работе в открытом космосе, ликвидаторы при авариях на АЭС и подводных лодках. Этот вид γ-излучения вызывает возбуждение множества видов органических молекул, их ионизацию и последующее возникновение активных форм свободных радикалов, которые дают начало цепным реакциям перекисного окисления, нарушающим различные ферментативные процессы в клетке и физиологические системы живых организмов, первичное воздействие γ-излучение оказывает на рецепторы, липиды, белки и ионный гомеостаз клеточных мембран. Считается, что структура ДНК является более радиорезистентной, чем биомембраны.
Поиск радиозащитных средств продолжается уже более шести десятилетий, однако имеющиеся препараты еще недостаточно эффективны и обладают некоторой токсичностью. В ряде обзоров и монографий [2–4] приводятся методы исследования и различные механизмы действия РП, однако лишь в отдельных публикациях приводятся данные, свидетельствующие о том, что РП могут влиять на энергетику клетки. Было показано, что радиозащитными свойствами могут обладать аминотиолы (β-меркаптоэтиламин, цистеамин, цистеин и др.), снижающие аэробное образование энергии в клетках тимуса крыс и ингибирующие деление клеток при связывании аминотиолов с белками [5]. Нами было предположено, что молекулярным механизмом радиозащитного эффекта некоторых химических соединений при введении их до γ-облучения может быть временное ингибирование образования энергии, возникающее при разобщении процессов окислительного фосфорилирования (ОФ) АДФ при синтезе макроэргических молекул АТФ и биологического терминального окисления питательных веществ в энергетических станциях клетки – митохондриях (Мх), следствием чего может являться торможение клеточного метаболизма и снижение вследствие этого концентрации образующихся при облучении активных свободных радикалов органических молекул [6]. Молекулярный механизм ферментативного синтеза АТФ за счет трансмембранного потенциала, возникающего в результате переноса протонов из Мх в цитоплазму клетки при реакциях дыхания в дыхательной цепи внутренней мембраны Мх, был предложен в хемиосмотической гипотезе П. Митчела (1961–1966). В наших экспериментальных работах были получены некоторые доказательства этого механизма [7, 8]. С помощью меченых изотопов жирорастворимых анионов и катионов впервые была измерена максимальная величина трансмембранного потенциала 350–400 мв в Мх. Показано уменьшение этого потенциала при синтезе АТФ и разобщителями ОФ с гидроксильной группой и донорно-акцепторными свойствами, способными переносить протоны через мембраны внутрь Мх. В качестве разобщителей ОФ и потенциальных радиопрофилактических средств в данной работе были исследованы анилиды салициловой кислоты с подобными свойствами, в которой гидроксил карбоксильной группы замещен фениламидной группой. В их химической структуре имеются галогенные заместители, дополнительные бензольные кольца и другие структуры. В медицинской практике применяются ЗСА, оказывающие противопаразитарное действие – тегалид, никлозамид, рафоксанид, клозантел и дизофенол, эти препараты нарушают энергетический обмен и передачу нервного импульса фасциол [9, 10]. Разобщение ОФ и дыхания в Мх ленточных червей, улиток и опухолевых клеток с помощью ЗСА, показанное зарубежными авторами на примере никлозамида, было обнаружено нами ранее для препаратов из класса двухосновных кислот (ДОК) [7]. Природные фенольные соединения (кверцетины, рутин, катехины и др.), синтетический ионол, группа ДОК являются слабыми разобщителями ОФ и дыхания в Мх, но проявляют высокую антиоксидантную активность [8, 11] и могут быть использованы как эффективные РП после облучения животных.
Цель исследования: определить радиозащитную активность ряда ЗСА при введении препаратов до γ-облучения лабораторных животных (мышей) в сублетальных и летальных дозах 6–11 Гр и ее молекулярные энергетические и клеточные механизмы.
Материалы и методы исследования
Бислойные липидные мембраны (БЛМ) формировали по методу Мюллера из н-деканового раствора обших липидов бычьего мозга с концентрацией 20 мг/мл на отверствии тефлонового стаканчика диаметром 1 мм. Зависимость электропроводности мембран (Gm) от концентрации модификаторов измерялась в водной среде с 20 мМ трис-буфером. При измерениях Gm на мембрану подавалось постоянное напряжение 20 мв. Gm БЛМ определяли путем сравнения падения напряжения на БЛМ и на известном сопротивлении. Напряжение сравнения увеличивалось с помощью усилителя постоянного тока У5-6 с большим входным сопротивлением 1012 ом и регистрировалось автоматическим электронным потенциометром КСП-4, подключенным к выходу усилителя.
Митохондрии (Мх) выделяли методом дифференциального центрифугирования из печени крыс линии Вистар весом 150–180 г. Для изучения влияния препаратов на скорость дыхания использовали Мх в состоянии 4 с высоким дыхательным контролем, равным 4–5. Скорость дыхания Мх определяли по скорости уменьшения содержания кислорода в среде инкубации полярографическим методом в ячейке объемом 1 мл. Использовали среду инкубации следующего состава: 241 мМ сахароза, 20 мМ сукцинат натрия, 1 мМ ротенон, 1 мМ фосфат калия, 2 мМ хлорид магния, 1 мМ ЭДТА (двунатриевая соль), 56 мМ трис-НСl, рН 7,5. Содержание Мх в ячейке составляло 2–3 мг белка/мл по методу Лоури. Установка была собрана на основе полярографа Lp-7 с самописцем EZ-7.
Условия облучения. Для определения радиозащитного действия исследуемых соединений использовали белых беспородных мышей-самцов вивария ИБК РАН весом 20–22 г, отличающихся высокой радиорезистентностью. ЛД50/30 для них равняется 7,12–7,30 Гр. Облучение мышей производили на γ-установке биологического эксперимента (ГУБЭ) института, заряженной изотопом 60Со, в дозах 6–11 Гр при мощности дозы 2,92 Гр/мин.
Микровязкость мембран теней эритроцитов. В суспензию теней эритроцитов (150 мкг/мл белка) добавляли вначале исследуемое соединение ЗСА, а затем флуоресцентные зонды 2,6-ТНС, ДМХ для исследования структурных перестроек или ДФГТ для измерения микровязкости мембран. Концентрация зондов, вводимых в образцы, была для 2,6-ТНС 5–10 мкМ, для ДФГТ и ДМХ – 0,15 мкМ. Исследования проводили в 15 мМ фосфатном буфере, рН 7.4. Спектры флуоресценции зондов регистрировали на спектрофлуориметре MRF-44B, Perkin-Elmer (США). Время инкубации препарата и зондов ТНС, ДМХ 20 мин., ДФГТ – 1,5–2 ч. Все зонды были фирмы Fluca и Serva. Тени эритроцитов из крови крыс линии Вистар получали по методу Доджа. Гемолиз эритроцитов проводили в физрастворе с 1 мМ ЭДТА.
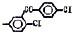
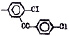
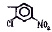
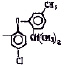
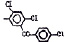
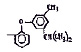
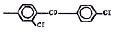
Исследованные соединения. В работе было исследовано 16 соединений из класса ЗСА, являющихся аналогами тегалида и имеющих различные заместители: галогенные (I, Br, Cl), метильные СН3, гидроксильные ОН-, NH и СООСН3-группы, бензольные кольца и другие структуры (таблица). Препараты были синтезированы Ф.С. Михайлицыным в Институте медицинской паразитологии Минздрава (г. Москва) с учетом наших рекомендаций. ЗСА вводили внутрибрюшинно лабораторным животным по 0,2 мл раствора за 1 час до облучения однократно. ЗСА растворяли в диметилсульфоксиде (ДМСО) фирмы Merck (ФРГ), который обладал низкой токсичностью на животных, хорошей растворимостью в нем препаратов ЗСА, слабыми радиозащитными свойствами и синергизмом при совместном действии с препаратами. При иссследовании влияния препаратов на Gm БЛМ и дыхание Мх объем растворителя в среде не превышал 2 %. Все исследованные препараты были очищены до степени о.с.ч. Статистическая обработка результатов исследований проводилась по критерию Стьюдента. Различия считались значимыми при р < 0,05.
Результаты исследования и их обсуждение
Радиозащитная эффективность ЗСА
Исходя из химической структуры соединений ЗСА с ОН-группами в основном бензольном кольце, галогенными заместителями в основном и дополнительных кольцах, было предположено, что молекулярным механизмом радиозащитного эффекта соединений может быть их разобщающее действие на нативных мембранах Мх, приводящее к ингибированию образования энергии в клетке. Разработанный нами на препаратах из класса двухосновных кислот «Комплексный биофизический экспресс-метод отбора потенциальных радиопротекторов» позволяет определять потенциальную радиопротекторную эффективность соединений на лабораторных животных на основании их активности (тестирования) на искусственных (БЛМ) и нативных (Мх) мембранных системах [12]. Соединения Г-1028, Г-992, Г-882 и Г-1021 показали наиболее высокую разобщающую активность, которая определялась по степени увеличения скорости поглощения кислорода (дыхания) Мх и по снижению соотношения скоростей разобщенного и сопряженного дыхания в присутствии препарата (дыхательного контроля), для них наблюдалась высокая радиозащитная эффективность. При внутрибрюшинном введении белым беспородным мышам за час до γ-облучения в летальной дозе 10 Гр различных концентраций этих препаратов (10-7–10-4 молей/кг живого веса) была выявлена их оптимальная радиозащитная концентрация 10-5 молей/кг живого веса на 30 сутки после облучения, при которой была отмечена высокая выживаемость животных 50–80 % (рис. 1), для других ЗСА она была меньше. При увеличении концентрации до 10-4 молей/кг живого веса радиозащита отобранных активных препаратов снижается на 10–20 %, в случае Г-1028 при 10-3 молях/кг живого веса она не наблюдается (рис. 1), что может быть связано с его токсичностью.
При оптимальной радиозащитной концентрации была выявлена высокая выживаемость мышей 80 % для наиболее эффективного препарата Г-992 (рис. 2, а), 70 % для тегалида и Г-882 (рис. 2, б), для менее эффективных препаратов Г-1028 и Г-1021 она составила 50 %, Г-947 – 45 %, а для малоэффективного Г-986 – 30 % (рис. 2. б). Наименее эффективными были препараты Г-1057 и Г-1024 с 20 % радиозащиты (рис. 2. а, б).
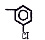
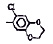
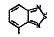
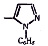
Химические структуры и шифры исследованных соединений ЗСА 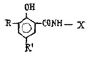
|
№ п/п |
Препарат, шифры |
ОН- |
R |
R1 |
Мол. вес |
Радикал Х |
|
1 |
Тегалид |
ОН |
Br |
Br |
544,4 |
|
|
2 |
Г-1028 |
ОН |
Br |
Cl |
498,5 |
|
|
3 4 |
Г-1032 Г-1057 |
ОН СООСН3 |
СН3 СН3 |
Cl Cl |
341,0 383,0 |
|
|
5 6 7 |
Г-1033 Г-1037 Г-988 |
ОН ОН ОН |
Br – I |
Cl Сl I |
509,0 430,0 647,6 |
|
|
8 |
Г-882 |
ОН |
Br |
Br |
405,5 |
|
|
9 |
Г-944 |
ОН |
Br |
Br |
463,5 |
|
|
10 |
Г-947 |
ОН |
– |
Cl |
305,8 |
|
|
11 |
Г-970 |
ОН |
Br |
Br |
461,0 |
|
|
12 |
Г-986 |
ОН |
Br |
Br |
578,5 |
|
|
13 |
Г-1021 |
OH |
Br |
Br |
544,0 |
|
|
14 |
Г-992 |
ОН |
Cl |
Cl |
430,3 |
|
|
15 |
Г-1024 |
NH |
I |
I |
636,0 |
|
|
16 |
Г-889 |
ОН |
– |
– |
311,0 |
|
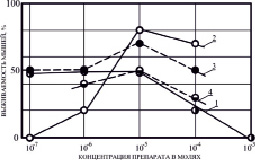
Рис. 1. Зависимость выживаемости мышей от концентрации некоторых ЗСА. 1 – Г-1028, 2 – Г-992, 3 – Г-882, 4 – Г-1021. Препараты вводились внутрибрюшинно растворенными в ДМСО за час до облучения в дозе 10 Гр. Концентрация препарата в молях/кг живого веса животных
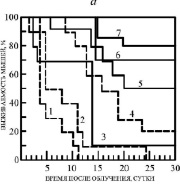
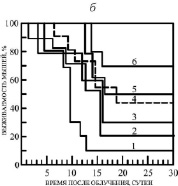
Рис. 2. а) Радиозащитное действие некоторых ЗСА. 1 – контроль (0,2 мл Н2О), 2 – ДМСО (0,2 мл), 3 – Г-970 (10 %), 4 – Г-1024 (20 %), 5 – Г-1028 (50 %), 6 – Г-882 (70 %), 7 – Г-992 (80 %). Препараты вводились внутрибрюшинно, растворенными в ДМСО, в концентрации 10-5 молей/кг живого веса, за час до облучения в дозе 10 Гр (рис. 6, а и б). б) 1 – Г-988 (10 %), 2 – Г-1057 (20 %), 3 – Г-986 (30 %), 4 – Г-947 (45 %), 5 – Г-1021 (50 %), 6 – тегалид (70 %) в концентрации 10-6 молей/кг живого веса
Все исследованные препараты обладали, таким образом, радиозащитными свойствами, за исключением Г-988 и Г-970, с которыми выживаемость была 10 %, как в контроле с ДМСО. В контрольных экспериментах с облучением без препаратов происходила 100 % гибель мышей через 11 суток и 90 % гибель – через 25 суток в случае введения животным воды и ДМСО (рис. 2, а, кривые 1, 2). Выявлено существенное увеличение продолжительности жизни выживших животных на 10-16 суток и снижение их гибели при введении ЗСА в ДМСО.
Достаточно эффективным препаратом оказался тегалид. К концу 30-дневного срока наблюдения выживаемость животных, получавших протектор, составляла в среднем 70 %, а средняя продолжительность жизни увеличивалась на 16 суток. Особенностью его действия является то, что достаточно высокая эффективность тегалида на Мх и радиозащитная эффективность наблюдалась при введении препарата животным в течение более широкого интервала времени 0,25–5,0 ч до γ-облучения, чем его аналоги (1 ч), максимальная разобщающая активность на Мх и радиозащитная эффективность – при введении за 1–3 ч.
Для определения радиобиологических показателей некоторых препаратов была исследована зависимость гибели мышей от дозы γ-облучения при введении их в концентрации 10-5 молей/кг живого веса в ДМСО за час до γ-облучения животных (рис. 3).

Рис. 3. Зависимость гибели мышей от дозы γ-облучения при введении ЗСА в ДМСО. 1 – контроль (0,2 мл воды), 2 – ДМСО (0,2 мл), 3 – Г-970, 4 – Г-1028, 5 – Г-992. На графике представлены результаты трех экспериментов
Величина ЛД50/30 в контроле была 7,12 Гр, для ДМСО – 8,6 Гр, для Г-970 – 9 Гр, Г-1028 – 10 Гр и Г-992 – 11 Гр. По наклону кривых судили о скорости изменения эффекта радиозащиты с возрастанием дозы облучения. По соотношению ЛД50/30 для растворителя ДМСО и препаратов к ЛД50/30 в контроле (вода) был определен фактор изменения дозы (ФИД): для ДМСО он равен 1,21, для Г-970 – 1,26, Г-1028 – 1,41, Г-992 – 1,54, при этом 50 % гибель мышей происходила при существенном увеличении дозы облучения. Протекторный индекс, учитывающий эффективность и токсичность радиопротектора, для ЗСА равен 15.
ФИД для тегалида, растворенного в ДМСО, в дозе 0,544 мг/кг живого веса составляет 1,51, в дозе 5,44 мг/кг – 1,56. Таким образом, десятикратное увеличение вводимой дозы данного потенциального радиопротектора существенно не увеличивает его эффективность. Для него характерна большая терапевтическая широта 108,8/5,44 = 20. Для тегалида отмечен высокий протекторный индекс = 95, для известного радиопротектора цистамина он равен 3,12.
Токсичность ЗСА определяли при внутрибрюшинном введении различных концентраций препаратов, вызывающих гибель белых беспородных мышей через 30 суток без облучения. При радиозащитной концентрации 10-5 молей/кг живого веса препараты ЗСА оказались нетоксичными и не вызывали гибели мышей, за исключением Г-988 и Г-1024, токсичность которых может быть связана с заместителями иода в основном бензольном кольце и хорошей проницаемостью мембран Мх из-за наличия двух дополнительных бензольных колец. Большинство препаратов не были токсичными при увеличении их концентрации до 10-3 молей (430–650 мг) /кг живого веса. Токсичность Г-1028 и Г-986 при этой концентрации могла быть связана с наличием заместителей хлора во втором и третьем бензольном кольце.
Молекулярный механизм радиозащитного действия ЗСА
Был исследован молекулярный механизм действия ЗСА на искусственных и нативных мембранных системах и его взаимосвязь с радиозащитным действием на лабораторных животных (белых беспородных мышах). Различными методами был показан разобщающий молекулярный механизм действия исследованных соединений, приводящий к ингибированию образования энергии при синтезе макроэргических молекул АТФ в Мх.
Во-первых, полярографическим методом были получены куполообразные кривые изменения скорости потребления кислорода (дыхания) митохондриями печени крыс при увеличении концентрации препаратов, добавленных после фосфорилирования АДФ. Вначале окисление субстрата (сукцината) приводило к увеличению стимуляции скорости разобщенного дыхания Мх по отношению к скорости сопряженного дыхания в состоянии 4, затем к увеличению обратимого ингибирования этой скорости при снижении концентрации кислорода. Дальнейшее увеличение концентрации препарата до 10-4–5 10-4 М приводит к необратимому ингибированию дыхания, при котором препарат становится токсичным.
В условиях in vivo при введении лабораторным животным соединений ЗСА в относительно низких нетоксических концентрациях 10-6–10-5 молей/кг живого веса разобщение процессов синтеза АТФ и дыхания, снижение образования энергии в Мх носило временный и обратимый характер. В контроле без облучения введение животным соединений ЗСА с высокой протонофорной и разобщающей активностью в нетоксических концентрациях стимулировало дыхание Мх, выделенных из печени крыс, снижало дыхательный контроль и разобщало ОФ уже через 15 мин, максимально – через 1–1,5 ч после введения препарата. Время облучения через час после введения ЗСА соответствовало, таким образом, максимальному эффекту разобщения препаратов. В это время наблюдается снижение двигательной активности животных, вероятно, из-за уменьшения образования энергии, как это может происходить при воздействии других неблагоприятных факторов. Затем степень сопряженности дыхания и синтеза АТФ в контроле без облучения увеличивается до нормальных значений, и через 3–5 ч (максимально через 7–8) разобщение ОФ уже не наблюдается. В течение суток в опытных образцах Мх из печени облученных крыс, которым были введены препараты ЗСА, происходит постепенное увеличение степени сопряженности процессов синтеза АТФ и дыхания Мх, дыхательного контроля, окислительно-восстановительного потенциала до значений, близких к исходным. В контроле, в Мх печени облученных животных без введения им препарата, в это время наблюдается существенное разобщение из-за ускорения свободнорадикального окисления. Восстановление энергетических параметров в опыте было возможно, вероятно, по мере снижения концентрации исследованных препаратов ЗСА при выведении их из организма животных, при этом, по нашим данным, возможно усиление их антиоксидантных свойств по аналогии со слабыми разобщителями из класса двухосновных кислот и природных фенольных соединений [11, 12]. При разобщающем действии исследованные соединения выполняют роль доноров водорода как протонофоры и доноров электронов в качестве антиоксидантов. В результате антиоксидантного действия снижается концентрация образующихся при γ-облучении продуктов свободнорадикальных реакций – активных форм кислорода (АФК), оксидов азота, продуктов перекисного окисления липидов и воды, повреждающих клеточные мембраны, ферменты, ДНК и вызывающих основные патологии. С антиоксидантным действием связывают радиозащиту аминотиолами [5].
Во-вторых, с помощью метода меченых изотопов жирорастворимых анионов и катионов было показано частичное снижение трансмембранного потенциала мембраны Мх при добавлении разобщающих концентраций препаратов. Такой эффект соответствует молекулярному механизму действия разобщителей, выдвинутому в гипотезе П. Митчела. ЗСА с более высокой разобщающей активностью снижали потенциал в большей степени. Несущественное «мягкое» разобщающее действие соединений может приводить к снятию гиперполяризации – снижению высокого мембранного потенциала на внутренней мембране Мх, активирующего образование токсичных АФК в Мх млекопитающих при воздействии облучения и других неблагоприятных внешних факторов, при патологиях [12–14]. Токсичность повышенного уровня АФК проявляется в том, что наблюдается Са2+ зависимое образование пор во внутренней мембране Мх и клеточная гибель [15, 16]. Протонофорное действие разобщителей (ДНФ, ЗСА, жирные кислоты) не должно вызывать очень большое снятие потенциала, которое приводит к существенному и необратимому ингибированию дыхания, отсутствию синтеза АТФ в Мх и токсичности соединения. Среди природных соединений обнаружены такие «мягкие» разобщители в Мх ткани бурого жира зимнеспящих животных – свободные жирные кислоты, способствующие образованию тепла при холодовом стрессе. Регулирует вхождение в состояние спячки и пробуждение соотношение уровня серотонина и норадреналина в мозге животных [17]. Природными разобщителями и регуляторами энергетического обмена Мх являются также гормоны щитовидной железы.
В-третьих, было показано увеличение электропроводности (Gm) искусственных бислойных липидных мембран (БЛМ) в зависимости от концентрации препарата в растворе, было доказано, что оно происходило за счет протонофорной активности соединений, что может приводить к снижению трансмембранного потенциала Мх. Была показана важность наличия ОН-группы в молекуле препарата и ее диссоциации для проявления этой активности, галогенные заместители способствовали диссоциации протона, увеличивая активность в следующем порядке: I- > Br- > Cl-. Другие заместители влияли на Gm БЛМ в меньшей степени. Для ряда препаратов (Г-1057, Г-1032, Г-947, Г-882, Г-944, Г-970, Г-1024) Gm БЛМ возрастала на 2–5 порядков в прямо пропорциональной зависимости от их концентрации. Два дополнительных бензольных кольца другой группы ЗСА (Г-1033, Г-1037, 1021, Г-1028, Г-988, Г-986, Г-992) способствовали более высокой растворимости препарата в липидах и более существенному увеличению Gm БЛМ на 5–6 порядков по квадратичной зависимости от концентрации препаратов, при 10-5 М ЗСА величины Gm достигали максимальных значений 10-4–10-3 См/см2 и далее не изменялись.
Было проведено сравнение разобщающей активности ЗСА на Мх и протонофорной – на БЛМ. Для этого определялись концентрации препаратов, которые приводили к одинаковому эффекту – на Мх они стимулировали скорость дыхания в 2 раза, а на БЛМ индуцировали электропроводность 5·10-9 – 10-9 См/ см-2, увеличивая ее в 5–10 раз. Эти концентрации были равны для первой группы ЗСА в присутствии и в отсутствии Мх, а второй группы со значительной растворимостью в липидах, они равны только при измерении Gm БЛМ в присутствии Мх, существенно поглощающих препарат. Полученные концентрации всех исследованных ЗСА отличались по величине и укладывались на прямую линию, проведенную под углом 45 ° (рис. 4). Из рисунка следует, что чем более активен был препарат как разобщитель на Мх и как протонофор на БЛМ, тем при более низкой концентрации он оказывал разобщающее и протонофорное действие. Полученная корреляция свидетельствовала в пользу протонофорного механизма разобщающего действия на Мх препаратов ЗСА, их способности переносить протоны также через мембрану Мх. Согласно нашим экспериментальным данным и хемиосмотической гипотезе Митчела, это приводит к снижению трансмембранного потенциала Мх, разобщению ОФ и дыхания в Мх и к уменьшению синтеза энергии, образующейся в виде макроэргических молекул АТФ.
Для выявления взаимосвязи выявленного молекулярного механизма ЗСА с их радиозащитным действием было проведено сравнение протонофорной активности препаратов ЗСА на БЛМ и радиозащитной эффективности при их оптимальной эффективной концентрации 10-5 молей/кг живого веса на лабораторных животных (рис. 5). Была выявлена прямо пропорциональная зависимость между этими параметрами при увеличении электропроводности БЛМ от 10-7 до 10-4 См/см2 для соединений 1–6, что доказывало их протонофорный радиозащитный механизм. Низкую Gm БЛМ препаратов 1 и 2 можно объяснить химической структурой этих веществ. Препарат Г-970 обладал дополнительным пятичленным кольцом с двумя атомами азота – токсичным пиразольным гетероциклом, Г-1057 содержал метильную вместо активной гидроксильной группы в основном бензольном кольце, что приводило к снижению их протонофорной и радиозащитной активности. Наибольшую радиозащитную эффективность 70–80 % при наиболее высокой протонофорной активности показали три соединения – тегалид, Г-882 и Г-992. Эти препараты при 10-5 М максимально стимулировали или обратимо ингибировали скорость дыхания Мх. При более высоких значениях Gm БЛМ 10-3 См/см2, индуцированных препаратами ЗСА, наблюдалось резкое снижение радиозащиты лабораторных животных от 80 % до 10 %, оно было связано с необратимым ингибированием скорости дыхания Мх ниже исходной и проявлением токсичности этих препаратов в опытах на животных. Снижение радиозащиты препаратов Г-1024 до 20 % и Г-988 до 10 % обусловлено их токсичностью, связанной с наличием двух атомов иода в основном бензольном кольце. Две выявленные корреляционные зависимости – разобщающей и радиозащитной активности препаратов от протонофорной (рис. 4, 5), позволили заключить, что первичным молекулярным механизмом радиопрофилактической защиты животных при их γ-облучении в летальной дозе 10 Гр является протонофорная разобщающая активность исследованных нами ЗСА, как и для бензотиадиазолов [3].
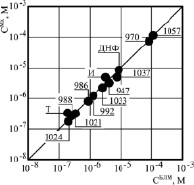
Рис. 4. Корреляция протонофорной активности ЗСА на БЛМ и разобщающей – на Мх. По оси ординат концентрация препаратов, стимулирующая скорость дыхания Мх в 2 раза, по оси абсцисс концентрация ЗСА, индуцирующая электропроводность Gm БЛМ 5.10-9 – 10-9 См/ см-2. На рисунке обозначены: И – ионол, Т – тегалид, ДНФ – динитрофенол
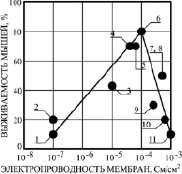
Рис. 5. Связь радиозащитной эффективности соединений ЗСА (выживаемости мышей при введении препарата за час до их γ-облучения в дозе 10 Гр 10-5 молей/кг живого веса) с их Gm БЛМ. На рисунке обозначены: 1 – Г-970, 2 – Г-1057, 3 – Г-947, 4 – Г-882, 5 – тегалид (10-6 М), 6 – Г-992, 7 – Г-1021, 8 – Г-1028, 9 – Г-986, 10 – Г-1024, 11 – Г-988
Механизмом молекулярного действия соединений ЗСА являлось также изменение фазового состояния мембран. Об этом свидетельствовало снижение микровязкости мембран теней эритроцитов, смещение температуры фазового перехода липидов мембран в сторону низких значений температур на 5–8 °С под действием ЗСА. Препараты, обладающие радиопротекторным действием в радиозащитной концентрации, снижали микровязкость мембран, рассчитанную по флуоресценции зонда ДФГТ, на 0,5–2,0 сПз при концентрациях 10-5–10-4 М, увеличивали их текучесть, в то время как ЗСА, не обладающие разобщающим и радиопротекторным действием, не влияли на этот параметр. Существенное снижение микровязкости более чем на 1–2 единицы при высоких концентрациях препаратов (10-4– 10-3 М) приводит, наоборот, не к радиозащите, а к радиосенсибилизации облученных животных. Изменению микровязкости могли способствовать структурные перестройки мембран теней эритроцитов, которые были исследованы в опытах по тушению флуоресценции зондов 2,6-ТНС и ДМХ на примере тегалида с высокой радиозащитной эффективностью [18]. Увеличение его концентрации от 10-8 М до 10-4 М приводило к монотонно медленному тушению флуоресценции зонда 2,6-ТНС, расположенного в поверхностных слоях мембраны, а ДМХ, расположенного глубже в мембране, вначале медленному, а затем быстрому и опять медленному. Такой характер тушения флуоресценции зонда ДМХ являлся экспериментальным доказательством способности тегалида преодолевать потенциальный барьер на границе липида низкой полярности мембрана/среда. Вероятно снижение (тушение) флуоресценции происходит за счет увеличения доступа воды к зонду с помощью препарата. Наиболее быстрая фаза тушения на облученных в дозе 50 Гр тенях эритроцитов происходила при 8·10-6 – 10-5 М тегалида с меньшей эффективностью и при более высоких концентрациях, чем на необлученных препаратах, наибольшее проникновение препарата в мембрану наблюдалось при его оптимальной радиозащитной концентрации 10-5 молей (3–6 мг)/кг живого веса [18]. Степень проницаемости мембран теней эритроцитов для препаратов ЗСА коррелировала с их разобщающей и радиопротекторной активностью, снижение микровязкости и изменение структуры липидов мембран происходит, вероятно, и в Мх, что должно способствовать проявлению разобщающего механизма в Мх и радиозащитного действия ЗСА на животных. Неактивные разобщители (препарат Г-889 без ОН-группы, РП цистеамин) могут незначительно, линейно снижать флуоресценцию зонда ДМХ.
Клеточные механизмы радиозащитного действия ЗСА
Полярографическим методом в ячейке было показано увеличение скорости дыхания при разобщении синтеза АТФ и дыхания с помощью ЗСА – скорости потребления экзогенного для митохондрий кислорода, что, по всей вероятности, будет способствовать снижению концентрации кислорода также и в клетке, т.е. приводить к внутриклеточной гипоксии. Аналогично действует классический разобщитель 2,4-динитрофенол (ДНФ) и его аналоги ТХФ, ДХФ, ПХФ, однако они проявляют высокую токсичность в условиях in vivo в отличие от исследованных нами препаратов ЗСА. Создание гипоксии с помощью ингибиторов дыхательной цепи в Мх путем необратимого связывания дыхательных ферментов, например, цианидом, приводит к летальным исходам. Гипоксия может также достигаться вследствие нетоксического действия протекторов на физиологическом уровне, например нитритом натрия и окисью углерода за счет связывания с гемоглобином и блокирования транспорта кислорода, биогенными аминами (серотонином, гистамином, катехоламинами), агонистами адрено- и аденозиновых рецепторов – путем сосудосуживающего действия [3, 4].
Для многих классов соединений показано, что состояние умеренной временной гипоксии радиочувствительных органов и тканей выполняет роль радиозащитного фактора [2, 12]. В состоянии гипоксии клетка запускает экспрессию генов, ответственных за множество компенсаторных защитных реакций – усиление образования энергии, синтез цитокинов, стволовых клеток и ростовых факторов, гемообразование, выведение ксенобиотиков, апоптоз, снижение образования АФК [19]. При действии гипоксии, разобщителей ОФ (жирных кислот), низкой тоничности среды, показан защитный механизм образования суперкомплекса, образованного из жестко стыкованных компонентов дыхательной цепи и синтеза АТФ, которое позволяет избежать резкого падения мембранного потенциала Мх и способствует синтезу АТФ [20]. При гипоксии происходит адаптивная метаболическая перестройка, в результате которой происходит накопление восстановительных эквивалентов в дыхательной цепи (НАДН2), активируются анаэробные и митохондриальные аэробные пути запасания энергии, способствующие повышению радиоустойчивости энергетической системы к моменту облучения [6, 21]. Возможны и другие механизмы радиопротекторного действия, сходные для ЗСА и других салицилатов – нестероидных противовоспалительных препаратов (НПВП), например аспирина, дифлунизала, которые связывают с обезболивающими и жаропонижающими свойствами НПВП, обусловленными снижением образования простагландинов, способствующих воспалению, боли. Описаны радиопротекторные свойства экзогенных простагландинов, однако использование их в клинике ограничено из-за многочисленных побочных эффектов [2].
Другой клеточный механизм профилактического радиозащитного действия ЗСА был исследован в отдельных опытах на клетках синхронной культуры миксомицета Fisarum polycephalum. Было показано, что препараты ЗСА с выраженной радиозащитной эффективностью в концентрациях 10-7–10-5 М снижают скорость репродуктивной активности клеток, сдвигая интерфазу клеточного цикла в фазе S, существенно уменьшается также включение меченого тимидина в ДНК. Снижение скорости метаболизма и пролиферации, по всей вероятности, происходит из-за дефицита энергии при разобщающем действии ЗСА на синтез АТФ, также при ингибировании репликации ДНК налидиксовой и оксолиновой кислотами [22], тиолами [5], которые обладали выраженной противолучевой активностью за счет увеличения времени и эффективности процессов репарации ДНК. Некоторые радиозащитные препараты (пероксиредоксин-6) могут снижать экспрессию генов, увеличивающуюся при ионизирующем облучении [23].
Заключение
При исследовании 16 соединений из класса ЗСА препараты под шифром Г-992, Г-882 и тегалид показали наиболее высокую 70–80 % радиопрофилактическую защиту при введении их в очень низких, нетоксичных концентрациях 10-6–10-5 М (0,5–5,0 мг/кг живого веса) растворенными в ДМСО за час до γ-облучения лабораторных животных в летальной дозе 10 Гр, они имели высокий фактор изменения дозы ФИД = 1,54–1,56. Радиозащитные нетоксичные концентрации указанных ЗСА существенно ниже, чем для многих известных радиопротекторов, существенно увеличивался срок жизни животных на 10–16 суток. Менее активные препараты, исследованные в более высоких концентрациях при γ-облучении животных в сублетальных и абсолютно летальных дозах 6–11 Гр, увеличивали выживаемость мышей до 10–50 %. Большинство ЗСА были во много раз более эффективными как радиопротекторы при концентрациях, во много раз более низких, чем салициловая кислота.
Показана линейная зависимость электропроводности БЛМ от концентрации препаратов с низкой растворимостью в мембранах БЛМ и квадратичная зависимость для ЗСА с высокой растворимостью, имеющих два дополнительных бензольных кольца. Была получена корреляционная зависимость разобщающей активности препаратов на Мх печени крыс от протонофорной активности на БЛМ для большинства соединений ЗСА с учетом высокого коэффициента распределения мембрана/среда 104–105. Корреляция свидетельствовала о способности ЗСА переносить протоны не только через БЛМ, но и через мембрану Мх.
Для выяснения связи мембранотропной и радипрофилактической активности препаратов ЗСА была снята зависимость выживаемости мышей при введении им оптимальной радиозащитной концентрации ЗСА 10-5 молей/кг живого веса препаратов за час до γ-облучения в летальной дозе 10 Гр от электропроводности БЛМ при 10-7 до 10-4 См/см2. Прямо пропорциональная зависимость между этими параметрами для некоторых препаратов доказывала их протонофорный радиозащитный механизм. Корреляция протонофорной и разобщающей активности доказывала также разобщающий протонофорный молекулярный механизм радиозащиты, проявлением которого является временное, обратимое, частичное ингибирование образования энергии и разобщение процессов синтеза АТФ и дыхания в Мх. Эффективность радиозащиты для ЗСА убывает в следующем ряду галогенных и других заместителей в бензольных кольцах: I- > Br- > Cl- > NO2- > NH-> COOCH3 > CH3.
Молекулярный механизм ЗСА был исследован также с помощью флуоресцентных зондов 2,6-ТНС, ДМХ. ДФГТ. ЗСА при оптимальной радиозащитной концентрации 10-5 молей (3–6 мг)/кг живого веса уменьшали потенциальный барьер на границе мембрана/среда, снижали микровязкость на 0,5–2,0 сПз липидов низкой полярности, температуру фазового перехода на 5–8 °С и вызывали структурные перестройки мембран теней эритроцитов. Аналогичные изменения, вероятно, происходят и в Мх, что должно способствовать проявлению разобщающего механизма в Мх и радиозащитного действия ЗСА на животных.
Клеточные механизмы радиозащиты с помощью ЗСА – гипоксия, торможение метаболизма и пролиферации клеток, обусловлены разобщающим действием исследованных препаратов и должны приводить к снижению концентрации образующихся при γ-облучении продуктов свободнорадикальных реакций, которые являются причиной основных радиационных патологий. Подобный эффект препаратов можно назвать их опосредованным антиоксидантным действием. Вероятно ЗСА могут проявлять также антиоксидантные свойства при снижении их концентрации и низкой протонофорной активности как ранее исследованные нами двухосновные кислоты и природные фенолы. Клеточные механизмы радиопрофилактического действия основных классов радиопротекторов – аминотиолов (цистамин, цистеамин), индолилалкиламинов (серотонин, триптамин) и биогенных аминов (адреналин, индралин), сходны с ЗСА, однако их молекулярные механизмы различны.
Автор приносит благодарность за оформление и обсуждение результатов к.б.н. Н.Л. Кожокару.
Библиографическая ссылка
Кожокару А.Ф. МОЛЕКУЛЯРНЫЕ И КЛЕТОЧНЫЕ МЕХАНИЗМЫ РАДИОЗАЩИТНОГО ДЕЙСТВИЯ САЛИЦИЛАНИЛИДОВ ПРИ ИХ ВОЗДЕЙСТВИИ ДО Γ-ОБЛУЧЕНИЯ ЛАБОРАТОРНЫХ ЖИВОТНЫХ В СУБЛЕТАЛЬНЫХ И ЛЕТАЛЬНЫХ ДОЗАХ // Международный журнал прикладных и фундаментальных исследований. 2019. № 8. С. 14-24;URL: https://applied-research.ru/ru/article/view?id=12819 (дата обращения: 28.10.2025).
DOI: https://doi.org/10.17513/mjpfi.12819