В настоящее время в связи с пандемией COVID-19 внимание многих исследователей направлено на изучение динамики дыхательных и кровеносных изменений в органах и тканях, а также на изучение путей профилактики этого заболевания [1–3]. Осложнения COVID-19 могут включать дыхательную недостаточность и внезапный респираторный дистресс-синдром, сердечную недостаточность и нарушения сердечного ритма, почечную недостаточность, полиорганную недостаточность и смерть. КОВИД-19 в первую очередь известен как респираторное заболевание [2, 3].
Конечно, легкие и дыхательные пути находятся в центре внимания при респираторных заболеваниях COVID-19. Поскольку новый патоген SARS-CoV-2 в основном поражает нижние дыхательные пути, инфицированные люди, которые испытывают умеренное или тяжелое заболевание, имеют сухой кашель, одышку и / или пневмонию [3, 4].
Сегодня на фоне серьезной пандемии COVID-19 особенно остро встает вопрос необходимости биологического моделирования болезней на мелких лабораторных животных. Важным фактором является создание таких экспериментальных моделей, которые бы наиболее адекватно отражали и помогали объяснить механизмы возникновения заболеваний дыхательной системы и пути их профилактики и лечения. Проведение таких экспериментов невозможно без детального изучения морфологических и физиологических характеристик легочной ткани, включающих ее гистологическое строение и кровоснабжение. Однако до настоящего времени структурно-функциональные особенности легких лабораторных животных изучены недостаточно. Анализ доступных литературных источников демонстрирует фрагментарность подобных исследований [5].
В литературе имеются данные о нормальных значениях основных показателей динамики крови в большом и малом кругах кровообращения, таких как тонус сосудов, кровенаполнение, степень оводнения легочной ткани, в зависимости от степени выраженности венозного застоя крови [6, 7]. Однако нам не удалось найти работ, которые позволили бы оценить эти показатели у здоровых животных в разные фазы дыхания: во время спонтанного вдоха и выдоха.
Поэтому на первом этапе исследования перед нами стояла задача изучить анатомо-физиологические и гистологические особенности легких здоровых животных на фоне спонтанного дыхания.
Как показывает опыт многолетнего изучения стресса, он представляет собой стандартную адаптационную реакцию в ответ на действие большого числа различных по природе факторов (интоксикация, кровопотеря, травма, инфекционный процесс, длительная физическая или психическая нагрузка и т.д.), потенциально угрожающих существованию организма. Вне зависимости от причины, ее вызвавшей, в основе стресс-реакции лежит повышенная выработка адренокортикотропного гормона (АКТГ) и индуцированная ею гиперпродукция надпочечниками стероидных гормонов. Картина стресса была впервые описана Г. Селье в 1936 г. как «синдром, вызываемый различными вредными агентами», впоследствии получивший известность как общий адаптационный синдром, или синдром биологического стресса [8, 9].
В литературе также имеется большое число работ, посвященных изучению системной и легочной гемодинамики при сосудистых заболеваниях респираторной системы методом реопульмонографии.
Однако клиническое значение реографических данных у больных с нарушениями кровообращения в малом круге, а также функциональных и морфологических особенностей ткани легких остаются недостаточно изученными, а трактовка полученных результатов в практической работе представляет значительные трудности.
Сведения о реографических показателях в норме и при нарушении легочного кровотока весьма скудны и противоречивы. Так, разнонаправленные изменения системной и регионарной гемодинамики на один и тот же стресс у различных видов животных отмечались рядом исследователей [2, 3, 10].
Вышеизложенное свидетельствует о необходимости более детального изучения и уточнения, а именно, динамики реографических показателей в норме и при нарушении легочного кровотока [10–12].
В доступной литературе мы не обнаружили данных о комплексном влиянии иммобилизации и гипотермии на морфофункциональные изменения легких.
Цель исследования: изучение морфофункциональных особенностей легочной ткани у здоровых животных при спонтанном дыхании, а также их изменений на фоне моделирования стресс-индуцированной альтерации под влиянием комплексного воздействия гипотермии и иммобилизации.
Материалы и методы исследования
Эксперименты выполнены на 30 белых беспородных крысах обоего пола массой от 170 до 250 г. Животные содержались на стандартном рационе вивария и брались в эксперимент натощак.
Экспериментальные животные распределялись по следующим группам:
1 группа – интактные животные (8 крыс). Кроме легкого наркоза и записи реограммы, эти животные не подвергались экспериментальным воздействиям.
2 группа – 8 крыс, здоровые животные, у которых после вскрытия грудной клетки изучались гистологические характеристики легочной ткани.
3 группа – экспериментальная (14 белых крыс), у которых изучали реопульмонографические показатели, морфологические и физиологические изменения в легких при комбинированной стрессовой альтерации легких форсированным снижением двигательной активности и снижением температуры окружающей среды. Сочетанный эффект гипотермии и иммобилизации вызывался фиксацией животных в тесной камере, объем которой составлял 80 см3, в течение 10 дней на протяжении 6 ч. Камера, за счет мелких отверстий, имела сообщение с окружающей средой, где поддерживалась температура + 3 + 4 °С [10, 12].
Системная и легочная гемодинамика изучалась на аппарате Реан-Поли с записью реопульмонограммы, реограммы (РГ), дифференциальной кривой и электрокардиограммы во втором стандартном отведении. Описанный способ регистрации кровообращения и наложения токовых и потенциальных электродов был разработан на кафедре нормальной физиологии Медицинского университета «Астана» [12, 13].
После эвтаназии легкие крыс извлекались из грудной клетки и взвешивались. У половины животных (7 крыс) изучалось оводнение легких путем высушивания в сухожаровом шкафу, расчета весового коэффициента (ВК) и сухого остатка (СО). У семи животных ткань легких забиралась на гистологическое исследование. После окраски срезов гематоксилином и эозином проводилось микроскопическое описание препаратов. При обработке полученных результатов использовали общепринятый метод статистики с использованием компьютерной прикладной программы Statistica 6,0 и Microsoft Exsell Professional. Достоверность полученных результатов оценивали с использованием t-критерия Стьюдента.
Результаты исследования и их обсуждение
РГ проводилась при частоте переменнного тока в среднем, силе тока и напряжении на электродах 4В.
Сущность реографического метода заключалась в регистрации кривой, которая отражала изменения электрического сопротивления тканей и органов, находящихся между электродами при ритмичной деятельности сердца.
Через исследуемый участок тела пропускался ток высокой частоты (50 кГц) и малой силы (2–3 мА). Исследуемая область тела для пропускаемого тока представляла определенное сопротивление. Высокочастотный ток, проникая глубоко в ткани изучаемого участка, распределялся по пути наименьшего сопротивления, то есть по кровеносным сосудам, в которых электрическое сопротивление закономерно изменялось при каждой пульсовой волне. Изменения электрического сопротивления в зависимости от систолы и диастолы вызывали колебание напряжения в цепи, которое улавливалось реографом, передавалось на самописец, усиливалось и регистрировалось в виде реографической кривой. В качестве самописца использовался электрокардиограф ЭК4Т-02.
Контурный анализ реографической кривой сводился к ее качественной и количественной оценке. При визуальной оценке изучали ритмичность, регулярность и форму реографических волн, устойчивость их элементов, характер вершины, крутизну анакротической и катакротической фаз, количество и выраженность пресистолических венозных волн.
Качественная оценка реограммы сводилась к измерению амплитудных и временных отрезков кривой, которые отражали состояние тонуса сосудов, их эластичность, величину ударного объема.
К амплитудным показателям относились:
- Ас – амплитуда систолической волны в мм, основная амплитуда реограммы, измеряется от основания систолической волны до высшей точки реограммы, данный показатель отражает уровень максимального пульсового колебания кровенаполнения и степень раскрытия сосудистого русла;
- Ад – амплитуда диастолической волны в мм, или дикротический индекс, измеряется от основания диастолической волны до высшей ее точки, отражает степень периферического сопротивления оттоку крови из артерий в область мелких вен.
Расчет амплитуды в омах производится путем деления амплитуды кривой в миллиметрах на высоту калибровочного импульса в миллиметрах и умножения полученной величины на постоянную величину калибровочного сигнала реоплетизмографа в Омах (0,1 или 0,5).
Временные показатели РГ представляют собой промежутки времени между зубцом Q на ЭКГ и началом РГ волны (t) и между другими характерными точками на РГ-волне. Систолическая волна на зарегистрированных нами реограммах интактных (здоровых) крыс характеризовалась вначале крутым подъемом, а затем приобретала более пологий характер и переходила в закругленную вершину. Соответственно, этим отрезком анакроты мы определяли фазы быстрого (Еб, с) и медленного систолического кровенаполнения (Ем, с), длительность всей анакроты обозначали как период максимального кровенаполнения (Е макс, с). Интервалу от зубца Q ЭКГ до начала подъема реографической кривой, отражающему время распространения пульсовой волны на участке сердце – исследуемая ткань соответствовал период напряжения (Т, с) при фазовом анализе систолы желудочков сердца. Точка перехода от крутой к более пологой части восходящего колена указывала на максимальную скорость наполнения сосудов в фазе быстрого систолического кровенаполнения. Дифференциация этой точки на реографической кривой (объемной реограмме) затруднительна, но четко обнаружилась на первой производной, отражающей скорость изменения регистрируемого процесса во времени (дифференциальной реограмме), являясь вершиной основного зубца. Следующий период, который мы определяли по реограмме – время общего кровенаполнения мозговых сосудов (Ео, с) – отрезок кривой от начала до точки максимального углубления инцизуры, расположенной на катакроте, и отражает колебания сопротивления в момент захлопывания полулунных клапанов сердца.
Исходя из полученных амплитудных и временных данных реограммы, рассчитывались следующие основные показатели:
- Реографический индекс – (РИ) отношение амплитуды систолической волны в миллиметрах к величине калибровочного импульса в миллиметрах. Вместе с амплитудной систолической волны РИ характеризовал величину пульсового кровенаполнения легких (выражается в относительных единицах).
- Коэффициент систоло-диастолического отношения (Ас/Ад) – отношение амплитуды систолической волны к амплитуде диастолической, отражающее степень преобладания артериального притока во время систолы над венозным оттоком во время диастолы.
- Амплитудно-частотный показатель (АЧП) – отношение реографического индекса (РИ) к длительности сердечного цикла (RR). АЧП характеризует величину объемного кровотока в исследуемой области в единицу времени.
Частота дыхания у здоровых животных равнялась 76 ± 3,03 мин-1. При этом 0,33 ± 0,01 с приходилось на фазу вдоха, а 0,32 ± 0,01 с на фазу выдоха; дыхательная пауза была очень короткой и измерить ее продолжительность не представлялось возможным.
Реографическая кривая здоровых животных напоминала обычную сфигмограмму, состоявшую из восходящего систолического участка, отражавшего приток крови к легочным сосудам и пологого диастолического отрезка, который, в зависимости от наличия и высоты дикротической волны, свидетельствует о характере венозного оттока крови к сердцу.
Нами было обнаружено, что продолжительность фаз изгнания крови из сердца и период напряжения его миокарда остается неизменным вне зависимости от фаз дыхательного цикла. Однако амплитудные показатели реопульмонограммы существенно разнятся на вдохе и выдохе. У здоровых животных амплитуда систолической волны равнялась 1,12 ± 0,04 Ом, в то время как амплитуда диастолы была 0,68 ± 0,03 Ом. Реографический индекс при этом был равен 0,5 Ом. Систоло-диастолическое отношение составляло 1,65 ± 0,09. На выдохе Ас и Ад снижались до 0,42 ± 0,07 Ом и 0,59 ± 0,08 Ом соответственно. РИ при этом изменялся незначительно и равнялся 0,47 ± 0,02 Ом, однако систоло-диастолическое отношение понизилось значительно – до 0,71 ± 0,08 Ом, что свидетельствовало о затруднении венозного возврата крови к сердцу через систему легочных вен.
При гистологическом исследовании ткани легких здоровых интактных крыс было обнаружено, что большая часть паренхимы лёгких – легочные альвеолы, которые выстланы уплощённым альвеолярным эпителием. Между альвеолами располагаются тонкие перегородки, в которых прослеживаются капилляры без признаков эритростаза, в просвете посткапиллярной венулы не обнаруживается диапедезных кровоизлияний, также не наблюдались признаки отека межальвеолярных перегородок. Лимфатические фолликулы в составе бронхов обнаруживались редко (рис. 1).
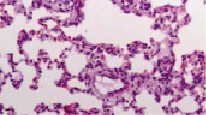
Рис. 1. Ткань легких здоровой крысы. Окраска гематоксилином и эозином. Увеличение х200
Изменения РГ при стресс-индуцированной альтерации показали, что в первый день, до 1 часа опыта, отмечается стойкая тенденция к снижению уровня наполнения кровью легочных сосудов (весовой коэффициент снижался от 1,3 до 0,6). На это указывало изменение временных параметров РГ: укорочение отрезков времени, отражающих периоды полного изгнания крови из сердца и напряжения миокарда, снижение АЧП). Амплитудные показатели также свидетельствовали об увеличении тонуса сосудов на уровне микроциркуляторного русла (снижение Ас, повышение Ад, уменьшение систоло-диастолического отношения Ас/Ад ниже единицы).
В дальнейшем, через 1 час после начала стрессорного воздействия, вероятно вследствие адаптации животных к экстремальным условиям и включению механизмов противодействия стрессу, перечисленные изменения стремились к нормализации (к уровню контрольных животных). В это время амплитудные и временные показатели у всех крыс контрольной группы, за исключением двух не отличались от таковых у здоровых животных. Однако после второго часа эксперимента вновь наступали изменения, аналогичные отмечавшимся в первый час опыта, и более того, они усугублялись.
Перечисленные нарушения сохранялись до последнего дня экспериментальной серии.
Гистологическое описание легочной ткани проводили у семи крыс (группа 3а) на пятые, а у остальных (группа 3б) – на десятые сутки от начала эксперимента.
Характерные морфологические признаки легочной ткани были однонаправленными у всех контрольных животных.
Гистологическая картина легочной ткани животных группы 3а (окраска гематоксилином и эозином; увеличение х200) свидетельствовала о значительных сдвигах микроциркуляторного кровообращения, что проявлялось на срезах признаками стаза эритроцитов на уровне посткапиллярных сосудов, диапедезными кровоизлияниями из капилляров, отеком межальвеолярных перегородок.
В ткани легких подопытных крыс отмечали развитие острого полнокровия капилляров и посткапиллярных венул со стазом эритроцитов. Отмечались отек межальвеолярных перегородок и диапедезные кровоизлияния из сосудов капиллярного типа (рис. 2). Также отличительными особенностями в это время были фибриноидное набухание стенок артериол, которые были фрагментарно спазмированными и в их просветах обнаруживалось небольшое количество красных кровяных клеток. Отмечалось полнокровие и парез расширенных капилляров, что свидетельствовало о прогрессирующей тканевой гипоксии (рис. 3).
На фоне полнокровия венозного участка микроциркуляторного русла отмечали частичный спазм и малокровие артериол, а в сосудистых стенках – фибриноидное набухание (рис. 4).
Расстройство микрогемоциркуляции сопровождалось паретическим расширением капилляров.
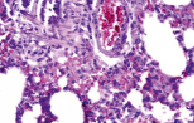
Рис. 2. Острое полнокровие. Стаз эритроцитов
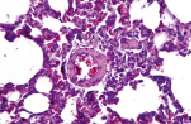
Рис. 3. Отек межальвеолярных перегородок и диапедезные кровоизлияния
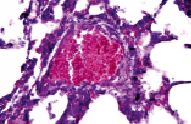
Рис. 4. Парез капилляров. Сладжирование эритроцитов
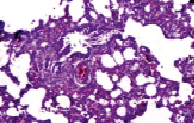
Рис. 5. Бронхоспазм с очаговой пролиферацией и десквамацией эпителиальной ткани слизистой оболочки бронхов
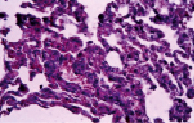
Рис. 6. Дистелектаз паренхимы легких
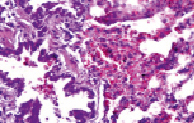
Рис. 7. Диапедез лимфоцитов с лимфоцитарной инфильтрацией стенки бронха
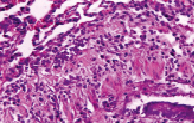
Рис. 8. Диапедез лимфоцитов с лимфоцитарной инфильтрацией стенки бронха
На десятые сутки у крыс группы 3б отмечались еще более серьезные нарушения (окраска гематоксилином и эозином, увеличение х200): наблюдались явления бронхоспазма с очаговой пролиферацией и десквамацией эпителиальной ткани слизистой оболочки бронхов (рис. 5), дистелектаза паренхимы легких и наличием эритроцитов в просветах щелевидных альвеолярных ходов (рис. 6), кровоизлияниями в перибронхиальной ткани с диапедезом эритроцитов в просвет бронха (рис. 7), диапедез лимфоцитов с лимфоцитарной инфильтрацией стенки бронха и межальвеолярных перегородок на фоне повышенного кровенаполнения и очаговой эмфиземы (рис. 8).
Выводы
Таким образом, основные нарушения гемодинамики, вызванные сочетанным влиянием двух стрессорных факторов – длительной иммобилизации и пониженной температуры, проявляются в понижении уровня кровенаполнения легочных сосудов, повышении тонуса прекапилляров и венозном застое крови в легких. Гистологические и физиологические нарушения легочной ткани свидетельствуют о развивающихся к середине эксперимента реактивном бронхоспазме и тканевой гипоксии, крайними проявлениями которых становятся к концу опыта очаговая эмфизема и дистелектаз легочной паренхимы.
Результаты, полученные в этой работе, помогут теоретикам и врачам глубже понять механизмы изменений, происходящих в органах и тканях под влиянием комбинированного стресса во время пандемии COVID-19. Это также будет полезно для выявления особенностей сердечно-сосудистых осложнений, разработки моделей риска легочных и сердечных осложнений, а также для теоретического обоснования методов лечения.
Библиографическая ссылка
Хамчиев К.М., Исаева З.К., Сулейменова Ф.М., Сагимова Г.К., Адайбаев К.Т. РОЛЬ БИОЛОГИЧЕСКОГО МОДЕЛИРОВАНИЯ БОЛЕЗНЕЙ ОРГАНОВ ДЫХАНИЯ В УСЛОВИЯХ COVID-19: ГИСТОЛОГИЧЕСКАЯ КАРТИНА ЗДОРОВЫХ И СТРЕСС-ИНДУЦИРОВАННЫХ ЛЕГКИХ // Международный журнал прикладных и фундаментальных исследований. – 2020. – № 7. – С. 50-56;URL: https://applied-research.ru/ru/article/view?id=13100 (дата обращения: 26.04.2024).

