Широкое использование угля в качестве дешевого топлива для выработки электроэнергии и тепла привело к росту отходящих газов с высоким содержанием СО2. Решение задачи снижения выброса СО2 сегодня приобрело глобальный характер и усиливается тем, что отходящие газы содержат значительные количества SO2 и NOx.
Известные способы очистки газов неэкономичны и сопровождаются образованием большого объема отвального загрязненного гипса [1–3]. Извлечение серы из газов составляет ~90 %, практически весь спектр соединений азота выбрасывается в атмосферу.
В 1970-е гг. был предложен эффективный способ глубокой очистки отходящих газов от SO2 с использованием расплавленной эвтектической смеси карбонатов щелочных металлов [4–6]. Данная технология требовала разработки метода дальнейшей регенерации расплава, который не был успешно решен авторами. Предложенная авторами регенерация расплава требовала осуществления многоступенчатого высокотемпературного (~850–900 °C) химического процесса, что приводило к выходу из строя оборудования за счет агрессивности расплава.
В работе [7] авторами было предложено новое решение – низкотемпературная (450–550 °С) регенерация расплава монооксидом углерода. Достигнуто высокое, до 99 %, извлечение серы из расплава. Технология была апробирована на котельной К-19 АО «Энерго-Орталык-3» (г. Шымкент) [8]. Полученные результаты полностью подтвердили теоретические основы технологии: достигнуто высокое до 95 % улавливание серы и практически полное извлечение ее при регенерации монооксидом углерода. К сожалению, несмотря на положительные результаты, открытыми остались вопросы поведения соединений азота при улавливании серы карбонатным расплавом и регенерации карбонатно-сульфатных расплавов монооксидом углерода. Кроме того, использование в качестве восстановителя СО усложняет аппаратурное оформление технологии, ввиду необходимости создания специальной установки для получения СО путем сжигания дополнительного количества угля.
Широкое использование в металлургической практике природного газа представляет большой интерес с точки зрения его применения в качестве восстановителя карбонатно-сульфатного расплава, вместо монооксида углерода. Теоретические аспекты регенерации карбонатно-сульфатного расплава природным газом были рассмотрены в работе [9]. Показана принципиальная возможность использования природного газа в качестве восстановителя карбонатно-сульфатного расплава с получением сероводорода (H2S), пригодного для получения серной кислоты и элементной серы [10]. Применение природного газа вместо СО для регенерации имеет значительные преимущества: исключается необходимость дополнительного оборудования и расхода угля для получения СО. В проведенных исследованиях, так же как и в случае использования СО, вопросы поведения соединений азота NOx в процессах химической абсорбции отходящих газов и регенерации карбонатно-сульфатного расплава природным газом не были подвергнуты детальному анализу.
Цель настоящей работы: исследование поведения оксидов азота при очистке отходящих газов ТЭС и металлургических предприятий эвтектикой карбонатов щелочных металлов и регенерации расплава монооксидом углерода и природным газом.
Методика исследования
Термодинамическая оценка вероятности протекания реакций взаимодействия между компонентами газового потока (SO2, NOx) с эвтектикой расплава состава, % (моль): Li2CO3 – 43,5, Na2CO3 – 31,5, K2CO3 – 25, сводилась к определению зависимости свободной энергии Гиббса от температуры. В основу исследований поведения соединений азота положен термодинамический анализ реакций взаимодействия оксидов азота (NO, NO2) с карбонатом калия как одного из доминирующих соединений, вступающего во взаимодействие с NOx с образованием нитрита калия.
Данные о свободных энергиях исходных веществ и продуктов реакций, а также их энтропиях и теплоемкостях взяты из работы [11]. За стандартное состояние карбоната, сульфата и нитрита калия приняты состояния – чистый жидкий переохлажденный карбонат (K2CO3ж), сульфат (K2SO4ж) и нитрит калия (KNO2ж).
Механизм регенерации расплава, содержащего нитрит калия, рассматривался с позиций термодинамической возможности его восстановления монооксидом углерода и природным газом.
Удаление соединений азота (NOx) из дымовых газов с помощью смеси карбонатной эвтектики
Механизм взаимодействия оксидов азота с карбонатом калия можно представить системой следующих реакций:
К2CO3 liquid + NO g + NO2 g =
= 2KNO2 liquid + CO2 g, (1)
K2CO3 liquid + 2NO g + 0.5O2 g =
= 2KNO2 liquid + CO2 g. (2)
Согласно результатам термодинамических расчетов вероятность протекания реакций (1), (2) достаточно высока, о чем свидетельствуют отрицательные значения энергии Гиббса во всем исследованном температурном интервале – 573–823 К (рис. 1).
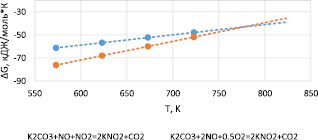
Рис. 1. Расчет свободной энергии Гиббса реакций взаимодействия соединений азота с карбонатом калия в температурном интервале 523–823 К
Механизм взаимодействия соединений азота с карбонатом калия характеризуется интенсивным образованием нитрита калия, изучение особенностей которого представляет интерес как с позиций формирования устойчивых соединений азота на стадии абсорбции газов карбонатным расплавом, так и дальнейшего восстановления его монооксидом углерода и природным газом. Видно, что уменьшение температуры смещает протекание реакций (1), (2) в сторону образования нитрита калия.
При комплексной очистке газов от SO2 и NOх в первую очередь следует ожидать активного взаимодействия сернистого ангидрида с карбонатом калия. Высокие скорости реакции поглощения серы карбонатным расплавом вызывают образование сульфатов, которые составляют основу расплавов, получаемых после абсорбции газов [7, 12, 13]. Данный факт объясняет относительно небольшое количество расплава, необходимое для удаления SO2 из газов. Низкие, по сравнению с серой, концентрации NOх в газах (250–400 мг/нм3) не окажут существенного влияния на расход карбонатного расплава. По данному способу достигается высокое, до 95 %, удаление серы и NOх из газов. При этом остаточное содержание серы в дымовых газах составляет 0,003 %. Это как минимум в 15 раз ниже значения достигаемого самыми эффективными процессами на основе известняка.
Результаты термодинамических расчетов показывают, что протекание реакций (1) и (2) в температурном интервале 523–823 К характеризуется отрицательными значениями свободной энергии Гиббса. По сравнению со значениями энергии Гиббса для реакции взаимодействия сернистого ангидрида с карбонатом калия, низкие значения энергии Гиббса реакций (1), (2) указывают на подчиненный их характер. Тем не менее можно утверждать, что сульфатно-карбонатный расплав, полученный после удаления серы из отходящих газов, будет содержать незначительное количество нитрита калия. Это свидетельствует не только о возможности улавливания SO2 и летучей золы из отходящих газов карбонатным расплавом щелочных металлов [8], но и о глубокой очистке газов от токсичных соединений азота NOx.
Карбонатный расплав, содержащий сульфаты и небольшое количество нитрита калия, может быть регенерирован путем извлечения серы, исследование которого представляет большой практический интерес.
Низкотемпературное восстановление нитрита калия монооксидом углерода и природным газом
Оценка термодинамической вероятности восстановления нитрита калия СО и СН4 проведена на основе термодинамического анализа реакций:
2KNO2 liquid + CO g =
= K2CO3 liquid + N2 g + O2 g, (3)
2KNO2 liquid + CH4 g + 0.5O2 g =
= K2CO3 liquid + N2 g + 2H2O g. (4)
Термодинамические расчеты энергии Гиббса реакций (1), (2), проведенные на основе стандартных значений для чистых веществ, указывают, что сокращение нитрита калия в расплаве возможно в широком диапазоне температур, включая интересующий нас низкотемпературный интервал 523–823 К (рис. 2).
Очевидно, что реакция (4) более практична, поскольку позволяет осуществлять восстановление нитрита калия природным газом. Это исключает необходимость использования специального оборудования для получения СО путем сжигания дополнительного расхода угля. Расчеты свободной энергии Гиббса для реакций (3) и (4) показывают предпочтительность протекания реакции (4), чем реакции (3). На рис. 2 видно, что значения энергии Гиббса реакции (4) в ~3 раза превышают значения энергии Гиббса реакции (3) во всем исследованном температурном интервале. Полученные результаты хорошо согласуются с данными работы [14], где показано отсутствие растворения метана в ионном карбонатном расплаве ввиду неполярности его молекулы.
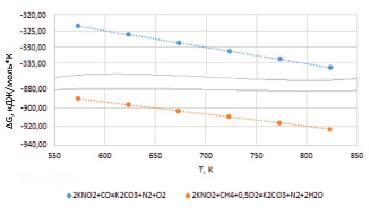
Рис. 2. Расчет свободной энергии Гиббса реакций восстановления нитрита калия СО и СН4 в температурном интервале 523–823 К
Таким образом, полученные результаты показывают принципиальную возможность низкотемпературного восстановления нитрита калия монооксидом углерода и природным газом. Прямое восстановление нитрита калия до его карбоната при той же температуре 450–500 °С, при которой происходит абсорбция SO2 и NOx в одном аппарате. Такая модификация может потенциально преобразовать технологию глубокой очистки отходящих газов ТЭС и металлургических предприятий от SO2 и токсичных соединений азота NOx на основе карбонатной эвтектики в практичный и жизнеспособный крупномасштабный процесс.
Выводы
1. На основании термодинамического анализа реакций взаимодействия оксидов азота с карбонатом калия показана принципиальная возможность их улавливания с образованием нитрита калия в расплаве. Результаты термодинамических расчетов показывают, что протекание реакций (1) и (2) в температурном интервале 523–823 К характеризуется отрицательными значениями свободной энергии Гиббса. По сравнению со значениями энергии Гиббса для реакции взаимодействия сернистого ангидрида с карбонатом калия, низкие значения энергии Гиббса реакций (1), (2) указывают на подчиненный их характер.
2. Показано, что взаимодействие соединений азота с карбонатом калия сопровождается образованием нитрита калия в расплаве и выделением углекислого газа, что повышает концентрацию СО2 в газах, направляемых на дальнейшее его улавливание.
3. В результате термодинамических расчетов энергии Гиббса реакции взаимодействия нитрита калия с СО и СН4 установлена высокая вероятность восстановления нитрита калия природным газом. Показано, что энергия Гиббса для реакции взаимодействия NOx с природным газом с уменьшением температуры повышается и при температуре процесса регенерации карбонатно-сульфатного расплава природным газом составляет, ∆Gº823 К = -922,6 кДж/моль.
Библиографическая ссылка
Досмухамедов Н.К., Егизеков М.Г., Жолдасбай Е.Е., Курмансеитов М.Б., Аргын А.А. ПОВЕДЕНИЕ NOХ ПРИ ОЧИСТКЕ ОТХОДЯЩИХ ГАЗОВ ТЭС КАРБОНАТНЫМ РАСПЛАВОМ ЩЕЛОЧНЫХ МЕТАЛЛОВ // Международный журнал прикладных и фундаментальных исследований. – 2021. – № 1. – С. 30-34;URL: https://applied-research.ru/ru/article/view?id=13169 (дата обращения: 20.04.2024).

