Наиболее распространенными мезенхимальными опухолями желудочно-кишечного тракта, по данным литературы, являются гастроинтестинальные стромальные опухоли (ГИСО) и составляют от 1 % до 2 % от всех новообразований ЖКТ [1].
ГИСО происходят из интерстициальных клеток Кахаля. Согласно статистике, общая заболеваемость ГИСО в Соединенных Штатах составляет 0,70 на 100 000 человек в год, наблюдается тенденция к росту. Наиболее часто ГИСО регистрируются в желудке (60 %), тонком кишечнике (тощая, подвздошная кишки 30 %, двенадцатиперстная кишка 4–5 %), реже подвергаются толстая кишка и аппендикс (1–2 %), пищевод (1 %), иногда встречаются и вне желудочно-кишечного тракта [2].
Золотым стандартом лечения ГИСО является оперативное вмешательство, для ГИСО менее 5 см, расположенных в желудке и тонкой кишке, рекомендуется лапароскопическая резекция. Однако, несмотря на радикальную операцию, возможен риск рецидива, что влияет на дальнейшую тактику лечения. Первая система классификации в зависимости от риска рецидива была предложена в 2002 г. Fletcher и его коллегами, в соответствии с ней на риск рецидива влияет размер опухоли и количество митозов, в 2006 г. Miettinen предложил также учитывать и локализацию опухоли. В 2008 г. Joensuu была предложена модифицированная классификация. В соответствии с ней деление на прогностические группы зависит от размера, индекса митотической активности, локализации опухоли и факта разрыва капсулы. К группам высокого риска относят: размер злокачественного образования более 10 см, индекс митотической активности более 10, опухоли 5–10 см с митотическим индексом 5–10, или локализованные вне желудка с размером 2,1–5 см и индексом митотической активности >5, или локализацией вне желудка и размером более 5,1 см [1].
По данным исследований ГИСО высокого риска имеют риск рецидива опухоли до 66 %, а общая 5-летняя выживаемость без применения адъювантной терапии после оперативного вмешательства составляет 35 % [3].
ГИСО экспрессируют протоонкоген KIT. Мутация гена KIT вызывает стимуляцию роста ГИСО; c-KIT, также известный как CD117, является белком с рецепторной тирозинкиназой, который регистрируется на поверхности различных типов клеток. Димеризация рецептора и активацию нижестоящих сигнальных путей происходит при связывании фактора стволовых клеток с внеклеточным доменом c-KIT. В ГИСО, в которых отсутствует экспрессия KIT, присутствуют мутации, связанные с рецептором фактора роста тромбоцитов, альфа (PDGFRA). В целом мутации KIT или PDGFRA обнаруживаются в 85 и 5 % соответственно [4].
Ингибиторы тирозинкиназы способны блокировать активный центр фермента, таким образом, предотвращать активацию и последующее деление клеток. Это дает возможность целенаправленного лечения ГИСО препаратами данной группы, такими как иматиниб [5].
Иматиниб является пероральным синтетическим низкомолекулярным ингибитором тирозинкиназы, нацеленным на белки Kit и PDGFRA. Ряд клинических испытаний продемонстрировали преимущество адъювантной терапии иматинибом у пациентов с прогрессирующим ГИСО и эффективность при неоперабельном или метастатическом процессе. В исследовании группы онкологии Американского колледжа хирургов были прослежены отдаленные результаты у пациентов с высоким риском рецидива, после оперативного лечения с последующей адъювантной терапии иматинибом в дозе 400 мг/сут в течение 1 года. После 7,7 лет наблюдения общие показатели выживаемости за 1, 3 и 5 лет составили 99, 97 и 83 % соответственно, показатели безрецидивной выживаемости в течение 1 года, 3 и 5 лет составили 96, 60 и 40 % соответственно [4].
Цель исследования: изучить отдаленные результаты лечения гастроинтестинальных стромальных опухолей с высоким риском рецидива.
Материалы и методы исследования
Выполнено ретроспективное исследование результатов лечения 248 пациентов с диагнозом ГИСО, наблюдавшихся в ГАУЗ «СООД» с 2000 по 2019 г. Из 248 пациентов к высокому риску рецидива по H. Joensuu были отнесены 63 пациента. Из них мужчин – 26 (41,3 %), женщин – 37 (58,7 %). Средний возраст составил 61, минимальный – 33, максимальный – 78 лет. Распределение пациентов по возрастным группам представлено на рис. 1.
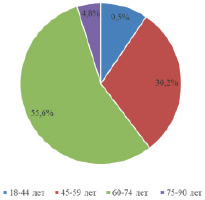
Рис. 1. Распределение пациентов по возрастным группам
Всем пациентам был выполнен стандартный комплекс диагностических мероприятий: УЗИ брюшной полости, МСКТ. У пациентов с локализацией процесса в желудке была выполнена ФГС, при локализации в толстой кишке – ФКС. Для верификации диагноза проводилось иммуногистохимическое исследование с определением маркеров CD 117, DOG 1, CD 34, индекса митотической активности, KI 67. Локализация опухолевого процесса представлена в табл. 1.
Как видно из табл. 1, наиболее частой локализацией опухоли являлся желудок (63,5 %), на втором месте тонкая кишка (14,3 %).
Всем пациентам было проведено радикальное оперативное вмешательство. Объёмы операций представлены в табл. 2.
Таблица 1
Локализация опухолевого процесса
|
Локализация опухолевого процесса |
Количество пациентов |
% |
|
Желудок |
40 |
63,5 |
|
Тонкая кишка |
9 |
14,3 |
|
Толстая кишка |
5 |
7,9 |
|
Забрюшинное пространство |
5 |
7,9 |
|
Двенадцатиперстная кишка |
4 |
6,3 |
|
Всего |
63 |
100 |
Таблица 2
Объёмы оперативных вмешательств
|
Операция |
Количество |
% |
|
Атипичная резекция желудка |
30 |
47,6 |
|
Резекция желудка |
4 |
6,3 |
|
Комбинированная резекция желудка |
4 |
6,3 |
|
Резекция тонкой кишки |
10 |
15,9 |
|
Комбинированная резекция тонкой кишки |
2 |
3,2 |
|
Резекция толстой кишки |
4 |
6,3 |
|
Комбинированная резекция толстой кишки |
1 |
1,6 |
|
Удаление забрюшинной опухоли |
3 |
4,8 |
|
Комбинированное удаление забрюшинной опухоли |
1 |
1,6 |
|
Резекция двенадцатиперстной кишки |
1 |
1,6 |
|
Панкреатогастродуоденальная резекция |
2 |
3,2 |
|
Гастрэктомия |
1 |
1,6 |
|
Всего |
63 |
100,0 |
Таблица 3
Локализация метастатических очагов
|
Локализация |
Количество |
% |
|
Печень |
11 |
64,7 |
|
Рецидив |
1 |
5,9 |
|
Брюшина |
4 |
23,5 |
|
Подвздошные лимфоузлы |
1 |
5,9 |
|
Всего |
17 |
100 |
Из табл. 2 видно, что наиболее распространенным оперативным вмешательством являлась атипичная резекция желудка (47,6 %). Реже всего встречались комбинированная резекция толстой кишки (1,6 %), комбинированное удаление забрюшинной опухоли (1,6 %), резекция двенадцатиперстной кишки (1,6 %), гастрэктомия (1,6 %).
Послеоперационные осложнения наблюдались в 7,9 % случаев. Послеоперационная летальность составила 1,6 % (1 случай).
Статистическая обработка проводилась в программах Microsoft Ecxel, и Statistica 6.0. Построение кривых выживаемости проводилось по методу Каплана – Майера.
Результаты исследования и их обсуждение
Из 62 пациентов адъювантная терапия иматинибом проводилась 43 пациентам (69,35 %).
Прогрессирование наблюдалось у 17 пациентов (27,4 %), из них адъювантную терапию иматинибом получали 10 (58,8 %) пациентов. Локализация метастатических очагов представлена в табл. 3.
Как видно из представленной таблицы, на первом месте встречается метастатическое поражение печени (64,7 %), на втором канцероматоз брюшины (23,5 %).
Прогрессирование в зависимости от локализации первичного очага представлено в табл. 4.
Таблица 4
Прогрессирование в зависимости от локализации процесса
|
Локализация |
Всего |
Прогрессирование |
% от локализации |
|
Желудок |
40 |
10 |
25,0 |
|
Тонкая кишка |
8 |
2 |
25,0 |
|
Толстая кишка |
5 |
1 |
20,0 |
|
Забрюшинное пространство |
5 |
1 |
20,0 |
|
Двенадцатиперстная кишка |
4 |
3 |
75,0 |
|
Всего |
62 |
17 |
27,4 |
В представленной таблице можно увидеть, что наиболее часто прогрессировали опухоли, локализованные в ДПК (75 %). Для остальных локализаций частота прогрессирования составляла 20–25 %.
Отдаленные результаты
Отдаленная выживаемость представлена на рис. 2.
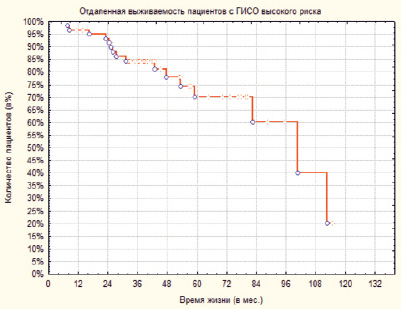
Рис. 2. Отдалённая выживаемость пациентов с ГИСО высокого риска
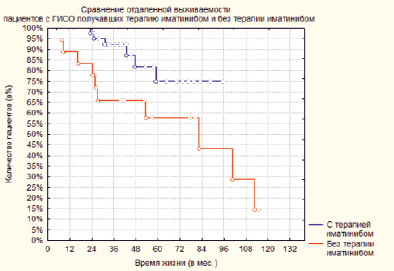
Рис. 3. Сравнение отдаленной выживаемости пациентов с ГИСО, получавших терапию иматинибом и без терапии иматинибом
Как видно из графика на рис. 2, 1-летняя выживаемость составила 97 %, 3-летняя 85 %, 5-летняя выживаемость 71 %.
На рис. 3 представлена отдаленная выживаемость в зависимости от проведения адъювантной терапии иматинибом.
Из рис. 3 видно, что во все отрезки времени у пациентов, получавших адъювантную терапию иматинибом, отдаленная выживаемость выше, чем у пациентов, которым проводилось только оперативное вмешательство (p = 0,039). У пациентов, получавших адъювантную терапию иматинибом, 1-летняя выживаемость составила 100 %, 3-летняя 93 %, 5-летняя 75 %. У пациентов без адъювантной терапии 1-летняя выживаемость составила 89 %, 3-летняя 66 %, 5-летняя 57 %.
Заключение
Проведение адъювантной терапии иматинибом у пациентов с ГИСО высокого риска увеличивает отдаленную выживаемость (p = 0,039).
Библиографическая ссылка
Киселева К.Е., Киселев Е.А. ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ ГАСТРОИНТЕСТИНАЛЬНЫХ СТРОМАЛЬНЫХ ОПУХОЛЕЙ У ПАЦИЕНТОВ С ВЫСОКИМ РИСКОМ РЕЦИДИВА // Международный журнал прикладных и фундаментальных исследований. – 2021. – № 3. – С. 35-39;URL: https://applied-research.ru/ru/article/view?id=13188 (дата обращения: 18.04.2024).

