Высокая интенсивность кариеса зубов у детей с психоневрологическими расстройствами (ПНР) сегодня носит не только медицинский, но социальный характер [5]. Согласно большинству литературных источников мультифакториальность данного заболевания обосновывает максимально комплексный подход к изучению кариесогенной ситуации [17]. Ротовая жидкость (РЖ) играет основополагающую роль в развитии кариеса зубов, так как она обеспечивает нормальное функциональное состояние зубов и слизистой оболочки полости рта. Физико-химическое постоянство эмали зубов полностью зависит от состава и химического состояния окружающей ротовой жидкости. Установлено, что изменение состава и свойств слюны влияет на развитие кариеса [5]. В отечественных и зарубежных исследований было обнаружено, что определенные виды психоэмоционального стресса вызывают изменение в слюне уровня калликреина, катехоламинов, кортизола, интенсивности свободно радикальных процессов и активности ферментов антиоксидантной системы (АОС) и пр. Также было показано, что содержание секреторного иммуноглобулина А снижается при эмоциональном переживании и хроническом стрессе, но повышается при эмоциональном раздражение, остром стрессе и позитивном настроении [2,3].
Несмотря на большой объем анатомо-физиологических данных о слюнных железах и их секрете, остается нерешенным вопрос о том, как именно работает механизм, управляющий формированием биохимического состава слюны. В настоящее время значительная часть исследователей склоняется к выводу о решающей роли психоэмоциональных факторов в этих процессах [3].
Снижение кислотности ротовой жидкости может способствовать увеличению проницаемости эмали зубов и нарушению минерализации молодых зубов [18], а также развитию "окислительного стресса" с внутриклеточным дисбалансом про-/антиоксидантной системы [13]. В зависимости от силы и длительности воздействия "окислительный стресс" может вызывать гибель клеток, либо возможно включение адаптивных защитных механизмов, которые приводят к росту клеточного редокс-статуса, восстановлению редокс-зависимого сигналинга и появлению нового соотношения активные формы кислорода (АФК)/антиоксиданты [4,6,10,11]. Имеются литературные данные об увеличении показателей антиоксидантной системы у детей с кариесом, в том числе в раннем возрасте [12,13,15].
Однако, до конца не ясно, какую роль в развитии кариозного процесса у детей c ПНР играет дисбаланс про-/антиоксидантной системы, поэтому выявление возможных взаимосвязей между динамикой параметров биогенеза свободных радикалов и активностью кариозного процесса у детей с указанной патологией будет способствовать установлению патогенетической роли свободнорадикальных механизмов в развитии кариеса и повышению эффективности профилактических и коррекционных мероприятий при данном заболевании.
Целью исследования является анализ взаимосвязи биохимических параметров функционального состояния антиоксидантной системы ротовой жидкости и активности кариозного процесса в полости рта у детей с ПНР.
Материалы и методы исследования
Для решения поставленной задачи проведено клинико-лабораторное обследование 85 детей в возрасте 8-17 лет, которые разделили на четыре подгруппы. Первую опытную подгруппу (О1) составили 23 ребенка в возрасте 8-12 лет, имеющие диагноз "умственная отсталость легкой степени тяжести", учащиеся профильной коррекционной школы VIII типа, вторую опытную подгруппу (О2) составили 22 ребенка с аналогичным диагнозом в возрасте 13-17 лет. Первую контрольную (подгруппу К1) – 20 соматически здоровых детей в возрасте 8-12 лет и вторую контрольную (К2) – 20 здоровых детей в возрасте 13-17 лет. По полу обследованные дети обеих групп распределились, в основном, в соотношении 1:1,15. Все дети постоянно проживают в г. Краснодаре. Обследование детей проводили по схеме, включающей клинические и лабораторные методы. Все обследованные дети имели клинически здоровый пародонт. Забор исследуемого материала проводился на базе детского стоматологического отделения стоматологической поликлиники ГБОУ ВПО КубГМУ Минздрава России. Биохимические исследования были проведены в соответствии с этико-правовыми аспектами клинических исследований и включали определение состояния ферментативного (супероксиддисмутазы (СОД) и каталазы) неферментативного (SH-групп) звеньев АОС. Активность СОД определяли по методу В.А. Костюка и соавт. [8]. Активность каталазы определяли по методу М.А. Королюка и соавт. [7]. Содержание тиоловых групп – по методу В.Н. Ореховича [9]. Забор смешанной слюны осуществляли в утренние часы натощак [1]. Полученную смешанную слюну исследовали на показатели антиоксидантной системы. Статистическую обработку экспериментальных данных проводили в соответствии с методами, принятыми в вариационной статистике, с использованием программы "STATISTICA 6.0".
Результаты исследования
и их обсуждение
Распространенность кариеса временных зубов у детей подгрупп О1 и К1 составила 91,30+1,55% и 75,0+4,48%. Распространенность кариеса постоянных зубов в основных подгруппах имела более высокие показатели, нежели в контрольных: 43,48+4,63% и 30,0+3,76% (в подгруппах О1 и К1) и 95,65+1,82% и 90,0+2,43% (в подгруппах О2 и К2 соответственно) (рис.1).
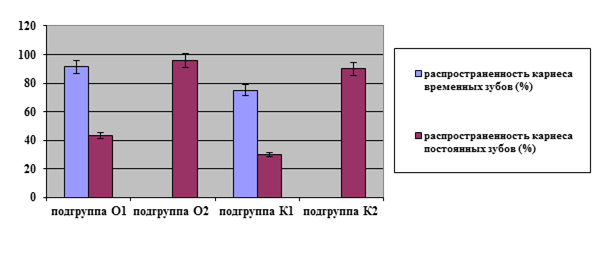
Рис. 1. Показатели распространенности кариеса в обеих клинических группах
Показатели индексной оценки интенсивности кариозного процесса обследуемых детей приведены в таблице 1. Следует отметить, что в опытных подгруппах преобладает показатель "к" (кариес), а в контрольных – показатель "п" (пломба), а также наличие удаленных постоянных зубов у школьников подгруппы О2.
Таблица 1
Показатели интенсивности кариеса зубов в обеих клинических группах
|
Показатель Подгруппа |
Показатель интенсивности кариеса |
|||||
|
"к" |
"п" |
"у" |
"К" |
"П" |
"У" |
|
|
Подгруппа О1 |
1,870+ 0,120* |
0,652+ 0,373 |
0,696+ 0,010* |
1,652+ 0,344* |
1,348+ 0,295 |
0 |
|
Подгруппа О2 |
0,05+ 0,005 |
1,10+ 0,006 |
0 |
3,50+ 0,704* |
2,10+ 0,625 |
0,20+ 0,03 |
|
Подгруппа К1 |
0,955+ 0,296 |
1,591+ 0,373* |
0,136+ 0,026 |
0,545+ 0,09 |
1,136+ 0,2 |
0 |
|
Подгруппа К2 |
0 |
0,05+ 0,005 |
0 |
1,45+ 0,176 |
2,15+ 0,626 |
0 |
Примечание: * значение р<0,05 по t-критерию
Согласно результатам исследования, уровень SH-групп в ротовой жидкости контрольной группы детей в возрасте 8-12 лет составил 0,12±0,01 ммоль/г белка, активность ферментов первого и второго звена антирадикальной защиты СОД – 0,27±0,01 усл.ед./г белка и каталазы – 0,95±0,07 мкмоль/(мин г белка). Содержание SH-групп в контрольной группе детей в возрасте 13-17 лет составляла 0,14±0,01 ммоль/г белка, активности СОД и каталазы – 0,29±0,01 усл.ед./г белка и 0,98±0,07 мкмоль/(мин г белка) соответственно.
В ротовой жидкости детей в возрасте 8-12 лет с ПНР концентрация сульфгидрильных групп снижалась на 23,4% (p<0,05) по сравнению с контрольной группой. Изменения активности ферментов СОД и каталазы носили однонаправленный характер и были выше показателей контроля на 14,8 % (p<0,05) и 19,6 % (p<0,05) соответственно, что можно рассматривать как адаптивную реакцию организма в ответ на "окислительный стресс", вызванный множественным кариесом. Уровень тиоловых групп у детей второй опытной группы был ниже контроля на 34% (р<0,05), активность СОД уменьшалась на 22,7% и каталазы – на 12,5% (p<0,05).
У детей в группе О2 (13-17 лет) показатели ферментативного и неферментативного звеньев были снижены, что, видимо, связано с нарушением защитных механизмов АОС на фоне пубертатного периода.
Заключение
С учетом вышеизложенного, результаты исследования показателей АОС ротовой жидкости детей с ПНР отражают степень выраженности стоматологической патологии. Снижение уровня SH-групп свидетельствует о начальном этапе истощения неферментативного звена антирадикальной защиты и является более значимым во второй основной группе. Подобные изменения показателей АОЗ ротовой жидкости показывают, что у детей с декомпенсированной формой кариеса (основная группа) происходит смещение баланса в системе "генерация свободных радикалов — детоксикация свободных радикалов" в сторону их гиперпродукции и декомпенсированного накопления.
Анализ взаимосвязи индивидуальных показателей активности кариеса и биохимических параметров функционального состояния АОЗ показал достоверную корреляционную связь между активностью кариозного процесса и количеством окисленных/восстановленных тиоловых групп и их соотношением у детей с ПНР.
Библиографическая ссылка
Гуленко О.В., Хагурова С.Б., Волобуев В.В. ПОКАЗАТЕЛИ АНТИОКСИДАНТНОЙ ЗАЩИТЫ РОТОВОЙ ЖИДКОСТИ ПРИ КАРИЕСЕ ЗУБОВ У ДЕТЕЙ С ПСИХОНЕВРОЛОГИЧЕСКИМИ РАССТРОЙСТВАМИ // Международный журнал прикладных и фундаментальных исследований. – 2014. – № 2. – С. 64-68;URL: https://applied-research.ru/ru/article/view?id=4696 (дата обращения: 24.04.2024).

