В настоящее время установлено, что многие хронические инфекции, возникающие при использовании медицинского имплантируемого оборудования – катетеров, протезов и др. – связаны со способностью патогенных бактерий формировать биопленки на поверхности этих устройств [1, 5].
Существуют различные методы лабораторного получения и количественного учета способности бактерий к образованию биопленок [5]. Наиболее распространенный и доступный метод исследования определения способности бактерий формировать биопленки на поверхности пластика, предложен G.OʼToole и R. Kolter [8]. Исследование способности бактерий формировать биопленки на поверхности стекла, как правило, ограничивается визуальным, описательным характером и лишь в некоторых случаях полуколичественной или количественной оценкой [3, 6].
По данным литературы, в 40-50 % случаев основным возбудителем острого или хронического инфекционного процесса, возникающего после протезирования тазобедренного сустава, является Staphylococcus epidermidis, в том числе и метициллинрезистентные штаммы (MRSE) [1]. У пациентов с позвоночно-спинномозговой травмой среди возбудителей инфекции мочевыделительной системы преобладает Escherichia coli [9]. Значительная роль данных микроорганизмов в патогенезе инфекционных осложнений возникающих в результате их способности связываться с поверхностями имплантируемых устройств посредством неспецифической адгезии [7, 9] и, как следствие, формировать биопленки и определяет актуальность нашего исследования.
Цель нашего исследования – количественный анализ способности различных клинических штаммов бактерий формировать биопленки на гидрофобных (полистирол) и гидрофильных (стекло) поверхностях.
Материалы и методы исследования
Исследована способность к образованию биопленки 20 клинических штаммов, выделенных от 18 пациентов, находившихся на лечении в РНЦ «ВТО». Микроорганизмы были выделены из мочи пациентов с позвоночно-спинномозговой травмой, поздний период (E.coli, n=9); с околосуставных тканей и с частей эндопротезов пациентов с развившейся нестабильностью тазобедренного сустава (S.epidermidis, n=6 и MRSE, n=5). Материал отбирали во время оперативного вмешательства при ревизионном эндопротезировании.
Выделение чистой культуры штаммов проводили общепринятыми методами. Идентификацию исследуемых штаммов проводили на бактериологическом анализаторе WalkAway-40 Plus («Siemens», США), используя панели РВСРС 20.
Исследование способности штаммов формировать биопленки на поверхности 96-луночных плоскодонных полистироловых планшетов для иммуноферментного анализа проводили по методу G.OʼToole и R. Kolter [11]. По уровню адсорбции красителя этанолом, измеренному в единицах оптической плотности (OD630) на фотометре ELx808 (BioTek, США) при длине волны 630 нм оценивали активность формирования биопленки. Для интерпретации полученных данных определяли критерии способности штаммами формировать биопленки в соответствии с рекомендациями Stepanovic S. et al. [10]: при значениях OD630 ниже 0,090 – считали, что штаммы не обладали способностью к образованию биопленки; при 0,090<ODпл≤0,180 – штаммы обладали слабой; при 0,180<ODпл≤0,360 – средней; при ODпл ˃0,360 – высокой способностью к образованию биопленки.
Для визуальной и количественной оценки способности бактерий формировать биопленки на поверхности покровного стекла использовали стерильные стеклянные чашки Петри диаметром 100 мм. В каждую чашку помещали стерильное покровное стекло размером 24х24 мм, на поверхность которого осторожно наливали 200 мкл суточной культуры штамма с концентрацией клеток 107 кл/мл и помещали в термостат при 370С. Через 3 часа добавляли мясопептонный бульон до 2 мл и помещали в термостат при 370С. Через 24 и 48 часов после инкубации питательную среду сливали, поверхность стекол трижды промывали 1,15М фосфатным буфером, фиксировали 960 спиртом, высушивали, окрашивали раствором генциан-виолета в течение 2 минут при комнатной температуре, после чего промывали фосфатным буфером.
Полученные препараты исследовали под микроскопом при увеличении в 640 раз (об. 40; ок. 16). Цифровые изображения полей зрения получали с помощью цифровой камеры-окуляра DCМ-300 (Китай), установленной на бинокулярном микроскопе XSP107E.
Для определения количественных характеристик использовали программу ImageJ (США). На цифровых изображениях препаратов измеряли площадь поля зрения, количество и площадь, занимаемую единичными адгезированными клетками и микроколониями. Рассчитывали количество единичных адгезированных клеток и микроколоний на единицу площади (1мм2), и доли, занимаемые ими в площади поля зрения. При этом учитывали размер микроколоний: до 10 мкм2, от 10 до 100 мкм2, от 100 до 1000 мкм2, от 1000 до 10000 мкм2, ˃ 10000 мкм2. С каждого препарата вводили не менее 20 случайных полей зрения, полученные результаты усредняли.
Статистическую обработку данных исследования выполняли с помощью табличного редактора «Microsoft Excel – 2010» и программного обеспечения анализа данных AtteStat Версия 13.0 [2]. Для оценки статистической значимости различий между группами использовали критерий Вилкоксона. Различия между группами считали существенными при р<0,05.
Для оценки тесноты и направления связи между количеством и площадью (долями), занимаемой единичными клетками и микроколониями, и оптическими плотностями (OD630) рассчитывали коэффициент корреляционного отношения Пирсона.
Результаты исследования и их обсуждение
По данным фотометрического анализа наиболее активно биопленку на поверхности полистирола формировали штаммы S.epidermidis, о чем свидетельствуют средние значения OD630 (рис. 1). При этом интенсивность образования биопленок штаммами была различной (таблица).
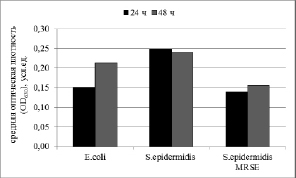
Рис. 1. Изменение средней оптической плотности красителя в лунках полистироловых планшетов, отражающей интенсивность формирования биопленки на их поверхности
Распределение штаммов по способности формировать биопленки на поверхности лунок полистироловых планшетов
|
Штамм |
Способность штаммов формировать биопленку (24 ч / 48 ч) |
||
|
слабая |
средняя |
высокая |
|
|
S.epidermidis (n=6) |
2 / 1 |
2 / 4 |
2 / 1 |
|
MRSE (n=5) |
4 / 4 |
0 / 1 |
1 / 0 |
|
E.coli (n=9) |
7 / 4 |
1 / 5 |
1 / 0 |
При исследовании способности бактерий формировать биопленки на поверхности покровного стекла установлено, что количество единичных адгезированых клеток и микроколоний через 48 часов увеличивалось (рис. 2 А, Б). Однако количество единичных адгезированных грамотрицательных бактерий (E.coli) на поверхности стекла было меньше, чем грамположительных (S.epidermidis, MRSE) (рис. 2 А), а их доля в площади поля зрения в 1,5-2 раза больше, что связано с размером бактерий (рис. 2 В). Площадь бактерий E.coli на двумерном изображении колеблется от 0,4 до 4 мкм2, изолятов стафилококка – от 0,196 до 1,766 мкм2, т.е. при меньшем количестве бактерии E.coli занимали большую площадь.
Наиболее выраженная способность к образованию биопленки на поверхности стекла отмечена у штаммов S.epidermidis и MRSE (рис. 2). У всех исследованных штаммов на поверхности стекла преобладали микроколонии размер которых не превышал 10 мкм2. При этом на такой показатель, как доля в площади поля зрения большее влияние оказывает наличие микроколоний размером более 10000 мкм2. Так, через 48 часов количество и доля микроколоний штаммов MRSE размером более 10000 мкм2 уменьшались, соответственно, в 8,5 и 4,2 раза, что приводило к уменьшению суммарной доли всех микроколоний в 1,5 раза (рис. 2 Б, Г). У штаммов S.epidermidis, напротив, наблюдали увеличение количества и доли микроколоний, которое происходило в основном за счет микроколоний размером от 100 до 1000 мкм2. У штаммов E.coli незначительно увеличивалось количество микроколоний размером от 10 до 10000 мкм2.
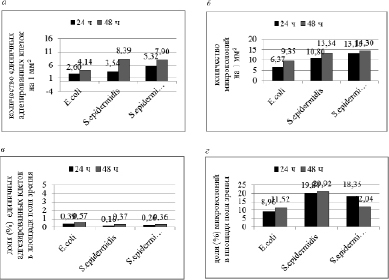
Рис. 2. Соотношение количества (а, б) и долей (в, г) единичных адгезированных клеток и микроколоний, формируемых клиническими штаммами, на поверхности покровного стекла через 24 и 48 ч
Отмечены статистически значимые положительные корреляционные связи между анализируемыми показателями для всех исследуемых штаммов. У штаммов MRSE через 48 часов показатели OD630 коррелировали с количеством (r=0,93; р=0,024) и долей (r=0,93; р=0,022) микроколоний на поверхности стекла размер которых составлял от 10 до 100 мкм2. У штаммов S.epidermidis через 48 часов увеличение показателей OD630 коррелировало с увеличением доли микроколоний размером от 100 до 1000 мкм2 (r=0,99; р=0,022). У грамотрицательных бактерий (E.coli) через 24 часа коэффициент корреляции между OD630 и количеством, OD630 и долей микроколоний размером от 10 до 10000 мкм2 изменялся от 0,79 до 0,90. Через 48 часов установлена прямая корреляционная связь между OD630 и количеством (r=0,73; p=0,025), OD630 и долей (r=0,81; p=0,009) микроколоний размером от 1000 до 10000 мкм2.
Известно, что адгезия микроорганизмов зависит не только от свойств поверхности стекла или полистирола, но и свойств самой микробной клетки. Как правило, бактерии с гидрофобными свойствами активнее формируют биопленки на поверхности из гидрофобных материалов, а бактерии с гидрофильными свойствами на поверхности из гидрофильных материалов [4, 7]. При этом разная способность клинических штаммов к формированию биопленки может свидетельствовать о различиях в их вирулентных свойствах [5].
Заключение
Проведенное исследование позволило получить качественно новую информацию о способности клинических штаммов формировать биопленки. Так, сравнительный анализ количественных данных, показал, что наиболее выраженной способностью к образованию биопленки как на поверхности полистирола, обладающей гидрофобными свойствами, так и на поверхности стекла, имеющей гидрофильные свойства, обладали штаммы S.epidermidis. Менее интенсивно формировали биопленку на поверхности стекла штаммы E.coli, у штаммов MRSE отмечена слабая способность к формированию биопленки на поверхности полистирола.
Наличие корреляционных взаимосвязей между анализируемыми показателями позволяет предположить, микроколонии какого размера и в каком количестве определяют величину показателей оптической плотности красителя в лунках полистироловых планшетов, что свидетельствует о возможности использования количественного анализа микроколоний на поверхности покровного стекла в качестве дополнительного теста для оценки способности бактерий к формированию биопленок и их характеристики.
Библиографическая ссылка
Осипова Е.В., Шипицына И.В., Науменко З.С. СРАВНИТЕЛЬНАЯ КОЛИЧЕСТВЕННАЯ ОЦЕНКА СПОСОБНОСТИ ОБРАЗОВАНИЯ БИОПЛЕНКИ РАЗЛИЧНЫМИ КЛИНИЧЕСКИМИ ШТАММАМИ БАКТЕРИЙ НА ПОВЕРХНОСТИ ПОЛИСТИРОЛА И СТЕКЛА // Международный журнал прикладных и фундаментальных исследований. – 2014. – № 8-1. – С. 55-58;URL: https://applied-research.ru/ru/article/view?id=5638 (дата обращения: 18.04.2024).

