Арилметилиденовые производные 3Н-фуран(пиррол)-2-онов являются структурными фрагментами природных соединений и удобными строительными блоками для синтеза различных соединений. Высокая реакционная способность указанных соединений обусловлена наличием в их структуре С=С и С=О групп. Реакции исходных соединений с различными С-нуклеофилами (ацетоуксусным эфиром [1], ацетилацетоном [2], циклогексаноном [3]) протекают по атому углерода экзоциклической этиленовой связи, реакции с моно- и бинуклеофильными реагентами протекают по атому углерода карбонильной группы [4–5]. В данной работе изучено взаимодействие 3-арилметилиден-3Н-фуран(пиррол)-2-онов с реактивом Гриньяра. Использование реактива Гриньяра позволяет наращивать С-С связь, а также получать различные, порой неожиданные продукты реакции. Взаимодействие полифункциональных соединений с реактивом Гриньяра состоит из нескольких стадий и зависит от строения исходного соединения и условий проведения реакции.
Взаимодействие 5-R-3-арилметилиден-3Н-фуран[1-(р-толил)-1Н-пиррол]-2-онов (Iа-г) с свежеприготовленным раствором реактивом Гриньяра проводилось в растворе абсолютного спирта, при мольном соотношении реагентов 1:1 и температуре 0–5 °С.
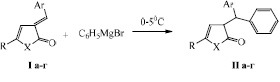
I, II а) X=O, R=CH3, Ar=о-OH-C6H4; б) X=O, R=C5H11, Ar=о-OH-C6H4; в) X=N-(p-CH3-C6H4), R=CH3, Ar=о-OH-C6H4; г) X=N-(p-CH3-C6H4), R= C5H11, Ar=о-OH-C6H4.
3-[2-Ar-(фенил)метил]-5R-3Н-фуран(1-(р-толил)-1Н-пиррол)-2-оны (II а-г) выделены с выходом до 85 %, состав и структура впервые полученных соединений доказаны с привлечением данных элементного анализа и ЯМР1Н-спектроскопии.
Наличие в ЯМР1Н-спектрах соединений II а-г дублета винильного протона в положении С-4 гетерокольца (д, 1Н, Н4) при 4.95-5.15 м.д., триплета, соответствующего протону при С-3 атоме цикла при 4.17-4.29 м.д. (т, 1Н, Н3), дублета протона экзоциклического атома углерода при 5.38-5.52 м.д. (д, 1Н, Нэкзо), а также отсутствие синглета протона при sp2-гибридном атоме углерода двойной С=С связи подтверждает образование продуктов 1,4-присоединения II а-г в реакции замещенных фуран(пиррол)-2-онов с реактивом Гриньяра. Ароматические протоны дают серию сигналов в слабом поле (6.53–7.96 м.д.), сигналы алкильных групп в положении С-5 гетероцикла находятся в сильном поле (1.01–2.32 м.д.).
Наличие нескольких реакционных центров в молекулах исходных соединений (I а-г) делает возможным присоединение реактива Гриньяра в изученных условиях по типу 1,2- или 1,4-присоединения.
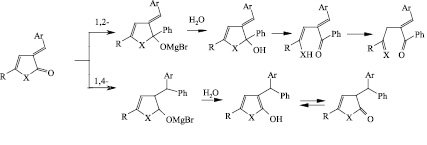
Известно, что стерические затруднения или дополнительное сопряжение карбонильных групп уменьшает выход в 1,2-реакции по сравнению с 1,4-присоединением.
Преобладание 1,4-присоединения связано с тем, что С=С-аддукт более устойчив, чем С=О-аддукт, поскольку первый содержит остаточную p-связь группы С=О, а она сильнее остаточной p-связи группы С=С.
В случае 1,2-присоединения реактив Гриньяра как нуклеофил легко атакует карбонильный атом углерода, имеющий частичный положительный заряд, смещая π-электроны на кислород. В результате этого происходит присоединение частицы С6Н5MgBr по двойной связи карбонильной группы с образованием магниевого алкоголята, гидролиз которого приводит к получению спирта. Дециклизация которого сопровождается образованием 1,4-дикетона (енамина). Однако, данное направление реакции не реализуется.
Схему сопряженного 1,4-присоединения можно представить следующим образом: атака аниона направлена на экзоциклический sp2-гибридный атом углерода, что приводит к образованию промежуточного интермедиата ароматической структуры, гидролиз которого приводит к гидроксифуранону, который стабилизируется в форме фуран-2-она.
Сравнивая химическое поведение 3-арилметилиден-3Н-фуран-2-онов и их N-содержащих гетероаналогов, следует отметить, что О-гетероциклы реагируют более активно, образуя продукты с лучшими выходами.
Исследование выполнено за счет гранта Российского Научного Фонда(проект № 15-13-10007).
Экспериментальная часть
Спектры ЯМР1Н получены на спектрометре Varian-400 при 20-25 °С в CDCl3, внутренний стандарт ТМС. Рабочая частота 400 МГц. ТСХ проводили на пластинах Silufol UV-254, элюент – гексан-этилацетат-хлороформ, 2:2:1, проявитель – пары иода.
Реактив Гриньяра получали по нижеприведенной методике.
В трехгорлую колбу на 100 мл, снабженную мешалкой, обратным холодильником и капельной воронкой помещают 0.005 моль магния (стружка) в 10 мл диэтилового эфира, затем в течение 10 мин прикапывают 0.005 моль бромбензола, растворенного в 7 мл эфира.
3-[2-Ar-(фенил)метил]-5R-3Н-фуран-[1-(р-толил)-1Н-пиррол]-2-оны (II). К свежеприготовленому реактиву Гриньяра прикапывают 0.005 моль 3-арилметилиден-3Н-фуран[1-(р-толил)-1Н-пиррол]-2-она в 10 мл эфира в течение 20 мин. Образовавшуюся массу нейтрализуют насыщенным раствором NH4Cl до нейтральной среды. Органический слой отделяют декантацией. Водный слой экстрагируют эфиром. Объединенные эфирные вытяжки сушат над осушителем (MgSO4), упаривают, выпавшие кристаллы очищают на колонке, заполненной силикагелем, элюент – диизопропиловый эфир : изопропиловый спирт (1:1).
3-[(2-гидроксифенил)(фенил)метил]-5-метил-3Н-фуран-2-он (IIа) Выход 85 %, Тпл. 13–15 °С. ЯМР1Н, d, м.д.: 1.53 с, (3Н, CH3), 4.26 т, (1Н, J 3.6), 5.10 д., (1Н, J 3.6), 5.45 д., (1Н, J 2.13), 6.74–7.42 м, (9Н, аром.), 9.34 уш.с (1Н, ОН). Найдено %: С 77.40; Н 5.37. С18H16O3. Вычислено %: С 77.12; Н 5.75.
3-[(2-гидроксифенил)(фенил)метил]-5-пентил-3Н-фуран-2-он (IIб) Выход 89 %, Т.пл. 16–18 °С. ЯМР1Н, d, м.д.: 1.01–2.37 м, (11Н, C5Н11), 4.21 т, (1Н, J 3.6), 5.01 д., (1Н, J 3.6), 5.38 д., (1Н, J 2.13), 6.67–7.31 м, (9Н, аром.), 9.20 уш.с (1Н, ОН) Найдено %: С 79.03; Н 6.93. С22H24O3. Вычислено %: С 78.54; Н 7.19.
3-[(2-гидроксифенил)(фенил)метил]-5-метил-1-(р-толил)-3Н-пиррол-2-он (IIв) Выход 70 %, Т.пл. 24–26 °С. ЯМР1Н, d, м.д.: 1.83 с, (3Н, CH3), 2.31 с, (3Н, CH3), 4.29 т, (1Н, J 3.6), 5.15 д., (1Н, J 3.6), 5.42 д., (1Н, J 2.13), 6.53–7.86 м, (13Н, аром.), 9.22 уш.с (1Н, ОН) Найдено %: С 80.87; Н 6.62; N 4.12. С25H23NO2. Вычислено %: С 81.27; Н 6.27; N 3.79.
3-[(2-гидроксифенил)(фенил)метил]-5-пентил-1-(р-толил)-3Н-пиррол-2-он (IIв) Выход 71 %, Т.пл. 20–22 °С. ЯМР1Н, d, м.д.: 1.15–2.32 м, (11Н, C5H11), 2.43 с, (3Н, CH3), 4.17 т, (1Н, J 3.6), 4.95 д., (1Н, J 3.6), 5.52 д., (1Н, J 2.13), 6.59–7.96 м, (13Н, аром.), 9.41 уш.с (1Н, ОН) Найдено %: С 82.45; Н 7.54; N 3.52. С29H31NO2. Вычислено %: С 81.85; Н 7.34; N 3.29.
Библиографическая ссылка
Аниськова Т.В., Веревочкин А.А., Чадина В.В., Егорова А.Ю. ВЗАИМОДЕЙСТВИЯ 5-R-3-АРИЛМЕТИЛИДЕН-3Н-ФУРАН(ПИРРОЛ)2-ОНОВ С РЕАКТИВОМ ГРИНЬЯРА // Международный журнал прикладных и фундаментальных исследований. – 2015. – № 9-2. – С. 252-254;URL: https://applied-research.ru/ru/article/view?id=7302 (дата обращения: 16.04.2024).

