Цитомегаловирус человека (ЦМВ) является представителем семейства Herpesviridae и принадлежит к подсемейству Betaherpesvirinae. Одной из ключевых характеристик герпесвирусов, в том числе и ЦМВ, является их способность устанавливать инфекцию латентного характера, которая может реактивироваться при понижении иммунного статуса. ЦМВ инфицировано до 90 % взрослого городского населения, однако у здоровых людей эта инфекция обычно протекает бессимптомно. При ослабленном иммунитете этот вирус представляет серьезную угрозу для жизни пациентов, особенно у больных СПИДом, реципиентов трансплантации, а также у новорожденных. ЦМВ способен проникать через плаценту и инфицировать плод, что ведет к мертворождению и врожденным уродствам. Кроме того, исследования показали, что ЦМВ может быть причиной аутоиммунных расстройств, диабета и атеросклероза [3].
Анти-ЦМВ лекарственные средства, которые в настоящий момент используются в клинике для лечения ЦМВ-инфекции, включают ганцикловир [6], цидофовир [5] и фоскарнет [4]. Данные препараты способны ингибировать синтез вирусной ДНК, катализируемый ЦМВ-полимеразой и понижать репродукцию вируса у пациентов, у которых были установлены клинические симптомы ЦМВ-инфекции. Однако их использование в клинике сопровождается множеством нежелательных эффектов. В частности, все эти препараты проявляют заметную токсичность [2]. Кроме того, они имеют низкую биодоступность, и для достижения необходимого уровня препаратов в крови требуется их внутривенное введение. Следует также отметить, что для достижения положительно результата в лечении ЦМВ-инфекции необходима длительная терапия, что, в свою очередь, приводит к возникновению резистентных вариантов ЦМВ [10]. Следовательно, поиск новых высокоэффективных анти-ЦМВ агентов является актуальной задачей.
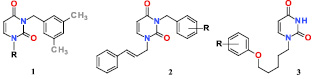
Ранее в литературе был описан ряд производных урацила 1, содержащих в положении 3 пиримидинового цикла 3,5-диметилбензильный фрагмент. Данные соединения проявили выраженный ингибиторный эффект в отношении ЦМВ и вируса иммунодефицита человека типа 1 (ВИЧ-1) [7]. Нами был обнаружен ряд 1-циннамил-3-бензилпроизводных урацила 2, которые также были активны как в отношении ЦМВ, так и в отношении ВИЧ-1 [9]. Недавно нами были описаны новые 1-[5-(фенокси)пентил]производные урацила 3, которые проявили мощную анти-ЦМВ активность in vitro [8].
Цель исследования
Поиск новых ингибиторов репродукции ЦМВ на основе 1-[5-(4-бромфенокси)пентил]производных урацила, содержащих в положении 3 пиримидинового цикла бензильный или нафтилметильный заместитель.
Материалы и методы исследования
Спектры ЯМР 1Н и 13С регистрировали на спектрометре «Bruker Avance 400» (400 МГц для 1H и 100 МГц для 13С) в ДМСО-D6, внутренний стандарт тетраметилсилан. Тонкослойную хроматографию выполняли на пластинах «Merk TLS Silica gel 60 F254» (Германия), используя в качестве элюента этилацетат (А) или смесь этилацетат – 1,2-дихлорэтан (1:1) (Б). Пластины проявляли с помощью УФ-лампы VL-6.LC (Франция). Для препаративной колоночной хроматографии использовали Kieselgel 60-200 μm, 60 A (Acros Organics, Бельгия). Температуры плавления измерены в стеклянных капиллярах на приборе «Mel-Temp3.0» (Laboratory Devices Inc., США).
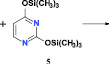
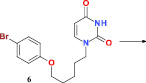
1-[5-(4-Бромфенокси)пентил]урацил (6). Смесь 1,0 г (8,92 ммоль) урацила и 0,15 г (2,80 ммоль) хлорида аммония в 20 мл гексаметилдисилазана (ГМДС) кипятили в течение 12 ч с защитой от влаги воздуха до образования прозрачного раствора. Избыток ГМДС удалили при пониженном давлении, к остатку – бесцветному прозрачному маслу 2,4-ди(триметилсилилокси)пиримидина (5) прибавили 2,9 г (9,01 ммоль) 1-бром-5-(4-бромфенокси)пентана (4), нагревали с защитой от влаги воздуха при 160–170 °С в течении 1 ч и оставили на ночь при комнатной температуре. К реакционной массе добавили 40 мл этилацетата и 10 мл изопропилового спирта. Через 30 мин выделившийся осадок отфильтровали, фильтрат упарили в вакууме досуха, остаток растворили в 10 мл хлороформа и хроматографировали на колонке с силикагелем, элюируя смесью хлороформ – метанол (10:1). Фракции, содержащие целевой продукт, объединяли, упаривали в вакууме и остаток перекристаллизовали из смеси изопропиловый спирт – ДМФА. Получили 2,4 г белого кристаллического вещества, выход 76 %, Т. пл. 125-127 оC, Rf 0,50 (А). Спектр 1H ЯМР, d, м. д.: 1,39 квин (2H, J = 8,3 Гц, CH2); 1,62 квин (2H, J = 7,2 Гц, CH2); 1,71 квин (2H, J = 7,2 Гц, CH2); 3,66 т (2H, J = 7,2 Гц, NCH2); 3,92 т (2H, J = 6,3 Гц, OCH2); 5,55 дд (1H, J = 7,8 и 2,2 Гц, H-5); 6,87 д (2H, J = 9 Гц, H-3’, H-5’); 7,41 д (2H, J = 8,9 Гц, H-2’, H-6’); 7,64 д (1H, J = 7,8 Гц, H-6); 11,23 с (1H, NH). Спектр 13C ЯМР, d, м. д.: 22,8; 28,6; 47,8; 68,0; 101,3; 112,2; 117,1; 132,5; 146,2; 151,4; 158,3; 164,3.
Общий метод получения 3-бензил- и 3-нафтилметилпроизводных 1-[5-(4-бромфенокси)пентил]урацила 8 – 15.
Смесь 1,0 г (2,83 ммоль) 1-[5-(4-бромфенокси)пентил]урацила (6) и 0,6 г (4,34 ммоль) К2СО3 в 15 мл ДМФА перемешивали при 80 °С в течение 1 ч, затем охладили до комнатной температуры, добавили 3,05 ммоль соответствующего бензил- или нафтилметилгалогенида и полученную смесь перемешивали при той же температуре в течение 36 ч. Реакционную массу профильтровали, фильтрат упарили в вакууме, остаток экстрагировали горячим хлороформом (3×50 мл), объединенный экстракт упарили при пониженном давлении и остаток перекристаллизовали из смеси этилацетат – гексан (1 : 1).
1-[5-(4-Бромфенокси)пентил]-3-бензилурацил (8). Выход 78 %, Т. пл. 96-98 оC, Rf 0,67 (Б). Спектр 1H ЯМР, d, м. д.: 1,38 (2H, квин, J = 7,0 Гц, CH2); 1,65 (2H, квин, J = 7,2 Гц, CH2); 1,71 (2H, квин, J = 7,4 Гц, CH2); 3,74 (2H, т, J = 7,1 Гц, CH2); 3,91 (2H, т, J = 6,2 Гц, CH2); 4,99 (2H, c, ArCH2); 5,75 (1H, д, J = 7,8 Гц, H-5); 6,87 (2H, д, J = 8,7 Гц, H-3’, H-5’); 7,21-7,31 (5H, м, C6H5); 7,42 (2H, д, J = 8,7 Гц, H-2’, H-6’); 7,75 (1H, д, J = 7,8 Гц, H-6). Спектр 13C ЯМР, δ, м. д.: 22,4; 28,1; 28,2; 43,4; 48,6; 67,5; 100,1; 111,8; 116,7; 127,1; 127,5; 128,3; 132,1; 137,2; 144,5; 151,1; 157,9; 162,4.
1-[5-(4-Бромфенокси)пентил]-3-(3,5-дихлорбензил)урацил (9). Выход 80 %, Т. пл. 82–83 °C, Rf 0,74 (Б). Спектр 1H ЯМР, d, м. д,: 1,35 (2H, квин, J = 6,4 Гц, CH2); 1,63 (2H, квин, J = 7,3 Гц, CH2); 1,69 (2H, квин, J = 7,4 Гц, CH2); 3,73 (2H, т, J = 7,1 Гц, CH2); 3,89 (2H, т, J = 6,3 Гц, CH2); 4,94 (2H, c, ArCH2); 5,75 (1H, д, J = 7,9 Гц, H-5); 6,84 (2H, д, J = 9,0 Гц, H-3’, H-5’); 7,25 (2H, д, J = 1,8 Гц, H-2», H-6»); 7,39 (2H, д, J = 8,9 Гц, H-2’, H-6’); 7,44 (1H, д, J = 2,0 Гц, H-4»); 7,73 (1H, д, J = 7,9 Гц, H-6). Спектр 13C ЯМР, δ, м. д.: 26,5; 32,2; 32,3; 46,9; 52,8; 71,7; 104,3; 115,9; 120,9; 130,5; 131,1; 136,3; 138,2; 145,5; 149,0; 155,3; 162,1; 166,7.
1-[5-(4-Бромфенокси)пентил]-3-(3,4-дихлорбензил)урацил (10). Выход 89 %, Т. пл. 94–95 °C, Rf 0,69 (Б). Спектр 1H ЯМР, d, м. д.: 1,38 (2H, квин, J = 7,8 Гц, CH2); 1,66 (2H, квин, J = 7,3 Гц, CH2); 1,70 (2H, квин, J = 7,7 Гц, CH2); 3,74 (2H, т, J = 7,3 Гц, CH2); 3,92 (2H, т, J = 6,4 Гц, CH2); 4,96 (2H, c, ArCH2); 5,72 (1H, д, J = 7,9 Гц, H-5); 6,85 (2H, д, J = 9,0 Гц, H-3’, H-5’); 7,23 (1H, дд, J = 8,4 и 2,1 Гц, H-5»); 7,38 (2H, д, J = 8,9 Гц, H-2’, H-6’); 7,47 (1H, д, J = 1,9 Гц, H-2»); 7,49 (1H, д, J = 8,2 Гц, H-6»); 7,67 (1H, д, J = 7,8 Гц, H-6). Спектр 13C ЯМР, δ, м. д.: 26,5; 32,1; 32,3; 46,8; 52,9; 71,9; 104,4; 116,0; 121,1; 132,2; 133,9; 134,2; 134,7; 135,2; 136,3; 142,5; 148,7; 155,4; 162,2; 166,6.
1-[5-(4-Бромфенокси)пентил]-3-(2,4-дихлорбензил)урацил (11). Выход 91 %, Т. пл. 102–103 °C, Rf 0,71 (Б). Спектр 1H ЯМР, d, м. д.: 1,39 (2H, квин, J = 7,5 Гц, CH2); 1,67 (2H, квин, J = 7,3 Гц, CH2); 1,70 (2H, квин, J = 7,3 Гц, CH2); 3,75 (2H, т, J = 7,2 Гц, CH2); 3,92 (2H, т, J = 6,3 Гц, CH2); 5,02 (2H, c, ArCH2); 5,75 (1H, д, J = 7,9 Гц, H-5); 6,85 (2H, д, J = 8,8 Гц, H-3’, H-5’); 6,94 (1H, д, J = 8,3 Гц, H-6»); 7,27 (1H, дд, J = 8,4 и 2,0 Гц, H-5»); 7,38 (2H, д, J = 8,9 Гц, H-2’, H-6’); 7,53 (1H, д, J = 2,0 Гц, H-3»); 7,73 (1H, д, J = 7,9 Гц, H-6). Спектр 13C ЯМР, δ, м. д.: 26,5; 32,1; 32,3; 45,3; 52,9; 72,0; 104,3; 116,0; 121,1; 131,5; 132,5; 132,9; 136,3; 136,5; 136,9; 137,5; 148,8; 155,3; 162,2; 166,6.
1-[5-(4-Бромфенокси)пентил]-3-(2,5-дихлорбензил)урацил (12). Выход 87 %, Т. пл. 137,5–139 °C, Rf 0,77 (Б). Спектр 1H ЯМР, d, м. д.: 1,40 (2H, квин, J = 8,0 Гц, CH2); 1,69 (2H, квин, J = 7,4 Гц, CH2); 1,72 (2H, квин, J = 7,1 Гц, CH2); 3,77 (2H, т, J = 6,9 Гц, CH2); 3,93 (2H, т, J = 6,4 Гц, CH2); 5,03 (2H, c, ArCH2); 5,77 (1H, д, J = 7,9 Гц, H-5); 6,87 (2H, д, J = 8,8 Гц, H-3’, H-5’); 6,94 (1H, д, J = 8,3 Гц, H-6»); 7,27 (1H, дд, J = 8,4 и 2,0 Гц, H-5»); 7,38 (2H, д, J = 8,9 Гц, H-2’, H-6’); 7,53 (1H, д, J = 2,0 Гц, H-3»); 7,73 (1H, д, J = 7,9 Гц, H-6). Спектр 13C ЯМР, δ, м. д.: 26,5; 32,1; 32,3; 45,6; 52,9; 72,0; 104,3; 116,1; 121,1; 130,8; 132,7; 135,2; 136,3; 136,5; 139,2; 142,5; 146,7; 155,3; 162,1; 166,6.
1-[5-(4-Бромфенокси)пентил]-3-(нафтил-1-метил)урацил (13). Выход 78 %, Т. пл. 112–113 °C, Rf 0,73 (Б). Спектр 1H ЯМР, d, м. д.: 1,40 (2H, квин, J = 7,7 Гц, CH2); 1,66-1,73 (4H, м, CH2×2); 3,77 (2H, т, J = 7,2 Гц, CH2); 3,92 (2H, т, J = 6,4 Гц, CH2); 5,48 (2H, c, ArCH2); 5,78 (1H, д, J = 7,9 Гц, H-5); 6,85 (2H, д, J = 9,0 Гц, H-3’, H-5’); 7,04 (1H, д, J = 7,1 Гц, H-2»); 7,36 (1H, т, J = 7,7 Гц, H-3»); 7,39 (2H, д, J = 9,0 Гц, H-2’, H-6’); 7,53 (1H, т, J = 7,7 Гц, H-7»); 7,58 (1H, т, J = 6,9 Гц, H-6»); 7,74 (1H, д, J = 7,8 Гц, H-6); 7,79 (1H, д, J = 8,2 Гц, H-4»); 7,93 (1H, д, J = 8,0 Гц, H-5»); 8,20 (1H, д, J = 8,4 Гц, H-8»). Спектр 13C ЯМР, δ, м. д.: 26,5; 32,2; 32,3; 45,5; 52,9; 72,0; 104,4; 116,0; 121,1; 126,7; 127,2; 129,4; 130,0; 130,4; 131,4; 132,8; 134,8; 136,3; 137,5; 148,6; 155,5; 162,2; 166,8.
1-[5-(4-Бромфенокси)пентил]-3-(4-бромнафтил-1-метил)урацил (14). Выход 65 %, Т. пл. 92,5–93,5 °C, Rf 0,65 (Б). Спектр 1H ЯМР (CDCl3), d, м. д.: 1,50 (2H, квин, J = 5,4 Гц, CH2); 1,73-1,84 (4H, м, CH2 × 2); 3,77 (2H, т, J = 7,3 Гц, CH2); 3,90 (2H, т, J = 6,3 Гц, CH2); 5,60 (2H, c, ArCH2); 5,82 (1H, д, J = 7,8 Гц, H-5); 6,75 (2H, д, J = 9,0 Гц, H-3’, H-5’); 7,17 (1H, д, J = 8,1 Гц, H-2»); 7,18 (1H, д, J = 7,8 Гц, H-3»); 7,38 (2H, д, J = 9,1 Гц, H-2’, H-6’); 7,61-7,64 (2H, м, H-6», H-6»); 7,69 (1H, д, J = 7,7 Гц, H-6); 8,26-8,32 (2H, м, H-5», H-8»). Спектр 13C ЯМР (CDCl3), δ, м. д.: 22,9; 28,5; 28,6; 41,6; 49,6; 67,5; 101,5; 112,7; 116,1; 122,5; 123,8; 125,1; 126,9; 127,0; 127,8; 129,2; 131,8; 131,9; 132,1; 132,4; 142,4; 151,4; 157,9; 162,9.
1-[5-(4-Бромфенокси)пентил]-3-(нафтил-2-метил)урацил (15). Выход 67 %, Т. пл. 91–93 °C, Rf 0,72 (Б). Спектр 1H ЯМР, d, м. д.: 1,37 (2H, квин, J = 7,9 Гц, CH2); 1,65 (2H, квин, J = 7,3 Гц, CH2); 1,70 (2H, квин, J = 7,3 Гц, CH2); 3,75 (2H, т, J = 7,3 Гц, CH2); 3,89 (2H, т, J = 6,4 Гц, CH2); 5,15 (2H, c, ArCH2); 5,77 (1H, д, J = 7,9 Гц, H-5); 6,84 (2H, д, J = 9,0 Гц, H-3’, H-5’); 7,40 (2H, д, J = 9,1 Гц, H-2’, H-6’); 7,41-7,48 (3H, ароматические H); 7,73 (1H, c, H-1»); 7,76 (1H, д, J = 7,9 Гц, H-6); 7,82-7,86 (3H, м, ароматические H). Спектр 13C ЯМР, δ, м. д.: 26,5; 32,2; 32,3; 47,8; 52,8; 71,3; 104,4; 116,0; 120,9; 130,0; 130,1; 130,2; 130,4; 131,7; 131,8; 132,1; 136,3; 136,4; 137,0; 139,0; 148,7; 155,4; 162,1; 166,7.
Результаты исследования и их обсуждение
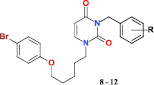
Синтез целевых соединений был осуществлен путем конденсации эквимолярных количеств 1-бром-5-(4-бромфенокси)пентана (4) и 2,4-бис(триметилсилилокси)пиримидина (5), который получали путем кипячения исходного урацила в избытке гексаметилдисилазана, при 160–170 °С в течение 1 ч с защитой от влаги воздуха без использования какого-либо растворителя в соответствии с ранее описанным методом [1, 8]. При этом образовывался исключительно 1-[5-(4-бромфенокси)пентил]урацил (6), выход которого составил 76 %. Его последующая обработка бензилгалогенидами 7 (X = Cl или Br) в растворе ДМФА в присутствии К2СО3 привела с выходом 78–91 % к 1-[5-(4-бромфенокси)пентил]-3-бензилпроизводным урацила 8–12:
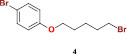
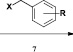
В аналогичных условиях N-алкилирование 1-[5-(4-бромфенокси)пентил]урацила (6) нафтилметилбромидами привело к 1-[5-(4-бромфенокси)пентил]-3-(нафтил-1-метил)- (13), 1-[5-(4-бромфенокси)пентил]-3-(4-бромнафтил-1-метил)- (14) и 1-[5-(4-бромфенокси)пентил]-3-(нафтил-2-метил)урацилу (15), выход которых составил 65–78 % (таблица):
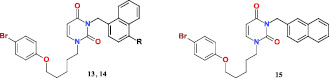
Выход и физико-химические свойства синтезированных соединений
|
Соединение |
R |
Выход, % |
Т. пл., °С |
Rf |
|
8 |
H |
78 |
96–98 |
0,67 |
|
9 |
3,5-Cl2 |
80 |
82–83 |
0,74 |
|
10 |
3,4-Cl2 |
89 |
94–95 |
0,69 |
|
11 |
2,4-Cl2 |
91 |
102–103 |
0,71 |
|
12 |
2,5-Cl2 |
87 |
137,5–139 |
0,77 |
|
13 |
H |
78 |
112–113 |
0,73 |
|
14 |
Br |
65 |
92,5–93,5 |
0,65 |
|
15 |
– |
67 |
91–93 |
0,72 |
Заключение
Осуществлен синтез 8 новых, ранее не описанных в литературе 1-[5-(4-бромфенокси)пентил]производных урацила, дополнительно содержащих в положении 3 пиримидинового цикла бензильный или нафтилметильный заместитель. Исследованы физико-химические и спектральные свойства полученных веществ. Новые соединения представляют значительный интерес в качестве потенциальных ненуклеозидных ингибиторов репродукции цитомегаловируса человека.
Работа выполнена при поддержке гранта Российского фонда фундаментальных исследований № 15-44-02299 р_поволжье_а.
Библиографическая ссылка
Парамонова М.П., Озеров А.А., Новиков М.С. СИНТЕЗ 3-[БЕНЗИЛ(НАФТИЛМЕТИЛ)]ПРОИЗВОДНЫХ 1-[5-(4-БРОМФЕНОКСИ)-ПЕНТИЛ]УРАЦИЛА КАК ПОТЕНЦИАЛЬНЫХ ИНГИБИТОРОВ РЕПРОДУКЦИИ ЦИТОМЕГАЛОВИРУСА ЧЕЛОВЕКА // Международный журнал прикладных и фундаментальных исследований. – 2015. – № 9-2. – С. 329-332;URL: https://applied-research.ru/ru/article/view?id=7320 (дата обращения: 19.04.2024).

