Болезнями соединительных тканей суставов в нашей стране страдают от 7,5 до 30 млн человек. Во всех суставах изменения начинаются прежде всего в хрящевой ткани. Происходит истончение фибрилл коллагена, расслоение волокон и потеря их эластичности [1]. Кроме того, происходит разрушение некоторых компонентов ткани. Проектирование состава нутрицевтиков на основе гидролизата коллагена типа II помогает решить проблему восполнения этих недостающих компонентов ткани. Разработкой нутрицевтиков из компонентов соединительных тканей может быть решена задача рационального поиска природных лекарственных средств, способных оказывать биофармацевтическое действие.
Современные лекарства (стероидные и нестероидные препараты) лишь снимают боль в суставах. Более того, они обладают побочным действием на органы и системы человека. Хондропротекторы имеют синтетическое происхождение и слабо усваиваются. Соединительная ткань как источник белкового материала давно используется в диетологии детского питания, разработке сред для культивирования клеток [2]. Гидролизаты коллагена применяют для лечения артрита и остеопороза в странах Европы и США [3, 5]. Природные хондропротекторы – глюкозаминогликаны – можно получить из хрящевой ткани рыб и других морских животных [4]. Ферментативный гидролиз позволяет сохранять необходимые вещества в нативной молекулярной форме [2]. Целью данной работы является исследование гидролиза биополимеров хрящевой ткани под влиянием фитопаина в зависимости от условий протеолиза. Конечной задачей является получение ферментативных гидролизатов для профилактики и лечения болезней суставов.
Материалы и методы исследования
Хрящи крупного рогатого скота и свиней были получены из трахей сразу после забоя животных. В процессе обезжиривания гомогенатов количество жира снизилось от 3 % до 0,02 %. Декальцинирование гомогената привело к снижению содержания кальция в 2 раза.
Мы исследовали гидролиз белков хрящевой ткани, применяя ферменты протепсин (ЗАО «ЗЭФ», Россия), химопсин (ООО «Самсон-Мед», Россия), панкреатин (AppliChem), папаин (AppliChem). Ферментный препарат фитопаин был получен из плодов папайи (Эквадор) по ТУ 9291-003-49959837-99. Он содержит комплекс папаина, химопапаина, протеиназы К (цистеиновые протеиназы), эстеразы и лизоцима.
Одним из физических факторов, ограничивающих ферментативный гидролиз, является степень измельчения ткани, а, следовательно, доступность молекул фермента для молекул биополимеров матрикса. Эта задача решается применением специального оборудования для дезинтеграции ткани. В нашей работе мы использовали механический гомогенизатор тканей типа домашнего миксера и гомогенизатор высокого давления (ГВД), а именно ГВД «Донор-3». ГВД пропускает под высоким давлением через узкую кольцевую микрощель хрящевую ткань, измельчённую на механическом миксере до 3-4 мм (3000-4000 мкм), и при этом разрушает частицы, гомогенизируя их. Гиалиновые хрящи были гомогенизированы до частиц размером 700-800 мкм. Средний размер частиц и полидисперсность после гомогенизации мы измеряли на фотонном корреляционном допплеровском фотометре NanoSizer TM фирмы Coulter (США).
При разработке технологии получения ферментативных гидролизатов требуется определить степень расщепления белкового субстрата и глубину гидролиза. Критерием эффективности расщепления ферментом субстрата может быть степень гидролиза, определенная по параметру DH [6]. Параметр DH вычисляют как отношение массовой доли аминного азота к массовой доле общего азота в гидролизате. Аминный азот определяли используя окрашивание гидролизата нингидрином. Взаимодействие нингидрина с аминокислотами в слабокислой среде при рН = 5,5 приводит к образованию дикетогидриндилиденкетогидринамина (комплекс Руэмана). Общий азот был определен методом Кьельдаля.
Анализ полученных гидролизатов мы проводили применяя следующие методы: гель-электрофорез в полиакриакриламидном геле (ПААГ– SDS, 7,5 %), спектофотометрию (Specord UV, Германия), МАЛДИ масс-спектрометрию: MALDI-TOF спектрометр (Autoflex speed, Bruker, Германия) и ЯМР-спектроскопию: ЯМР спектрометр Bruker 600 AVANCE III (Bruker BioSpin, Reinshtetgen, Германия).
Результаты исследования и их обсуждение
Степень гидролиза образцов, расщепленных фитопаином, была выше по сравнению со степенью гидролиза образцов, полученных под влиянием протепсина, химопсина, панкреатина, папаина. Параметр DH (степень гидролиза), определенный для фитопаина, имеет максимальную величину при температуре 55оС (Рис. 1). Степень гидролиза увеличивается с повышением концентрации фермента от 10 до 20 %. Исследование кинетики протеолиза показывает, что максимальное количество аминного азота образуется в течение 3 часов. В одинаковых условиях действия фитопаина и папаина (AppliChem) степень гидролиза у папаина была в 2 раза ниже.
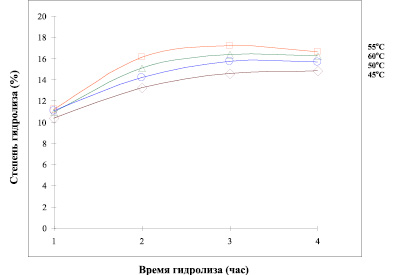
Рис. 1. Влияние различных температур на степень гидролиза под действием фитопаина в 0,01 М цитратном буфере, рН 6,0
На электрофореграммах (рис. 2) показано, что количество низкомолекулярных пептидов в гидролизатах, полученных после действия фитопаина, больше по сравнению с гидролизатами, полученными под влиянием папаина (AppliChem): образцы 3 и 5.
Качественный состав гидролизатов был исследован методами ЯМР- и масс-спектрометрии. Расщепленные фибриллы коллагена были получены при следующих условиях гидролиза: фитопаин в 0,01 М цитратном буфере, рН 6,0; Т = 55 °С, С = 10 %, время гидролиза – 3 часа. Определена идентичность сигналов в образцах гидролизатов биополимеров гиалиновых хрящей свиней (образец 1) и крупного рогатого скота (образец 2). Спектры ЯМР соответствуют пептидам, содержащим 10-30 аминокислотных остатка (рис. 3).
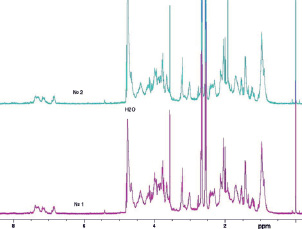
Рис. 3. Протонные ЯМР-спектры гидролизатов биополимеров гиалиновых хрящей свиней (образец 1) и крупного рогатого скота (образец 2). Двухмерные (2D) спектры ядерного магнитного резонанса регистрировали на ЯМР спектрометре Bruker 600 AVANCE III
Результаты масс-спектрометрии подтверждают эти данные и показывают наличие пептидов молекулярной массы от 2000 до 4000 Д (рис. 4 – В). С повышением температуры протеолиза до 60оС количество пептидов снижается, а их молекулярная масса изменяется от 2000 до 5000 Д (рис. 4 – А).
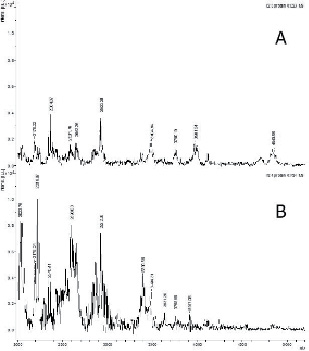
Рис. 4. Распределение молекулярных масс пептидов в гидролизатах биополимеров гиалиновых хрящей крупного рогатого скота, полученных после действия фитопаина в 0,01 М цитратном буфере, рН 6,0, С = 10 % и при температурах: А) Т = 60 °С, В) Т = 55 °С
В гидролизатах хрящевой ткани идентифицированы дисахариды и олигосахариды гиалуроновой кислоты, хондроитин-4-сульфата (рис. 5-В) [7]. Повышение температуры до 60 °С не изменяет их состав и количество (рис. 5-А). Однако, одновременное увеличение температуры до 60 °С, а концентрации фитопаина до 15 % приводит к разрушению дисахаридов и олигосахаридов хондроитин-4-сульфата (рис. 5-С). Дисахариды гиалуроновой кислоты проявляют более высокую устойчивость в этих условиях протеолиза.
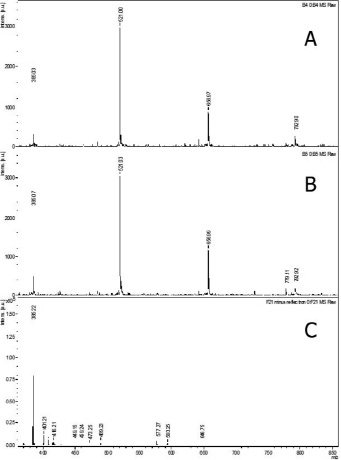
Рис. 5. Распределение молекулярных масс глюкозаминогликанов в гидролизатах биополимеров гиалиновых хрящей крупного рогатого скота, полученных после действия фитопаина в 0,01 М цитратном буфере, рН 6,0, при разных температурах и концентрациях: А) Т = 60 °С, с = 10 %; В) Т = 55 °С, с = 10 %; С) Т = 60 °С, с = 15 %
Заключение
В результате проведенных экспериментов мы определили, что параметрами процесса гидролиза, существенно влияющими на степень гидролиза, являются температура, величина рН, продолжительность процесса, концентрация фермента. Нами показано, что наибольшая степень гидролиза наблюдается при температуре ферментации, равной 55 °С. Мы определили максимальные условия получения гидролизатов под влиянием фитопаина, при которых образуются пептиды и дисахариды глюкозаминогликанов: рН 6, 0; Т = 55 °С, 10 % фитопаина, время гидролиза 3 часа. Нами разработан основной состав нутрицевтиков: мы получили гидролизаты хрящевой ткани с молекулярно-массовым распределением структурных элементов биополимеров хрящевой ткани, изменяющиеся от 350 Д до 5000 Д. Найдено, что значения параметров гидролиза ферментного препарата фитопаина выше значений параметров гидролиза папаина (AppliChem). Если сравнивать гидролизаты хрящей, полученные в патенте [8] под действием папаина (Sigma), молекулярные массы которых варьируют от 1500 Д до 10000 Д, и гидролизаты, полученные под влиянием фитопаина, последние содержат больше низкомолекулярных веществ. Комплекс ферментов, содержащихся в фитопаине, расщепляет больше связей в хрящевых гомогенатах по сравнению с папаином (AppliChem). Полученные гидролизаты можно применять в качестве нутрициального средства для профилактики и лечения болезней опорно-двигательного аппарата.

Рис. 2. Электрофореграммы (ПААГ– SDS, 7,5 %) гидролизатов биополимеров хрящевой ткани, полученных при следующих условиях: 1. Маркеры (100, 30, 25, 20, 10, 5 и 3,4 кДа). 2. Коллаген «Ультра» (ООО «Алина Фарма», Московская обл.). 3. Гидролизат биополимеров хрящевой ткани, полученный под влиянием фитопаина в 0,01 М цитратном буфере, рН 6,0; Т = 55 °С, концентрация фермента 10 %. 4. Контроль, фитопаин без гидролиза. 5. Гидролизат биполимеров хрящевой ткани, полученный под влиянием папаина в 0,01 М цитратном буфере, рН 6,0; Т = 55 °С, концентрация фермента 10 %. 6. Гидролизат биополимеров хрящевой ткани с дезоксихолатом. (Эксперименты выполнены Христиным М.С.)
Работа выполнена при финансовой поддержке Фонда содействия развитию малых форм предприятий в научно-технической сфере, программа Старт-2014, соглашение № 183ГС1/8727.
Библиографическая ссылка
Николаева Т.И., Молчанов М.В., Лауринавичюс К.С., Капцов В.В., Шеховцов П.В. ФЕРМЕНТАТИВНЫЙ ГИДРОЛИЗ БИОПОЛИМЕРОВ ХРЯЩЕВОЙ ТКАНИ ПОД ВЛИЯНИЕМ ФИТОПАИНА // Международный журнал прикладных и фундаментальных исследований. – 2015. – № 12-7. – С. 1252-1256;URL: https://applied-research.ru/ru/article/view?id=8129 (дата обращения: 19.04.2024).

