В настоящее время тромбоэмболия легочной артерии (ТЭЛА) считается одним из тяжелейших острых сосудистых заболеваний, сопровождающихся высокой летальностью, являясь третьей по частоте причиной смерти в развитых странах. Основными факторами риска развития ТЭЛА являются: тромбофлебит глубоких вен, пожилой возраст, длительные хирургические операции, варикозная болезнь вен нижних конечностей, хроническая сердечная недостаточность, онкологические заболевания, травмы и другие [2, 3, 7].Особую группу пациентов составляют беременные с ТЭЛА. Ограничение существующих методов своевременной диагностики (КТ-ангиопульмонография, перфузионная сцинтиграфия легких, лабораторная диагностика), а также полноценной терапии заболевания (тромболитическая и антикоагулянтная) определяет высокую степень неблагоприятных исходов у данной категории, что, в свою очередь, ведет к увеличению материнской смертности. Альтернативой консервативной терапии ТЭЛА может служить тромбэктомия из легочной артерии и ее ветвей, однако, по понятным причинам, в обзоре мировой литературы имеются лишь единичные сообщения об успешном применении хирургических методов у беременных. Giovanni Saeed (2014 г.), анализируя англоязычную литературу за период с 1970 по 2012 гг., сообщает о 12 случаях хирургического лечения массивной ТЭЛА у беременных [22, 23, 24, 27, 28]. В отечественной литературе первый случай зарегистрирован 28 апреля 2006 г. [4].
Приводим собственное наблюдение.
Больная Б., 35 лет, заболела остро на 10-11-й неделе беременности. 26.06.15 поступила по наряду СМП в ГКБ №79 напрямую в отделение реанимации с жалобами на выраженную одышку при минимальной физической нагрузке, кашель, эпизод потери сознания. По данным обследования при поступлении в общеклиническом анализе крови отмечалась нормохромная анемия легкой степени тяжести (Hb 109 г/л, Эр. 3,48*10^12/л, MCV 89,0). В биохимическом анализе крови обращало внимание повышение С-реактивного белка (85,2 мг/л), по данным коагулограммы имелось значимое повышение D-димеров (24000), тромбоэластограммы – угол альфа 0 градусов. На ЭКГ отмечалась синусовая тахикардия, отклонение электрической оси сердца вправо. УЗ-картина соответствовала 10-й неделе беременности: в полости матки определялось одно плодное яйцо с одним живым эмбрионом, КТР 27 мм, определялись сердцебиение, дифференцирующийся хорион, тонус матки повышен н был, пороки развития выявлены не были. На КТ органов грудной клетки признаки двусторонней полисегментарной инфарктной пневмонии. По данным КТ-ангиопульмонографии в области бифуркации легочного ствола определялся тромб-«наездник» диаметром 8 мм, распространяющийся в обе легочные артерии, ширина общего легочного ствола: 3,0 см; левой легочной артерии 2,1 см; правой проксимальной легочной артерии 2,1 см; правой дистальной легочной артерии 1,7 см. Источником ТЭЛА явился тромбоз левой подколенной вены. Учитывая характер и локализацию тромба, невозможность выполнения тромболизиса (пациентка изъявила желание сохранить беременность), высокий риск фрагментации тромба с развитием дистальной эмболии легочных артерий, пациентке в ходе консилиума врачей было решено выполнить операцию: первым этапом постановку кава-фильтра в нижнюю полую вену, вторым этапом – тромбэктомию из ствола ЛА в условиях ИК. В условиях рентгеноперационной была выполнена имплантация фильтра OptEase Cordis в нижнюю полую вену, после чего пациентка была переведена в кардиохирургическую операционную, где ей была выполнена открытая тромбоэмболэктомия из легочной артерии в условиях искусственного кровообращения (время ИК составило 18 минут). Интраоперационно: срединная стернотомия, перикардотомия и подключение аппарата искусственного крвообращения (системный гепарин, канюляция аорты, канюляция правого предсердия и верхней полой вены). Начато искусственное кровообращение в условиях нормотермии. Пережаты полые вены. Разрез ствола лёгочной артерии. Из ствола легочной артерии и её ветвей отсосом аспирированы тромботические массы («свежие» и «застарелые» рис. 1 и рис. 2). Дистально справа и слева в легочное русло введен катетер Фогарти. Тромбов нет. Разрез ЛА ушит проленом 4/0.

Рис. 1
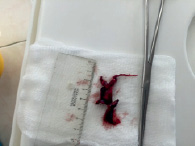
Рис. 2
Ранний послеоперационный период протекал в условиях отделения реанимации. Проводилась инфузионная, симптоматическая, антикоагулянтная терапия, антибиотикотерапия. На фоне проводимого комплексного лечения была отмечена стабилизация состояния и через 2-е суток пациентка была переведена в профильное отделение для дальнейшего лечения. В послеоперационном периоде при ЭхоКГ отмечалось умеренное расширение правого предсердия (ЛП 3,5 см, ПП=ЛП), легочная гипертензия (СДПЖ 38 мм .рт. ст), относительный гипокинез МЖП, ФВ 68 %, удовлетворительная сократительная способность миокарда. На серии контрольных рентгенограмм органов грудной клетки поствоспалительные изменения нижней доли правого легкого, разрешение двустороннего гидроторакса. Учитывая отрицательную динамику тромбоза вен н/к на фоне проводимой антикоагулянтной терапии, а также увеличение факторов риска ретромбоза и повторных эпизодов ТЭЛА с дальнейшим течением беременности, было решено отказаться от удаления кава-фильтра. На сроке 14–15 недель беременности было выполнено УЗИ плода, данных за пороки развития выявлено не было, плод был развит пропорционально, соответствовал срокам беременности. Пациентка была выписана из стационара на 16-й день после операции с рекомендациями о парентеральном приеме низкомолекулярных гепаринов и амбулаторном наблюдении в женской консультации при родильном доме ГКБ № 79. Во втором и третьем триместре беременность протекала без осложнений. В 35-36 недель беременности была произведена плановая госпитализация в родильный дом для динамического наблюдения за состоянием пациентки и плода. По результатам наблюдения нарушений в развитии и функциональном состоянии плода не выявлено. 30 декабря 2015 года в связи с развитием регулярной родовой деятельности в гестационном сроке 38–39 недель было произведено родоразрешение путем операции Кесарева сечения. Родился живой доношенный мальчик весом 3130 г., ростом 50 см с оценкой по шкале Апгар 8 и 9 баллов. Послеродовый период протекал без особенностей. Родильница выписана на 10-ые сутки домой с ребёнком в удовлетворительном состоянии.
Выводы
Хирургическое лечение в условиях искусственного кровообращения у беременных пациенток при наличии показаний возможно и не оказывает негативного влияния на внутриутробное развитие плода, однако требует дальнейшего накопления опыта.
Библиографическая ссылка
Косаченко А.Ж., Подтетенев А.Д., Назарян К.Э., Акимов И.В., Абраамян Т.Р., Тихонов А.В., Назаров В.В., Кандауров А.Э. СЛУЧАЙ УСПЕШНОЙ ТРОМБЭКТОМИИ ИЗ ЛЕГОЧНОЙ АРТЕРИИ У БЕРЕМЕННОЙ ПАЦИЕНТКИ // Международный журнал прикладных и фундаментальных исследований. – 2016. – № 4-3. – С. 563-565;URL: https://applied-research.ru/ru/article/view?id=9013 (дата обращения: 19.04.2024).

