Лактоферрин (ЛФ), относится к группе трансферрина, обратимо связывает также как трансферрин два иона железа и обладают не только сходством первичной структуры (59 % гомологии) но также пространственное строение очень близкое с тождественными участками связывания железа. Этот многофункциональный гликопротеин вырабатывается железистым эпителием слизистых оболочек у различных видов млекопитающих, включая человека, коров, коз, лошадей, собак, и грызунов, а также обнаружен у рыб [2], ЛФ присутствует в молоке, слезах, желчи, слюне, вагинальной жидкости, поте, сперме и секретах дыхательного и желудочно-кишечного трактов [3, 4].
ЛФ в акушерской и гинекологической практике изучен недостаточно. По данным А.Н. Дюгеева и А.Н. Шипулина, максимальный уровень ЛФ в плазме крови отмечается во время менструаций. Содержание ЛФ в плазме крови гораздо выше у женщин в постменопаузальном периоде, чем в пременопаузе. В вагинальном секрете после менструации количество ЛФ повышается до 62, 9 – 218,0 мкг\мл, по сравнению с 3,87 – 11,4 мкг\мл до месячных. У женщин, принимающих гормональные контрацептивы, уровень ЛФ во влагалище снижается. Эти и другие исследования свидетельствуют о гормональной зависимости изменений концентрации ЛФ в биологических жидкостях [1]. В последние годы определены некоторые молекулярные механизмы регулирования функции эстрогенсвязывающих рецепторов эндометрия и генов лактоферрина [10].
При нормально протекающей беременности в сыворотке крови у здоровых женщин не выявлено изменений уровня ЛФ [Crocker 2000, Prieto J.A., 1997, Rebelo I.,1996]. Повышение уровня ЛФ в плазме крови выявлено при длительном безводном периоде, преждевременных родах, внутриматочной инфекции у беременных и при нефропатиях [Otsuki K.,1999, Nishiya K., 1999].
Таким образом, остается неясным вопрос происхождения лактоферрина в крови беременных. Цель нашей работы исследовать ткань плаценты на содержание лактоферрина, определить его тканевую локализацию и концентрацию в плаценте здоровых женщин и страдающих гестозами.
Материалы и методы исследования
В работе использовали плаценты полученные при своевременных родах от здоровых женщин и страдавших преэклампсией. Материал подвергали исследованию не более чем через 12 часов после родов. Водно-солевые экстракты готовили на трис-глициновом буфере рН = 8,6. Бутаноловые экстракты готовили добавлением к гомогенату плаценты на трис-глициновом буфере рН = 8,6 холодного бутанола в отношении 1:4 перемешивали, центрифугировали. После центрифугирования бутанол сливали, а водную фазу фильтровали, диализовали против трис-HCl буфера (рН-8,6) при + 4С и концентрировали в ячейке «Миллипор-РSАС» (США). Определение локализации ЛФ в ткани плаценты проводили на криостатных срезах непрямым методом реакции иммунофлюоресценции [7]. Первые антитела – очищенные иммуноглобулины из поликлональной кроличьей антисыворотки к лактоферрину человека. Вторые антитела поликлональные козьи ФИТЦ(флюорохром изотиоцианат) антитела к иммуноглобулинам кролика [Thermo Fisher Scientific].
Иммуноферментный анализ на лактоферрин проводили в соответствии с инструкцией производителя [Вектор-Бест, Новосибирск] Регистрацию проводили фотометрически на фотометре для ИФА при длине волны 492 нм. Концентрацию определяли по калибровочному графику, исходя из полученного значения оптической плотности. Полученные значения концентраций умножали на коэффициент разведения соответствующих сывороток. Контрольную сыворотку сравнивали с полученными результатами проведенного анализа.Электрофоретическое и хроматографическое исследование иммуноэлектрофорез и иммунодиффузионный анализ в агаре (ИДА) проводили по стандартным протоколам [7].
Результаты исследования и их обсуждение
Содержание лактоферрина в водно-солевых экстрактах плаценты по нашим данным колеблется в пределах 4950,0 ± 320,0 нг/мл., что в пересчете на вес ткани составляет 1237,5 ± 470,0 нг/мг. Столь высокое содержание лактоферрина не может быть объяснено простым сывороточным пропитыванием и мы предположили участие плаценты в синтезе лактоферрина.
Иммуногистохимическим методом лактоферрин обнаружен нами в эпителии ворсин плаценты (рис. 1).
Мы провели выделение лактоферрина из ткани плаценты по распространенной методике [2] с нашими модификациями. Разработан метод очистки лактоферрина в котором выход продукта составляет не менее 85 %. На первом этапе исходный материал (3000,0 мл водно-солевого экстракта плаценты) смешивали с сульфатом аммония (ч.д.а.) до концентрации 2М и после 6-8 часовой экспозиции центрифугировали при 10000 об/мин в течении 45 минут. На втором этапе полученный осадок ресуспендировали в буфере (10 мМ трис-НС1, pH 7,6, 1 мМ ЭДТА, 1 ММ железо(III)-аммоний). На третьем этапе полученный раствор наносили на колонку (4.5x 60 см) гепарин-сефарозы (Sigma, США) нредварительно уравновешенную 20 мМ Трис-НС1, рН 7.5. Сорбент промывали 20 мМ Трис-НС1, рН 7.5, затем тем же буфером, содержащим 1 %-ный тритон Х-100, и снова буфером без тритона до исчезновення оптического поглощения. Элюцию проводили с помощью лииейного градиента концентраций NaCl от О до 1 М в 20 мМ Трис-НС1, рН 7.5. Полученные фракции диализовали и концентрировали в ячейке «Миллипор-РSАС» (США). Зону выхода ЛФ определяли с помощью иммунохимического анализа фракций. Отличие нашей модификации перед существующими методами аффинной хроматографии на гепарин сефарозе [7] заключается в том, что колонка с гепарин-сефарозой перед началом хроматографии обрабатывается 0,2-0,3 % раствором формальдегида, который окисляя минорные функциональные группы гепарина (NH2 например) повышает его отрицательный заряд и, соответственно, повышает аффинность по отношению к лактоферрину. По нашим расчетам константа диссоциации снижалась с 106 М до 85 М, что свидетельствует о повышении аффинности лактоферрина к гепарину и более полному его связыванию. Полученный лактоферрин представляет собой гликопротеин с молекулярной массой около 84000, коэффициентом диффузии в агарозе 3,1х10 – 7 см2 сек-1, относительной электрофоретической подвижностью 0,42. этот белок обладает малой гидрофобностью и элюируется с фенилсефарозы 0,4 М сульфатом аммония. Изоэлектрическая точка его равна 9,2.
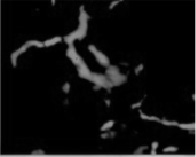
Рис. 1. Локализация лактоферрина в ткани плаценты. Иммуногистохимическое исследование. Х 240
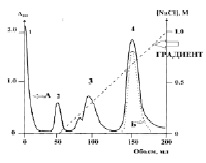
Рис. 2. Профиль хроматографического разделения лактоферрина на гепарин-сефарозе. А. поглощение белка при 280 нм; Б. иммунохимическая детекция лактоферрина

Рис. 3. Иммуноэлектрофорез лактоферрина. 1. плацентарный лактоферрин; 2. лактоферрин молока человека; А – антисыворотка к белкам крови человека; Б-антисыворотка к лактоферрину человека
Полученный лактоферрин, несмотря на полную иммунохимическую идентичность с лактоферрином молока человека, по некоторым физико-химическим характеристика отличается от него. Особенно заметно отличие в электрофоретической подвижности плацентарного лактоферрина и лактоферрина молока человека (рис. 3). По нашим данным относительная электрофоретическая подвижность плацентарного лактоферрина0,41 ± 0,006, а очищенного препарата лактоферрина из молока человека 0,47 ± 0,003. Эти различия можно считать подтверждением существования нескольких изоформ лактоферрина, обладающих одинаковой молекулярной массой, иммунохимической идентичностью, но различающихся сродством к различным ионогенным групамм [5].
Количественное определение лактоферрина в плаценте провели раздельно в водно-солевых и бутанольных экстрактах. Как сообщалось выше содержание лактоферрина в водно-солевых экстрактах плаценты в пересчете на вес ткани составляет 1237,5 ± 470,0 нг/мг. В бутаноловых экстрактах плаценты лактоферрин содержится в концентрации 2379,0 ± 210 нг/мг ткани. То есть, получены доказательства существования цитозольных и мембраносвязанных вариантов лактоферрина. Этот факт отмечен впервые. Содержание лактоферрина в водно-солевых и бутаноловых экстрактах плаценты, женщин страдавших гестозами определяется в пределах, соответственно, 1485,0 ± 180,0 нг/мг ткани и 2593,11 ± 640,0 нг/мг ткани. Эти данные свидетельствуют о тенденции роста концентрации лактоферрина в ткани плаценты. Если мембрансвязанная форма (бутанольная фракция) увеличивается незначительно (чуть более 9 %), то водорастворимая форма возрастает на 20 % (р ≤ 0,01).
Рост уровня лактоферрина в плацентах женщин, страдавших гестозом, мы расцениваем как признак дегенерации клеток эпителия ворсин плаценты, т.к. существуют данные об участии лактоферрина в активации процессов апоптоза [6].
По нашим данным, содержание лактоферрина в сыворотке крови беременных с физиологически протекающей беременностью колеблется в пределах показателей у здоровых доноров (1500-2200 нг/мл) в период до 24 недель. После этого срока, вплоть до 40 недель беременности отмечено повышение уровня ЛФ до 3500-6500 нг/мл у 88 % женщин. Интересно отметить, что почти у всех обследованных рожениц (96 %) отмечается ещё большее (в 2-6 раз) увеличение степени гиперлактоферринемии в образцах сывороток крови, взятых непосредственно в момент родов, по сравнению с образцами крови, взятых за 6 часов до и 6 часов после родоразрешения. Учитывая наши данные по обнаружению лактоферрина в водно-солевых и бутаноловых экстрактах плаценты, можно допустить, что причиной гиперлактоферринемии у беременных и рожениц является продукция лактоферрина плацентой. Это согласуется с результатами Thaler и соавторов [9], которые с помощью моноклональных анител к ЛФ выявили реакцию интерстиция трофобласта базальной площадки плаценты человека и ворсинок цитотрофобласта, но не ворсинок хориона.
Библиографическая ссылка
Ушакова М.В., Николаева Н.Н. ПЛАЦЕНТАРНЫЙ ЛАКТОФЕРРИН В НОРМЕ И ПРИ ПРЕЭКЛАМПСИИ // Международный журнал прикладных и фундаментальных исследований. – 2016. – № 5-4. – С. 580-583;URL: https://applied-research.ru/ru/article/view?id=9454 (дата обращения: 17.04.2024).

