Гипертоническая болезнь относится к самым часто встречающимся патологиям сердечно – сосудистой системы и распространена во всем мире, особенно в цивилизованных странах. Имеются данные о том, что в патогенезе первичной гипертензии ведущая роль принадлежит мембранным нарушениям [7].
Классической моделью для изучения свойств мембраны при различной патологии служит мембрана эритроцита. Его цитоплазматическая мембрана является ключевой в обеспечении и регуляции физиологической активности этих клеток. Специфические функции мембраны обеспечиваются её сложной структурной организацией, главными компонентами которой являются белки. Наиболее представительными белками в мембране эритроцитов человека являются спектрины, анионтранспортный белок полосы 3, а также сократительные белки – актин и тропомиозин. И, хотя мембраносвязанный гемоглобин (МСГ) представлен в меньшем количестве, чем остальные белки, он играет важную роль как в образовании и поддержании стабильности цитоскелета, так и в механизмах ферментативного катализа и внутриклеточной трансформации энергии [2].
В ряде работ отмечено высокое содержание МСГ у больных ИБС III-го функционального класса, язвой желудка или 12-ти перстной кишки, на лактатной модели гипоксического состояния [3], при остром отравлении монооксидом углерода [8], нитрита натрия и солянокислого фенилгидразина [10]. В наших работах также было выявлено повышение уровня МСГ у больных ИБС и ГБ, что указывало на деструктивные процессы в мембране эритроцитов [5]. Установлено, что образование избыточных ковалентных связей гемоглобина с мембранным скелетом, разрушает её белковую структуру и способствует окислению фосфолипидов через Са2+-зависимую липооксигеназную активность [10]. Кроме того, автор показал, что изменение взаимодействия мембраны эритроцита с гемоглобином может быть обусловлено повышенным содержанием в ней фосфатидилсерина и сфигномиелина, а также структурным состоянием самого гемоглобина. В монографии Ю.В. Постнова и С.Н. Орлова [7] показано, что нарушения структурной организации плазматической мембраны при первичной гипертензии вызваны изменениями в белках, образующих её цитоскелет. Тем не менее мы не нашли сообщений о влиянии МСГ на отдельные белки мембраны эритроцитов при сердечно – сосудистой патологии.
Целью нашей работы явилась оценка воздействия разных уровней мембраносвязанного гемоглобина на величину белков мембраны эритроцитов и их взаимосвязь у больных гипертонической болезнью.
Материалы и методы исследования
В исследовании принимали участие пациенты с гипертонической болезнью (ГБ) I и II степени (n = 51) в возрасте 42 ± 1,5 лет, мужского пола. Диагноз ГБ, а также дифференциальную диагностику для исключения симптоматических артериальных гипертоний проводили в соответствии с рекомендациями ВНОК (2008). Критериями исключения для больных являлись наличие острого инфарта миокарда или нарушения мозгового кровообращения в предшествующие 6 месяцев, нарушения ритма сердца, наличие приступов стенокардии напряжения, обострение интеркурентных заболеваний.
В контрольную группу входили клинически здоровые мужчины в количестве 29 человек, средний возраст которых составил 39 ± 1,3 лет. Исследование выполнено в соответствии со стандартами надлежащей клинической практики и принципами Хельсинской декларации. Все пациенты были ознакомлены с целями и основными положениями исследования. До включения в исследование у всех участников было получено письменное информированное согласие.
У всех пациентов определяли основные белки мембраны эритроцитов, мембраносвязанный гемоглобин. Определение МСГ в структурных фрагментах мембраны эритроцитов проводили в гемолизате по убыли гемоглобина до и после центрифугирования при 6000 об/мин на спектрофотометре СФ-2000 при длине волны 536 нм по методике З.С. Токтамысовой и Р.Х. Биржановой [9].
Мембраны эритроцитов выделяли по методу Dodge [11]. Выделение и очистку водорастворимой фракции белков осуществляли на центрифугах «Allegra» 64R. Концентрацию белков определяли с использованием набора Qubit Protein Assay Kit («Invitrogen», США) на приборе Gubit Protein, согласно инструкции фирмы – изготовителя.
Одномерный электрофорез проводился на полиакриламидных гелевых пластинах с концентрацией разделяющего геля 7,5 % и 15 % в присутствии додецилсульфата натрия по методу Лэммли [12]. Окраска гелевых пластинок проводилась раствором Кумасси R250 («Sigma», США). Для определения массы исследуемых белков использовались наборы маркеров фирмы Bio-Rad (#161-0363) и Thermoscientific (#26614). Расчет количественного содержания мембранных белков (мкг на 1мг общего белка) выполнялся с помощью программы математической обработки электофореграмм [6].
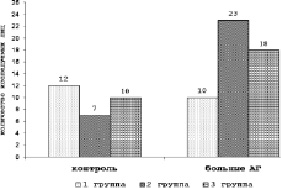
Рис. 1. Распределение лиц контрольной группы и больных АГ по уровню мембраносвязанного гемоглобина. Примечание. *p < 0,05 – значимость различий между соответствующими группами контроля и больных АГ; **p < 0,05 – между 1-ой и остальными группами больных АГ, точный критерий Фишера
Данные к рис. 1
|
контроль |
больные АГ |
|
|
1 группа |
12 |
10 |
|
2 группа |
7 |
23 |
|
3 группа |
10 |
18 |
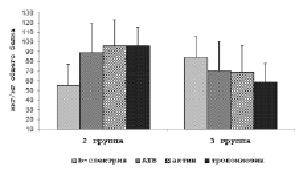
Рис. 2. Количественное содержание белков мембраны эритроцитов у больных АГ с разным уровнем мембраносвязанного гемоглобина. Примечание. Me (Q25-Q75); р – критерий Манн-Уитни
Данные к рис. 2
|
2 группа |
3 группа |
|
|
β-спектрин |
55 |
83,9 |
|
АТБ |
89 |
70,3 |
|
актин |
95,9 |
69 |
|
тропомиозин |
95,8 |
58,5 |
Характер корреляционных связей между количественным содержанием белков мембраны эритроцитов у больных АГ 2-ой и 3-ей групп
|
2 группа (n = 23) |
|||||||||
|
1 |
2 |
2.1 |
3 |
4.1 |
4.5 |
5 |
6 |
7 |
|
|
2 |
0,93 |
||||||||
|
2.1 |
0,79 |
0,68 |
|||||||
|
3 |
0,63 |
0,60 |
0,55 |
||||||
|
4.1 |
0,57 |
0,48 |
0,65 |
0,92 |
|||||
|
4.5 |
0,49 |
0,53 |
0,84 |
0,93 |
|||||
|
5 |
0,62 |
0,66 |
0,73 |
||||||
|
6 |
0,52 |
0,44 |
0,56 |
0,78 |
0,80 |
0,86 |
0,56 |
||
|
7 |
0,46 |
0,57 |
0,57 |
0,57 |
0,68 |
0,44 |
|||
|
8 |
0,59 |
0,44 |
0,59 |
0,76 |
0,72 |
0,75 |
0,53 |
0,84 |
0,73 |
|
3 группа (n = 18) |
|||||||||
|
2 |
0,74 |
||||||||
|
2.1 |
0,51 |
||||||||
|
3 |
0,51 |
0,62 |
|||||||
|
4.1 |
0,48 |
0,73 |
0,83 |
||||||
|
4.5 |
0,48 |
0,80 |
0,78 |
||||||
|
5 |
0,52 |
0,59 |
0,49 |
||||||
|
6 |
0,85 |
0,74 |
0,91 |
||||||
|
7 |
-0,74 |
||||||||
|
8 |
0,57 |
0,69 |
0,68 |
0,58 |
|||||
Примечание. 1 – α-спектрин, 2 – β-спектрин, 2.1 – анкирин, 3 – АТБ, 4.1 – полоса 4.1, 4.5 – транспортёр глюкозы, 5 – актин, 6 – Г-3-ФДГ, 7 – тропомиозин, 8 – Гл.-S-Тр. Коэффициенты ранговой корреляции Спирмена – p < 0,05. Тесные связи выделены жирным шрифтом.
В результате исследования 320 электрофореграмм белкового спектра была проведена количественная оценка 10-ти мембранных белков эритроцитов: α-спектрина, β-спектрина, анкирина (полоса 2.1), анион-транспортного белка (АТБ), полосы 4.1, трансмитера глюкозы (GLUT), актина, глицеральальдегид-3-фосфатдегидрогеназы (Г-3-ФДГ), тропомиозина и глутатион-S-трансферазы (Гл.-S-Тр.).
Статистическая обработка результатов проводилась с помощью пакета программ «Statistica 6.0». Полученные данные в сравниваемых группах анализировали, используя критерий Манна-Уитни. Взаимосвязь переменных оценивали путём изучения парной ранговой корреляции (Спирмен). Различия считались достоверными при р < 0,05.
Результаты исследования и их обсуждение
При анализе уровня МСГ выяснилось, что его количество у больных АГ было значимо выше (р = 0,021), чем у лиц контрольной группы – соответственно: 9,22 (7,1-11,8) и 6,6 (5,0-9,4). Учитывая значительный разброс данных, все больные АГ и лица контрольной группы были разделены по уровню МСГ на три группы: 1-ая группа – с содержанием МСГ меньше 6 %, 2-ая группа – от 6 до 9,0 % и 3-я группа – больше 9,0 % (рис. 1).
Из представленных данных видно, что в количественном отношении превалировали больные 2-ой группы, а меньший процент составили больные 1-ой группы. Среди клинически здоровых людей существенных межгрупповых различий выявить не удалось.
Сравнительный анализ изучаемых белков мембраны эритроцитов у контрольных лиц также не выявил межгрупповых различий. Исследование белковых компонентов мембраны эритроцитов у больных АГ (рис. 2) показало, что во 2-ой группе отмечалось меньшее количество β-спектрина и большее – анионтранспортного белка, актина и тропомиозина.
Как известно, основная функция спектринов – поддержание формы клеток и обеспечение их устойчивости к деформации, а также контроль над латеральной подвижностью интегральных мембранных белков [1]. Снижение содержания β-спектрина может приводить к потере эластичности мембраны, уменьшению деформабильных свойств и ухудшению прохождении эритроцитов через обменные капилляры. Большее содержание анионтранспортного белка (АТБ) у больных 2 группы, вероятно, оказывает регулирующее и координирующее влияние на метаболические процессы и структурное состояние мембраны так, как по своей природе он является полифункциональным и действует как сайт связывания мембранных белков. Иная картина наблюдалась при высоком уровне МСГ (3 группа): здесь отмечалось возрастание содержание β-спектрина, резкое снижение содержания АТБ, актина и тропомиозина, что говорит о повреждении цитоскелета мембраны у этой категории больных. Кроме того, снижение содержания тропомиозина приводит к еще большему изменению формы эритроцитов вплоть до образования эхиноцитов и сфероцитов, от которых отшнуровываются мелкие мембранные везикулы [7], содержащие тканевой фактор активации внешней системы свёртывания крови [4].
Корреляционный анализ межбелковых связей в мембране эритроцита показал, что количество и уровень этих связей у больных ГБ 2-ой и 3-ей групп значительно различались между собой. Так у больных 3-ей группы был существенно меньше уровень и количество межбелковых связей, чем во 2-ой группе Это касалось α-спектрина, анкирина, АТБ, полосы 4.1, транспорта глюкозы, актина и особенно тропомиозина (таблица).
Нужно отметить, что белкам полосы 2.1 (анкирин) и 4.1 также отводится ключевая роль в образовании цитоскелета мембраны. Оба белка обладают высокой чувствительностью к протеазам, легко фосфорилируются и связываются со спектринами. Именно изменения взаимодействия между спектринами, анкирином и фосфолипидами нарушают условия для поддержания в нормальном состоянии участки липидного бислоя мембраны и способствуют процессу экзоцитоза, приводящего к образованию мембранных везикул [7].
Таким образом, проведённые исследования показали, что высокий уровень мембраносвязанного гемоглобина оказывает существенное влияние на структурные, интегральные (β-спектрин, АТБ) и сократительные (актин, тропомиозин) белки мембраны эритроцитов. В результате количественного изменения этих белков мембраны и их взаимосвязей у больных гипертонической болезнью возникают нарушения структурной организации и функциональной активности мембраны, снижаются буферные свойства эритроцитов, нарушаются реологические и гемостазиологические характеристики крови. Такое состояние, несомненно, ухудшает перфузию крови в микроциркуляторном русле, тканевой газообмен и, тем самым, усиливает системную гипоксию, которая имеет место при данной патологии.
Библиографическая ссылка
Кузнецова Э.Э., Пивоваров Ю.И., Бабушкина И.В., Горохова В.Г., Сергеева А.С. ВЛИЯНИЕ РАЗНЫХ УРОВНЕЙ МЕМБРАНОСВЯЗАННОГО ГЕМОГЛОБИНА НА КОЛИЧЕСТВЕННОЕ СОДЕРЖАНИЕ БЕЛКОВ МЕМБРАНЫ ЭРИТРОЦИТОВ И ИХ ВЗАИМОСВЯЗЬ У БОЛЬНЫХ ГИПЕРТОНИЧЕСКОЙ БОЛЕЗНЬЮ // Международный журнал прикладных и фундаментальных исследований. 2016. № 6-3. С. 480-484;URL: https://applied-research.ru/ru/article/view?id=9636 (дата обращения: 16.01.2026).

