Введение
Пектины представляют собой семейство сложных полисахаридов, которые содержат 1,4-связанные α-D-галактозилуроновые остатки. В ряду пектиновых полисахаридов особый интерес вызывает гомогалактуронан (HG), представляющий собой линейную цепочку из 1,4-связанных остатков α-D-галактозилуроновой кислоты, в которой некоторые карбоксильные группы метилэтерефицированы. Они также могут быть О-ацетилированы в положениях С-2 и С-3 [1–3].
Степень этерификации (СЭ), которая выражается в процентах этерифицированных карбоксильных групп в молекуле пектина, является важным показателем для классификации пектинов. Пектины с высоким содержанием метоксильных групп (ВМ) (СЭ > 50 %) требуют относительно высокой концентрации растворимых твердых веществ и низкого рН для образования геля. Пектины с низким содержанием метоксильных групп (НМ) (СЭ < 50 %) образуют жесткие гели под действием кальция или многовалентных катионов, которые сшивают цепи галактуроновой кислоты [4, 5]. Пектин широко применяется в пищевой промышленности при производстве джемов, желе, мороженого и других пищевых продуктов, где он действует как желирующий агент и загуститель [6, 7]. Особый интерес пектин вызывает для использования в медицине. Связано это с тем, что он относится к полисахаридам, контролировать свойства которых можно путем изменения уровня кислотности окружающей среды, то есть показания рН. В частности, полисахариды, гелеобразование которых зависит от рН, можно использовать при создании наноконтейнеров для адресной доставки лекарств, поскольку уровень кислотности различных органов и тканей различается [8–10]. Отсутствие токсичности и описанные здесь свойства пектинов делают их очень интересными и привлекательными для приготовления лекарственных форм с контролируемым высвобождением [11–13]. Пектин также благотворно влияет на здоровье человека в сочетании с антибактериальными и протекторными препаратами [14–16].
Целью данной работы является модификация структуры пектина посредством введения гидрофобных фрагментов в результате реакции с гидроксидом тетрабутиламмония и последующего алкилирования карбоксильных групп полученного продукта метиловым эфиром каприловой кислоты для дальнейшего использования в качестве носителя лекарственных средств.
Материалы и методы исследования
Все химические вещества, используемые в работе, включая пектин, каприловую кислоту, монокалийфосфат, гидроксид тетрабутиламмония, гидроксид натрия и другие реагенты, являлись коммерческими препаратами и материалами аналитического класса. FTIR-спектры были записаны на приборе ИК Фурье-спектрометр ФСМ 1201 с использованием KBr. Спектры 1Н-ЯМР регистрировали на спектрометре Bruker AVANCE с частотой 400 МГц, в качестве растворителя для ЯМР-анализа использовали D2О. Термограммы для термогравиметрического анализа (TGA) были получены на термогравиметрическом анализаторе TGA-C (Mettler Toledo, USA).
Приготовление метилового эфира каприловой кислоты. В фильтр объемом 100 мл с магнитным двигателем и обогревателем добавляется 1 г октановой кислоты. В качестве катализатора добавляется две капли метансульфоновой кислоты при перемешивании в течение 5 мин при температуре 70 ºС. После этого добавляется около 2 мл (в 10 раз больше метилового спирта), который играет роль растворителя и реакционноспособного вещества одновременно, реакционная смесь перемешивается при температуре 70 ºС в течение 4 ч, выход реакции отслеживается с помощью ТСХ. Для фиксации эфирного продукта использовалась смесь (25 % н-гексана: 75 % этилацетата). Количество жирной кислоты для получения метилового эфира составляло 69·10-4 моль.
Модификация структуры пектина с использованием гидроксида тетрабутиламмония (ТБА-ОН). В фильтр объемом 100 мл с магнитной мешалкой добавляют (0,5 г 0,0028 моль) пектина и 50 мл дистиллированной воды и перемешивают при температуре 40 ºС. После этого добавляют тетрабутиламмоний (ТБА-ОН) по каплям при перемешивании до тех пор, пока реакция не завершится и не будет получен ярко-желтый раствор с рН 8–9. Затем раствор экстрагируют с помощью морозильной камеры в течение 72 ч для получения гибкого желтого полимера, который хорошо растворим в сульфоксиде натрия.
Получение сложного эфира тетрабутиламмонийного пектина (Рес-ТБА). В дополнение к продукту реакции первой фазы добавляют (0,6 г) тетрабутиламмонийного пектина (ТБА-пектин) и 10 мл карбоната калия в качестве катализатора (0,4 г / 10 мл) при 70 ºС, перемешивают в течение 6 ч. Полученный продукт отделяется 100 мл ацетата, фильтруется, промывается несколько раз метиловым спиртом (около 5 мл), осаждается этилацетатом, фильтруется и сушится в вакууме при температуре 40 ºС в течение 24 ч. Далее полученное соединение помещают в фильтр объемом 100 мл с магнитной мешалкой, содержащим 10 мл воды, и добавляют карбонат калия по каплям до полного разложения, затем раствор экстрагируют с помощью морозильной камеры в течение 72 ч и температуре 40 ºС. Выход конечного продукта составил 75 %.
Загрузка лекарственного средства (аспирин) в гранулы из пектина и сложного эфира пектина. В фильтр объемом 100 мл с магнитной мешалкой добавляют 0,3 г продукта и 10 мл воды, перемешивают в течение получаса при температуре 30 ºС. После получения вязкого раствора добавляют 0,2 г аспирина и перемешивают в течение 2 ч. Гранулы, сформированные каплями с помощью шприца (рис. 1), в водном растворе 10 %-ного хлорида цинка в форме шариков геля, отделяли от водного раствора путем фильтрации, промывали дистиллированной водой и сушили при 40 ºС в течение 24 ч.
Изучение высвобождения лекарственного средства. В фильтр объемом 100 мл с магнитной мешалкой добавляют 10 гранул и 50 мл раствора N монокалийфосфата при перемешивании. Концентрацию аспирина определяют путем измерения спектров поглощения в ультрафиолетовом и видимом диапазонах при 234 нм в течение 100 мин (каждые 10 мин).
Результаты исследования и их обсуждение
На первом этапе был получен сложный эфир каприловой кислоты (С7Н15СООСН3) с использованием метансульфоновой кислоты в качестве кислотного катализатора, как показано на схеме 1.
Структура полученного сложного эфира была подтверждена с помощью ИК-спектроскопии. ИК-спектры жирных кислот характеризуются несколькими основными полосами поглощения, связанными с колебаниями различных связей в их молекулах. В спектрах каприловой кислоты (рис. 1, а) четко выражены следующие полосы. В области 3000–2800 см-1 наблюдается широкое и интенсивное поглощение, обусловленное валентными колебаниями связей С-Н в группах -СН2 и -СН3. Валентные колебания карбонильной группы (С=О) в СООН и сложноэфирных группах (-СООR). Деформационные колебания связи С-Н в группах (-СН2 и -СН3) проявляются при 1400 см-1. Колебания связи С-О в карбоксильных и сложноэфирных группах поглощают при 1200 см-1. В области 720–730 см-1 поглощение характерно для (-СН2). В ИК-спектрах сложных эфиров (рис. 1, б) по сравнению с каприловой кислотой наблюдается изменение величины поглощения как карбонильной, так и сложноэфирной групп. Валентные колебания карбонильной группы смещены в высокочастотную область и проявляются в виде характеристической полосы в диапазоне 1750–1725 см-1. Кроме того, исчезает широкая полоса поглощения в области 3300–2500 см-1. Четко проявляется полоса деформационных колебаний СН3 группы в области 1300–1000 см-1. Для метиловых эфиров характерны две полосы при 1245 и 1195 см-1.
На втором этапе был получен тетрабутиламмоний пектина (ТВА-пектин).
Гидроксид тетрабутиламмония добавляли в водный раствор пектина капельным способом и перемешивали при температуре 40 ºС, где рН колебался в пределах 8–9. Тетрабутиламмониевый пектин был выделен с помощью морозильной камеры, и структура полученного соединения была изучена с помощью методов спектроскопии. Масса осадка составляет 1,058 г, выход 90,65 %, степень замещения 66,91 %.
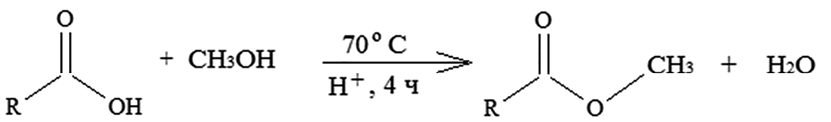
Схема 1
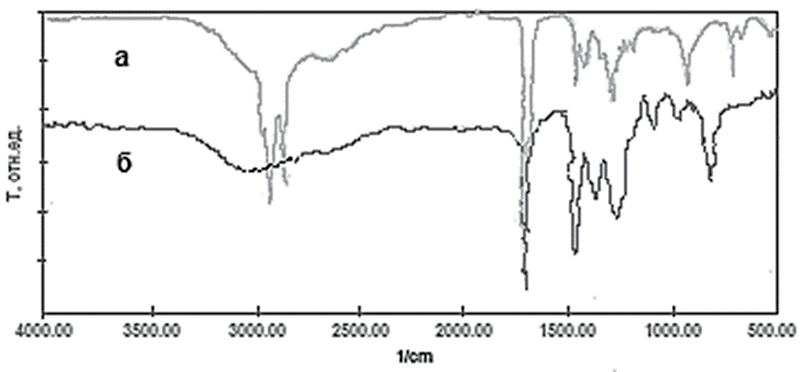
Рис. 1. ИК-спектры (а) каприловой кислоты и (б) метилового эфира каприловой кислоты Источник: составлено авторами
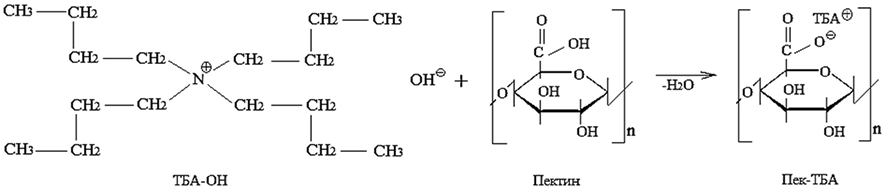
Схема 2
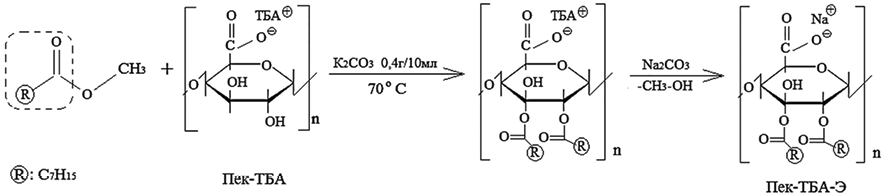
Схема 3
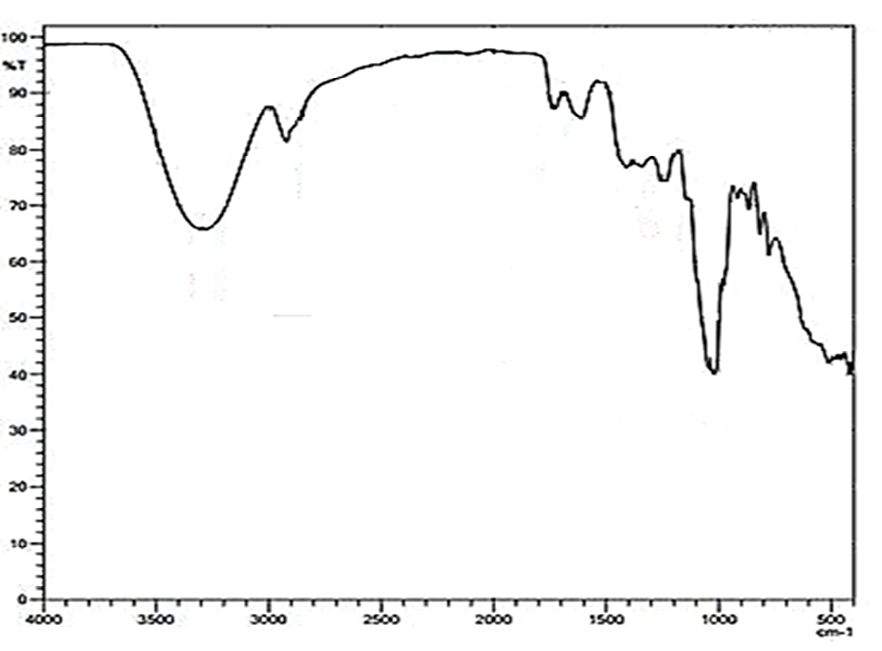
Рис. 2. ИК-спектры пектина Источник: получено авторами
После этого получен сложный эфир пектина (Э-ТБА-пектин) путем перекрестной реакции этерификации сложного эфира каприловой кислоты с тетрабутиламмониевым пектином с использованием карбоната калия К2СО3 в качестве катализатора при 70 ºС, время реакции 6 ч. В конце реакции выход из аммонийной формы в натриевую преобразуется с использованием карбоната натрия (схема 3). Выход конечного продукта – 75 %
В ИК-спектрах гидрофобизированных образцов пектина (рис. 2) имеет место широкое поглощение в области 3450–3300 см-1, относящееся к валентным колебаниям ОН-групп и водородным связям в структуре полимера. При 1750 см-1 и 1630 см-1 наблюдаются пики, вызванные симметричным и асимметричным колебаниями ионизированных карбоксильных групп. Проявляются полосы поглощения, характерные для метиловых эфиров в области низких частот 1250–1200 см-1. Деформационные колебания связи О-Н в гидроксильных группах поглощают при 1030 см-1. Флуктуация спиртовых групп вызывает слабое поглощение в области 950–900 см-1.
Данные 1Н ЯМР спектроскопии нативного и гидрофобизированного пектина почти не отличаются, поэтому в работе приведен протонный спектр последнего (рис. 3). В спектре пектина в области сильного поля (0,97–1,01 м.д. а также 1,46–1,74 м.д.) проявляются сигналы СН групп, находящихся в положении 4. Протоны, связанные с атомом углерода в положении 1 пиранозного цикла, резонируют при 3,34–3,38 м.д. Химические сдвиги при 3,43–3,59 м.д. относятся к протонам углерода в положении 2 и 3 галактопиранозилуронового фрагмента. Протон углерода, связанного с карбоксильной группой, резонирует в области слабого поля (5,22–5,24 м.д.) Для метоксильной и карбоксильной групп свойственно проявление сигнала при 3,67–3,91 м.д. соответственно.
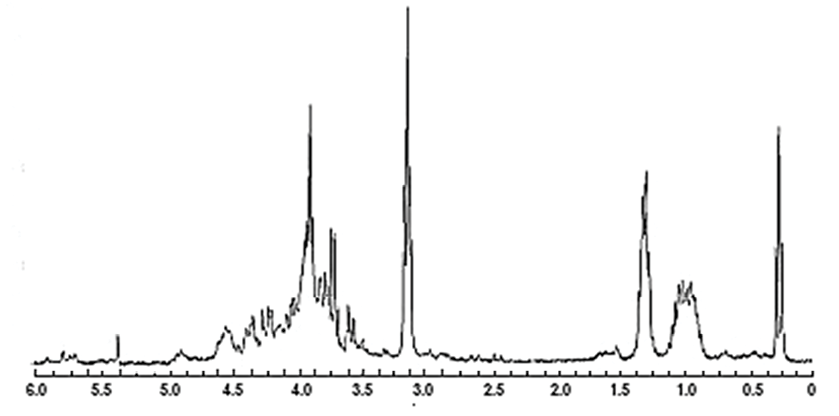
Рис. 3. 1Н ЯМР-спектры гидрофобизированного пектина Источник: составлено авторами
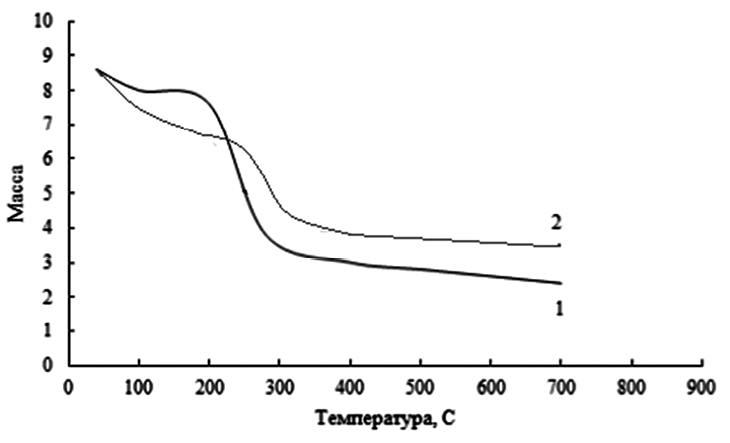
Рис. 4. Кривые термогравиметрического анализа (TGA) для пектина (1) и Э-ТБА-пектина (2) Источник: составлено авторами
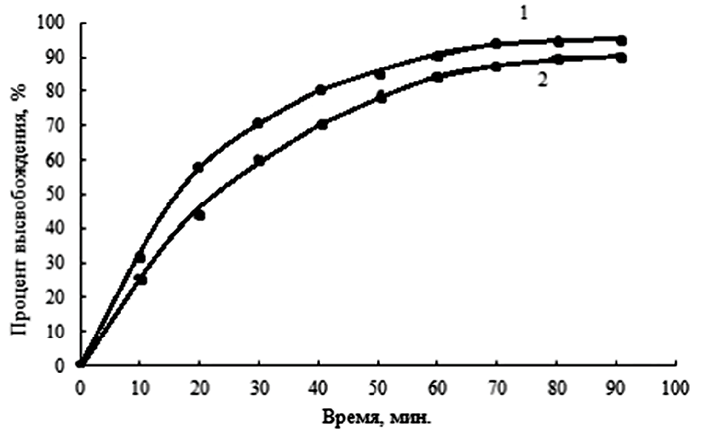
Рис. 5. Кривые продолжительности высвобождения аспирина из пектина (1) и пектинового эфира (2) Источник: составлено авторами
Кривые TGA для полученных соединений использовали для определения их термостабильности и сравнения с исходным материалом. На рис. 4 показана кривая количественного термического анализа нативного пектина и его гидрофобизированного производного.
На первой области кривой (1) наблюдается небольшой перегиб при температуре 70 ºС, где потеря массы образца составляет около 8 %, что следует отнести к потере влажности образца. Далее, при температуре 200 ºС происходит значительная потеря массы образца примерно на 50 %, что соответствует термическому распаду пектина. Температура выше 400 ºС отвечает обжигу соединения и его сгоранию. Как показано на кривой (2), влажность ТВА пектина устраняется дольше и при более высоких температурах. Распад полимера начинается также с 200 ºС и протекает в два этапа. Полный распад начинается с 300 ºС. Термогравиметрические данные показывают, что модифицированный пектин является более термостабильным.
На рис. 5 показана эффективность высвобождения аспирина как из пектина, так и из гидрофобизированного пектина в зависимости от времени. Как видно, лекарственное средство высвобождается из модифицированного пектина в течение более длительного времени и в меньшем объеме, чем из пектина, что может быть обусловлено гидрофобными фрагментами, препятствующими проникновению молекул воды между полимерными цепями.
Заключение
Молекулярная структура пектина модифицирована с использованием сочетанного метода, включающего взаимодействие с трибутиламмоний гидроксида и перекрестной этерификацией с метиловым эфиром каприловой кислоты. Соединения охарактеризованы спектральными методами. Установлено увеличение продолжительности и объема высвобождения лекарственного средства, связанного с модифицированным пектином, по сравнению с нативным пектином. Эксперименты показывают возможность использования представленного гидрофобизированного пектина в системах доставки лекарственных средств.
Конфликт интересов
Библиографическая ссылка
Серикова Л.В., Худайбергенова Э.М. СИНТЕЗ И СВОЙСТВА ПРОДУКТОВ СОЧЕТАННОЙ ГИДРОФОБИЗАЦИИ СТРУКТУРЫ ПЕКТИНА // Международный журнал прикладных и фундаментальных исследований. 2025. № 9. С. 42-48;URL: https://applied-research.ru/ru/article/view?id=13758 (дата обращения: 07.03.2026).
DOI: https://doi.org/10.17513/mjpfi.13758

