Введение
Коморбидность при сердечно-сосудистых заболеваниях – важнейшая проблема современной кардиологии. Наличие нескольких взаимоотягощающих патологий ухудшает течение и прогноз основного сердечно-сосудистого заболевания, меняет качество жизни [1]. Проблематика коморбидности накладывает существенное социальное и экономическое бремя на систему здравоохранения в целом. Известно, что сердечно-сосудистые заболевания являются наиболее распространенной причиной смертности от всех заболеваний во всем мире [2]. Второй по значимости причиной смертности выступают онкологические заболевания, и сочетание у пациентов данной нозологии с заболеваниями сердечно-сосудистой системы создает определенный коморбидный фенотип, имеющий ряд установленных трудностей для ведения в клинической практике. По данным Федерального проекта «Борьба с онкологическими заболеваниями», в Российской Федерации за 2023 год было выявлено на 7,6% больше онкологических случаев по сравнению с 2022 годом: 1168,9 случая на 100 тыс. населения, смертность от новообразований – на 1,8% [3].
Пациенты с сердечно-сосудистой патологией и онкологическими заболеваниями, несмотря на отнесение их к разных группам, имеют значимое количество общих факторов риска развития. Важнейшими факторами развития онкологических заболеваний являются курение, избыточный вес, ожирение, уровень физической активности, питание [4]. Увеличение распространенности хронических неинфекционных заболеваний и факторов их развития неуклонно ведет к росту как сердечно-сосудистой, так и онкопатологии.
Актуальным направлением в данной области является изучение кардиотоксичности, развивающейся на фоне лечения онкологических заболеваний. В статье рассматриваются современные аспекты механизмов кардиотоксичности при лечении онкологических заболеваний, и возможные способы ранней диагностики данного явления.
Цель научного обзора: провести анализ современных литературных источников, касающихся способов иммунологической диагностики кардиотоксических эффектов противоопухолевой терапии злокачественных новообразований у пациентов с сердечной недостаточностью с целью их раннего выявления и коррекции.
Материалы и методы исследования
Проведен несистематический обзор отечественных и зарубежных литературных источников по исследуемой теме, который производился с помощью сплошной выборки в базах данных PubMed, РИНЦ и eLibrary с использованием ключевых слов: «артериальная гипертония» (arterial hypertension), «ишемическая болезнь сердца» (coronary artery disease), «хроническая сердечная недостаточность» (chronic heart failure), «кардиотоксичность» (cardiotoxicity), «противоопухолевая терапия» (antitumor therapy). В выборку также вошли такие комбинации, как «хроническая сердечная недостаточность и противоопухолевая терапия»; «ишемическая болезнь, артериальная гипертония и кардиотоксические эффекты». Проводился анализ информации, представленной в литературных обзорах, оригинальных исследованиях, метаанализах. Поиск информации проводился в соответствии с протоколом Preferred Reporting Items for Systematic Reviewsand Meta-Analyses (PRISMA) [5]. Всего было проанализировано более 100 публикаций. Для написания обзора использовались 47 работ (3 – отечественные источники). Глубина поиска составила 14 лет.
Результаты исследования и их обсуждение
Кардиотоксичность. Определение, современное представление о проблеме
Кардиотоксичность – термин, включающий в себя перечень осложнений со стороны сердечно-сосудистой системы, возникающих на фоне лечения онкологических заболеваний [6]. Стоит отметить, что кардиотоксичные эффекты могут развиваться как во время лечения онкологического заболевания, так и после лечения. Согласно классификация T.M. Suter и M.S. Ewer, выделяют два типа кардиотоксического эффекта противоопухолевой терапии:
• необратимый – данный тип кардиотоксичности характерен при применении антрациклиновых антибиотиков и химиотерапии. Характеризуется нарушением сократительной функции миокарда вследствие гибели кардиомиоцитов;
• обратимый – при данном варианте кардиомиопатии характерно повреждение митохондрий и белков, отвечающих за сокращение миокарда. Такой вид кардиотоксичности характерен при применении терапии моноклональными антителами [7].
На сегодняшний день имеется существенное количество публикаций, указывающих на высокий риск негативного влияния противоопухолевой терапии на сократительную функцию левого желудочка, с последующими нарушениями ритма, удлинением интервала QT, ишемией миокарда, легочной гипертензией [8-10]. Основной обсуждаемой темой в разрезе данной проблемы является изучение развития и течения сердечной недостаточности на фоне лечения онкологической патологии.
Отдельно сегодня обсуждается бессимптомное течение кардиотоксичности на фоне лечения онкологических заболеваний, где отдельная роль уделяется использованию цитокинов [11].
Течение ишемической болезни сердца на фоне противоопухолевой терапии
По современным представлениям, одним из ключевых механизмов развития атеросклероза лежит хроническое неинфекционное воспаление, которое также тесно связано с развитием опухолевого процесса. Такие факторы, как курение, ожирение, артериальная гипертония, злоупотребление алкоголем, снижение физической активности, избыточный вес, являются потенциальными факторами развития атеросклероза [12]. По данным исследований, у пациентов с ИБС встречаемость избыточной массы тела составляет до 80%. В свою очередь избыточная масса тела ассоциирована с 13 видами онкологических заболеваний [13]. Патогенетическая взаимосвязь избыточной массы тела и онкологии связана с интенсивной выработкой гормонов жировой ткани и такими цитокинами, как интерлейкин-6, фактор некроза опухоли альфа, С-реактивный белок. По данным проспективных исследований, риск развития или ухудшение течения ИБС на фоне онкологических заболеваний увеличивается на фоне противоопухолевой терапии и продолжает возрастать даже в случае успешного излечения от онкологического заболевания [14; 15]. Кардиотоксические осложнения при лечении онкологического заболевания зависят от типа проводимой терапии. На фоне использования антрациклиновых антибиотиков происходит формирование комплексов с железом, кислотных радикалов и выработка топоизомеразы 2b в пролиферирующих клетках, что приводит к подавлению синтеза ДНК и апоптозу кардиомиоцитов.
На фоне формирования кислотных радикалов происходит прогрессирование атеросклероза [16]. Противоопухолевые препараты на основе платины способны вызывать прогрессирование эндотелиальной дисфункции и, соответственно, атеросклероза [17]. По данным исследований, риск развития ИБС повышен в 2,6 раза у пациентов, прошедших успешное излечение рака яичек цисплатином, по сравнению с пациентами без онкологической патологии. Также был отмечено увеличение случаев острого коронарного синдрома в 17% раз в течение 1-й недели от начала лечения [18].
Лечение моноклональными антителами также повышает риск развития и прогрессирования имеющегося атеросклероза [19]. Такими же негативными свойствами в отношении лечения онкологических заболеваний обладает гормональная терапия рака молочной железы, повышая риск развития ИБС на 25% по сравнению с пациентами без онкологических заболеваний [20].
Лучевая терапия, являясь широко используемым методом в лечении онкологических заболеваний, также оказывает ряд негативных воздействий на течение ИБС. Выделяют как макро-, так и микрососудистые нарушения. По данным исследований, эндотелий сосудов очень чувствителен к действию излучения [21; 22]. Как следствие этого, возникают тромботические осложнения, нарушение гемостаза, нарушение эластичности сосудистой стенки. По результатам длительных наблюдений в США у пациенток с раком молочной железы на фоне облучения и излечения заболевания, частота развития ИБС была больше на 18,7% по сравнению с пациентами без онкологического заболевания [23]. Макрососудистые нарушения на фоне лучевой терапии проявляются в образовании новых атеросклеротических бляшек. По данным морфологических исследований, содержат меньше липопротеидов низкой плотности и больше гиперплазированной интимы [24].
Нарушение структуры интимы приводит к изменению эластичности сосудистой стенки, повышению периферического сопротивления сосудов и, как следствие, росту артериального давления. Повышение артериального давления при лечении онкологической патологии также может быть обусловлено гормональной терапией.
Развитие хронической сердечной недостаточности на фоне противоопухолевой терапии
Патогенетические механизмы приводят к структурным и функциональным изменениям миокарда, повышению уровня натрийуретического пептида и последующему развитию сердечной недостаточности (рисунок).
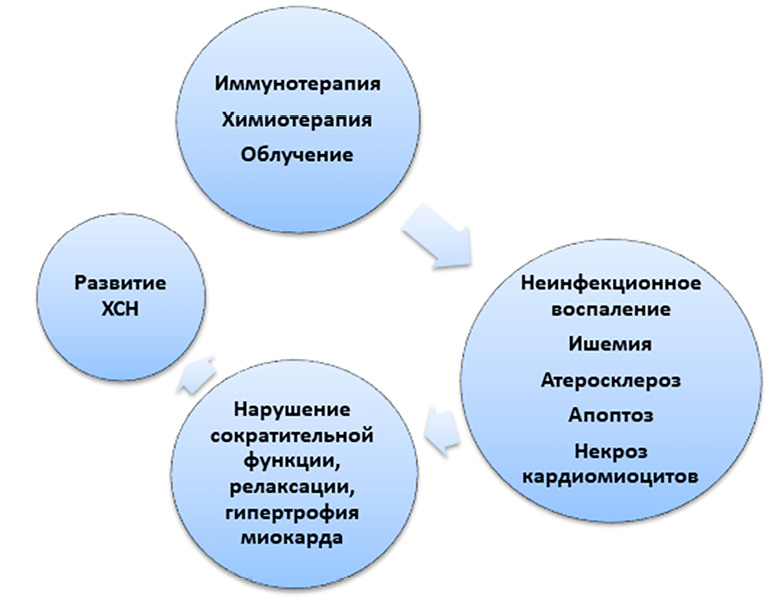
Основные механизмы развития хронической сердечной недостаточности при лечении онкологических заболеваний Составлено авторами по результатам данного исследования
Точные механизмы развития сердечной недостаточности на фоне противоопухолевой терапии до конца не изучены. Среди известных факторов выделяют активацию воспалительных цитокинов, окислительный стресс, повреждение митохондрий, выработку свободных радикалов, деструкцию ДНК и мембраны кардиомиоцитов [25; 26]. По данным экспериментальных исследований на фоне лечения доксорубицином, смертность от развития сердечной недостаточности увеличивается в два раза по сравнению с другими видами противоопухолевой терапии [27]. При остром повреждении миокарда – появление симптомов в течение первых 14 дней на фоне старта лечения антрациклиновыми антибиотиками и их последующей отмены, возможно полное восстановление миокарда. Хронические формы, возникающие в течение года и более, как правило, трансформируются в дилатационно-гипокинетическую кардиомиопатию [28].
Таким образом, раннее выявление симптомов, признаков и рисков возникновения сердечной недостаточности является важнейшей задачей при старте противоопухолевой терапии.
Вопросы ранней диагностики
В отношении ранней диагностики кардиотоксических эффектов противоопухолевой терапии у пациентов с ИБС в проспективных исследованиях продемонстрирована роль использования высокочувствительного тропонина Т, повышение концентрации которого ассоциировано с кадиотоксическими эффектами [29]. Однако в более поздних исследованиях было отмечено, что данный маркер может иметь повышенную концентрацию и до начала лечения онкологии, что снижает уровень его специфичности [30]. У пациентов с ИБС, проходящих противоопухолевое лечение онкологических заболеваний, было отмечено повышение концентрации С-реактивного белка, интерлейкинов. Вместе с тем изменение уровней данных цитокинов могло быть связано непосредственно с онкологическим процессом, что указывает на высокую чувствительность данных цитокинов, однако ставит под сомнение их специфичность [31].
Актуальным направлением в ранней и специфичной диагностике влияния кардиотоксических эффектов на миокард на фоне противоопухолевой терапии представляется использование микроРНК. В проведенных исследованиях отмечалась корреляция между паттернами miR-1, miR-2, miR-155, miR-214, которые выявлялись до образования новых атеросклеротических бляшек на фоне проводимой противоопухолевой терапии [32; 33].
Для пациентов с ХСН ценным диагностическим маркером является мозговой и N-концевой фрагмент натрийуретического пептида. Известно, что в диагностике сердечной недостаточности данные гормоны играют важнейшую роль, однако в использовании у пациентов с ХСН с онкологической патологией имеют ряд ограничений. Также данный маркер при наличии ожирения, клапанной патологии сердца, фибрилляции предсердий, почечной недостаточности может демонстрировать ложно сниженные уровни [34; 35]. Повышение уровня натрийуретических пептидов свыше 100 пг/мл в сочетании с одышкой в течение первых суток после начала лечения антрациклином может быть ассоциировано со значимым риском смертности от сердечно-сосудистой недостаточности [36]. Необходимость использования пептидов и тропонина Т в оценке риска дестабилизации течения сердечной недостаточности отражена в соответствующих источниках [37; 38]. По данным метаанализа 61 исследования с участием 5691 пациента с онкологическими заболеваниями и ХСН, было отмечено повышение уровня тропонина Т, а также выявлена корреляция с дисфункцией левого желудочка по сравнению с пациентами без онкологической патологии [39].
В то же время имеются данные о том, что повышение BNP и NT-proBNP может происходить до начала лечения онкологической патологии без сердечной недостаточности. Это объясняется тем, что злокачественные клетки способны вырабатывать такие вазоактивные вещества, как вазопрессин и эндотелин-1, а также сердечные гормоны – натрийуретический пептид [39-41]. Также интересно отметить исследования, указывающие на повышение онкологических маркеров при ХСН у пациентов без онкопатологии. В исследовании Shi K. и соавт. было отмечено повышение уровня CA 19-9 (рак поджелудочной железы), CA 125 и белка НЕ 4 (рак яичников) у пациентов с сердечной недостаточностью [42]. Открытым остается вопрос о повышения риска возникновения новообразований на фоне ХСН. Данный вопрос является очень актуальным для проведения дальнейших исследований [43].
Для оценки наличия и течения сердечной недостаточности при лечении онкологических заболеваний для оценки морфофункциональных изменений необходимо применять эхокардиографию с подсчетом глобальной продольной деформации левого желудочка. В зависимости от выявленных параметров выделяют 6 вариантов морфофункциональных изменений при кардиальной токсичности:
• отсутствие изменений на ЭхоКГ при наличии симптомов и повышении маркеров (тропонин Т, BNP/NT-proBNP);
• наличие диастолической дисфункции с нормальным уровнем биомаркеров (тропонин Т, BNP/NT-proBNP);
• наличие диастолической дисфункции, повышение уровня биомаркеров (тропонин Т, BNP/NT-proBNP), нормальная фракция выброса левого желудочка;
• ЭхоКГ – признаки ХСН с сохраненной фракцией выброса, наличие симптомов ХСН;
• бессимптомное снижение фракции выброса левого желудочка менее 50%;
• снижение фракции выброса левого желудочка менее 50% с наличием симптомов ХСН [44].
Дополнительные иммунологические маркеры
По данным исследований, определённо важную диагностическую ценность в диагностике ХСН при терапии рака имеет галектин-3 – бета-галактозид-связывающий белок, лектин, участвующий в целом ряде патогенетических процессов (воспаление, фиброз, пролиферация кардиомиоцитов, окислительный стресс, отложение коллагена) [45]. В исследованиях показана значимая диагностическая роль галектина-3 в ранней диагностике сердечной недостаточности на фоне лечения рака молочной железы [46]. Однако его прогностическое значение при данном виде ассоциации еще не изучено.
Фактор дифференцировки роста 15 – пептид из суперсемейства трансформирующего фактора роста. Повышение концентрации данного маркера отмечено у пациентов с раком молочной железы, проходивших лечение антрациклином и трастузумабом, по сравнению с пациентами без онкологической патологии. Также выявлены обратные корреляции данного маркера с уровнем фракции выброса левого желудочка [47]. Для оценки его прогностических свойств необходимо проведение проспективных исследований.
Заключение
Кардиоонкология – не только новое научное направление, сформированное необходимостью изучения и профилактики кардиоваскулярных рисков на фоне терапии онкологических заболеваний. Пациенты, имеющие данную коморбидную ассоциацию, требуют мультидисциплинарного подхода и изучения дополнительных методик оценки ранней диагностики потенциальных осложнений. Возможно, в перспективе это станет новой специальностью в практическом здравоохранении, а не только научным направлением.
Актуальной задачей в данной области является проведение проспективных исследований, касающихся исходов течения сердечно-сосудистых заболеваний, в частности хронической сердечной недостаточности, на фоне лечения онкологических заболеваний, а также методик раннего выявления кардиотоксических эффектов и их своевременной профилактики.
Конфликт интересов
Библиографическая ссылка
Анкудинов А.С., Галсанова Ж.Т. КАРДИОВАСКУЛЯРНАЯ ТОКСИЧНОСТЬ ПРИ ЛЕЧЕНИИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ: СОВРЕМЕННЫЕ АСПЕКТЫ ПАТОГЕНЕЗА. ИММУНОЛОГИЧЕСКАЯ ДИАГНОСТИКА // Международный журнал прикладных и фундаментальных исследований. 2025. № 12. С. 23-29;URL: https://applied-research.ru/ru/article/view?id=13776 (дата обращения: 22.01.2026).
DOI: https://doi.org/10.17513/mjpfi.13776

