Согласно классическому определению – функциональное состояние пациента представляет собой комплекс свойств определяющих его жизнеспособность [1, 2]. Как правило, в этот комплекс входят значения таких показателей, как давление, пульс, антропометрические данные, общее состояние.
Разными авторами [3, 4] предлагаются различные классификационные уровни функционального состояния. Распространяя аналогии предлагаемых уровней на организм пациента хирургического отделения, предлагается следующая систематизация – представлена в таблице.
В таблице переменная LET характеризует уровень напряженности и вычисляется по формуле
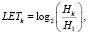 (1)
(1)
где Нk – уровень напряженности текущего k-го состояния пациентов, Н1 – уровень напряжения 1-го состояния.
Значения Hk вычисляются путем применения некоторого функционала от значений различных признаков, характеризующих состояние пациента и являющихся информативными факторами риска возможного развития патологического процесса в до и после операционный периоды.
Признаки, характеризующие состояние пациента, в большинстве случаев можно свести к логическим переменным, принимающим значение «true» – признак присутствует у пациента, «false» – признак отсутствует. Если от множества информативных признаков (вопросы формирования такового рассмотрены, например, в [5, 6]) перейти к кортежам, упорядочив признаки по любому критерию, – например, показателю информативности, то, перейдя к бинарному кодированию признаков, в качестве Нk предлагается принять величину
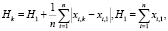
где xi,k – бинарное значение i-го признака в текущем состоянии k, xi,1 – бинарное значение i-го признака в состоянии 1.
Проведение вычислительных процедур и формирование превентивных диагностических заключений предлагается осуществлять на различных этапах обследования пациента (до и после операции) с целью выявления его адаптационных возможностей и резервов организма по преодолению последствий операционного вмешательства.
Для повышения оперативности и качества оценки уровней напряженности функционального состояния пациента предлагается применять автоматизированную систему поддержки принятия решений (АСППР), которая не только оценивает степень напряжения, но и формируют рекомендательные заключения по прогнозу развития ситуации и возможных терапевтических (или иных корректирующих состояние пациента) воздействий.
Проектирование АСППР (как в целом, так и и отдельных ее элементов) основывается на определенной модели автоматизированной информационно-аналитической поддержки функционального состояния пациента на ключевых этапах лечения (включая операционное вмешательство) – например, представленная на рисунке.
Согласно рисунку модель отражает следующую технологию прогнозирования и профилактики. По результатам анализа анамнеза больного, до и после операционного вмешательства системой поддержки принятия решений осуществляется вычисление рисков различных прогнозов тромбоэмболии и исходов лечения в целом. По определенным решающим правилам осуществляется диагностика патологических форм и исхода лечения или профилактики. Этот процесс осуществляется под управлением лечащего врача на основе рекомендаций, сформированных системой поддержки. После выбранной, согласно рекомендациям, терапии осуществляется контроль состояния пациента и определение рисков. Данный процесс повторяется до достижения желаемого эффекта (выздоровления или купирования состояния) или летального исхода.
Поскольку процессы терапевтического воздействия (профилактики и-или лечения) включают в себя применение автоматизированной системы поддержки принятия решения при определении рисков и классификации состояний и исходов, то появляется возможность для конкретного больного фиксировать (и далее – анализировать) градиент изменений и скорость изменения состояний в численной форме и тем самым оценивать эффективность профилактики и-или лечения в количественных формах, отражая качество терапевтического процесса.
Уровни напряженности функциональных систем организма
|
№ п/п |
Значение LET (верхняя граница) |
Степень напряжения регуляторных систем организма |
Состояние организма |
|
1 |
0,38 |
Оптимальный уровень (норма) |
Хорошее |
|
2 |
0,73 |
Умеренное напряжение |
Удовлетворительное |
|
3 |
1,35 |
Выраженное напряжение |
Тяжелое |
|
4 |
1,72 |
Резко выраженное напряжение |
Крайне тяжелое (предагональное) |
|
5 |
2,35 |
Перенапряжение |
Крайне тяжелое (предагональное) |
|
6 |
3 |
Резко выраженное перенапряжение |
Терминальное (агональное) |
|
7 |
3,72 |
Истощение регуляторных систем |
Терминальное (агональное) |
|
8 |
4,35 |
Резко выраженное истощение регуляторных систем |
Предсостояние клинической смерти |
|
9 |
>6 |
Возможен летальный исход |
Клинической смерти |
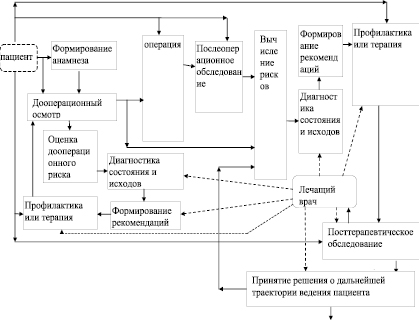
Укрупненная информационно-аналитическая модель
К значениям показателей качества функционирования предлагаемой СППР ПТ предъявляются следующие требования:
– клиническая приемлемость и непротиворечивость;
– нижние пороговые значения показателей качества не должны быть меньше, чем у ранее разработанных и применяемых (с решающими правилами для сходных форм тромбоэмболии и-или на ином математическом аппарате). Таковыми в данном случае являются [7, 8] диагностическая чувствительность (ДЧ), диагностическая специфичность (ДС), диагностическая эффективность (ДЭ) с пороговыми значениями 0,8.
Обеспечение адекватности синтезированных решающих правил обусловливается двумя основными факторами:
– научно обоснованным сформированным множеством информативных признаков, обладающих требуемыми классификационными характеристиками и системно представляющих состояние организма;
– научно обоснованными и логически непротиворечивыми методами и алгоритмами структурно-параметрической идентификации (синтеза) решающих правил.
Вопросам формирования множества информативных признаков и упорядочивания его элементов по выбранным показателям посвящено множество исследований, рассмотренных в [6, 7].
Большинство из них предполагает:
– обязательное соблюдение принципов доказательной медицины (исключение составляют экспертные методы);
– использование одного из методов с учетом специфики структуры данных;
– обработку одномодальных признаков;
– обработку количественных признаков, представленных в непрерывной шкале значений.
В связи с этим предлагается осуществлять оценку информативности признаков различными методами, учитывающими их гетерогенность и модальность, а затем, упорядочив множество признаков по мере убывания показателя информативности для каждого из методов (частные кортежи признаков), получить искомое множество информативных признаков путем пересечения частных кортежей (или организации взвешенно-мажоритарного голосования между ними) и задания критерия, определяющего максимальный объем множества.
В качестве подобных методов предлагается использовать:
– Метод корреляционных предпочтений.
В каждом классе ωl вычисляются матрицы парной корреляции между признаками, которым ставятся в соответствие матрицы смежности Sl:
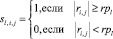 ,
,
где ri,j – коэффициент парной корреляции между признаками i и j, rpl – пороговые значения для коэффициентов парной корреляции в классах ωl.
Далее вычисляются значения матрицы Msp:
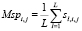 ,
,
которые используются для определения значений вектора Vsp:
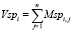
(n – количество исходных признаков). В качестве меры информативности признака i принимается величина
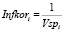 .
.
– Метод дискриминантных предпочтений.
Допустим, значения признаков принимают значения «true» («1») либо «false» (0) либо используется бинарное кодирование в алфавите {0,1}. В этом случае предлагается применять аналог полинома Габора в виде логического многочлена:
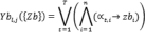 ,
,
где n – количество показателей, представленных в булевой форме; T – количество дизъюнкций; αt,i – логическая константа, позволяющая учитывать или не учитывать логическую переменную i в конъюнкции t (αt,i = true – показатель i учитывается, αt,i= false – показатель i не учитывается), zbi – признак i из {Zb}.
Приведенная формула идентифицируется с помощью аппарата логических нейронных сетей или любыми алгоритмами минимизации булевых функций. Затем, для каждого класса ωl определяем множество отличий {εb}l логических аппроксимантов от клинически подтвержденных ситуаций, по которым для каждого класса ωl признаки xi упорядочиваются и формируются l множеств характеристик для классов и соответствующие им множества рангов 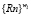
Итоговая информативность определяется как
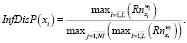
В качестве элементов множества решающих правил предлагается использовать продукционные конструкции, позволяющие по выполнению (невыполнению) определенных условий осуществлять соотнесение состояния пациентов к определенным классам, – уровням напряженности функционального состояния или определенным патологическим состояниям.
Для случая, когда значения прямых или латентных признаков принадлежат нечетким множествам с базовыми переменными на непрерывной шкале разработаны методы нечеткого логического вывода [9].
Для решения подобных задач в случае представления признаков в форме логических переменных предлагается использовать либо ДСМ-метод [10], либо логический нечеткий вывод на основе лингвистических переменных, как наиболее приближенный к синдромальному подходу в медицине.
Использование ДСМ-метода в случае большого количества признаков (более 20) недостаточно продуктивно, поскольку возникают проблемы с вычислительными ресурсами организации полного перебора сочетаний всех признаков (более 220 и последующим степенным ростом) и выполнением необходимых условий выполнимости посылок правил ДСМ-индукции [11] в случае, если количество пациентов в обучающей выборке соизмеримо (одного порядка или меньше) с количеством анализируемых признаков. Подобные проблемы возникают и при выборе оптимальной конструкции лингвистической переменной.
В связи с этим синтез условий активации продукций с учетом указанной специфики «входной» информации предлагается осуществлять с помощью искусственных логических нейронных сетей [12], организованных на основе базовых парадигм метода группового учета аргументов – МГУА [13].
Таким образом, предлагаемая модель автоматизированной информационно-аналитической поддержки функционального состояния больного в до- и послеоперационный периоды позволяет на различных этапах технологии ведения больного в хирургическом отделении анализировать его функциональное состояние с помощью современных компьютерных технологий применения СППР и оперативно вмешиваться в процесс течения болезни и ее терапии. Отслеживание информационных потоков между отдельными частями модели позволяет формализовать и объективизировать терапевтический процесс, способствуя повышению эффективности операционного воздействия и качества лечения.
Предлагаемая модель апробировалась в хирургическом отделении Курской областной больницы для прогноза развития тромбоэмболии при эндопротезировании крупных суставов (показатели качества – диагностические чувствительности специфичности и эффективности превышали уровень 0,87).

