Тканеинженерные конструкции (скаффолды) являются важной составляющей регенеративных технологий [1]. Недавнее стремительное развитие таких перспективных методов тканевой инженерии как биопринтинг, лазерно-опосредованные технологии, наряду со ставшими привычными для исследовательской практики импринтлитографией и электроспиннингом, в значительной мере актуализируют исследования по широкому фронту направлений [2, 3, 4]. К таким направлениям относят создание биомиметических материалов, изучение топографии поверхности скаффолда в проекции наноструктурирования, анализ пространственного взаимодействия материалов скаффолда с заселяемыми культурами клеток, развитие методов неинвазивного контроля, изучение трехмерных клеточных культур с позиций механотрансдукции, разработку методов математического моделирования, а также оценку перфузионых свойств скаффолда [5, 6, 7].
В настоящее время среди микроскопических методов анализа состояния скаффолдов наиболее широко используются сканирующая и трансмиссионная электронные микроскопии [8, 9]. Кроме того, для оценки создаваемых тканеинженерных конструкций применяются атомно-силовая микроскопия и лазерная сканирующая конфокальная, последняя в значительной мере нацелена на изучение флуоресцентных клеточных меток и трассеров, в то же время возможности лазерной сканирующей конфокальной микроскопии позволяют оценивать структурные элементы скаффолда на этапе его производства, а также на этапах биотехнологии ведения 3Д клеточной культуры [10, 11].
Цель работы: показать возможности методов конфокальной микроскопии для оценки тканеинженерной конструкции (скаффолда) на этапах его получения и при ведении в условиях 3D клеточной культуры.
Материалы и методы иследования
Приготовление скаффолда. Для получения композита использовали следующие материалы: поликапролактон (PCL) (80 кДа, Sigma-Aldrich), хитозан (Сhitosan Low molecular weight, Sigma-Aldrich), растворители 1,1,1,3,3,3-гексафторпропанол (HFP, Sigma-Aldrich). Композит готовили следующим образом: готовили 12 % PCL W/V, в качестве растворителя PCL использовался хлороформ, хитозан (Chit) растворялся из расчета 50 мг на 1 мл HFP, получали 5 % W/V раствор Chit, полное растворение не менее 3 суток. Для получения 0,5 % W/V композита хитозана смешивали 1 мл 5 % Chit W/V и 9 мл 12 % PCL W/V. Затем в композит 0,5 % W/V композит хитозана и поликапролактона добавляли нанопорошок трикальций фосфата (Sigma-Aldrich) с размером частиц 200 nm из расчета 30 мг на 10 мл композита и бета-глицерофосфат динатриевой соли (Sigma-Aldrich) 30 мг на 10 мл композита. Перед проведением электроспиннинга растворы перемешивали с помощью магнитной мешалки в течение 15–17 часов.
Формирование полотна скаффолда выполняли на установке электроспиннинга NF-103 (MECCO), на базе «Инновационный медико-технологический центр» (ЗАО «ИМТЦ). При получении полотна постоянными параметрами были: высота 22 см, ускоряющее напряжение – 21 кВ, диаметр коллектора (мандрилы) 8 мм, скорость подачи раствора полимера – 0,5 мл в час. При проведении электроспиннинга использовали одноразовые шприцы «BBraun» объемом 5 мл и иглы «Sterican» – 25G. Полученный скаффолд стерилизовали «холодным» этиленоксидным методом.
Получение мезенхимальных стволовых клеток и заселение скаффолда. Получали аспират костного мозга из головки бедренной кости, полученной при операции протезирования тазобедренного сустава, выделяли мононуклеарную фракцию костного мозга, с использованием среды, содержащей фиколл, с плотностью 1,077 г/см3 (Lymphocyte Separation Medium, Lonza). Центрифугировали 40 мин при 400g при комнатной температуре. Отбирали верхнюю фракцию, промывали в фосфатно-солевом буфере, рассаживали в культуральные флаконы из расчета 1 млн клеток/1 см2 со средой DMEM с GlutaMax и пониженным содержанием глюкозы 1 г/л (Gibco), дополненной 10 % эмбриональной бычьей сывороткой (Gibco) и антибиотиками пенициллин 100 ед./мл и стрептомицин 100 мкг/мл. Культуральные флаконы с клетками помещали в СО2 инкубатор с 95 % влажностью и 5 % содержанием СО2. На 4 сутки среду с неприлипшими клетками сливали, добавляли свежую среду DMEM, как описано выше, с FGF-β 5 нг/мл. Через неделю меняли среду на свежую без FGF-β, еще через неделю клетки криоконсервировали и использовали для заселения скаффолда. Для криоконсервации использовалась среда следующего состава – DMSO (Sigma-Aldrich) – 10 %, эмбриональной бычьей сыворотки (Gibco) – 40 % и 50 % DMEM с GlutaMax и пониженным содержанием глюкозы 1 г/л (Gibco).
Перед заселением клетками скаффолд фиксировали на дне культурального шестилуночного планшета (9,6 см2) – площадь поверхности дна лунки (Nunc), добавляли среду DMEM с 10 % эмбриональной бычьей сывороткой (Gibco), переносили по 200 тыс. клеток из расчета на 1 лунку с фиксированным скаффолдом на дне, инкубировали в СО2 инкубаторе с 95 % влажностью и 5 % содержанием СО2. В качестве контроля в две лунки 6-луночного планшета вносили по 200 тысяч клеток (без скаффолда). Полное время инкубации 48 часов, часть образцов исследовалась на цитотоксичность, оставшиеся фиксировали в 10 % нейтральном формалине, для цитологического анализа.
Тест на цитотоксичность (МТТ). Через 48 часов после начала культивирования скаффолдов проводили МТТ-тест в 4 образцах со скаффолдом и клетками и в образцах, содержащих только клетки. В каждую исследуемую лунку добавляли свежеприготовленный желтый раствор бромида 3-(4,5-диметилтиазол-2-ил)-2,5-тетразолия 5 мг/мл (МТТ, Sigma-Aldrich) до конечной концентрации 0,5 мг/мл и культивировали в течение 3 ч в СО2-инкубаторе. После инкубации среду отбирали в отдельные пробирки, центрифугировали при 400 g в течение 5 мин. Супернатант удаляли, выпавшие синие кристаллы формазана растворяли в 1 мл диметилсульфоксида (ДМСО), переносили в соответствующие лунки, мягко пипетируя. Затем отбирали по 3 аликвоты (200 мкл) каждого образца и переносили в 96-луночный планшет. В качестве калибровочного контроля использовали 3 лунки, содержащие только 200 мкл ДМСО. Оптическую плотность определяли на приборе «Multisсan RC» на длине волны 570 нм, вычитая фон при 620 нм. Результаты МТТ-теста обрабатывали с помощью программы «Microsoft Excel». Расчет цитотоксического индекса (ЦИ) проводили по стандартной формуле: ЦИ ( %) = [1–(ОПэ-ОПк)/ОПк], где ОПэ – значение оптической плотности в экспериментальной точке
Окрашивание образцов скаффолда. Для анализа цитоскелета использовали метод с фаллоидином, меченным FITC (Phalloidin Fluorescein Isothiocyanate Labeled, Sigma-Aldrich). Готовили рабочее разведение 5мг на 1 мл меченного FITC фаллоидина. ДМСО, которое использовали для окрашивания фиксированных образцов скаффолда, заселенного клетками, в финальной концентрации при разведении в фосфатно-солевом буфере – 1:40. Продолжительность окрашивания 1 час, затем образцы отмывали в 4 последовательных сменах дистиллированной воды по 10 минут, высушивали и монтировали на предметные стекла.
Для окрашивания ядер использовали флюоресцирующий краситель – DAPI в рабочем разведении – 1 мг на 1 мл деионизированной воды с финальной концентрацией 1:1000 при разведении в фосфатно-солевом буфере, время окрашивания 10 минут, время промывки в дистиллированной воде 10 минут, 2-кратно.
Изучение полотна электроспиннинга методом конфокальной микроскопии. Исследование образцов полотна электроспиннинга методом лазерной конфокальной микроскопии осуществляли с помощью лазерного конфокального микроскопа «Zeiss LMS 710» («Карл Цейсс МикроИмэйджинг ГмбХ», Германия) с принадлежностями: объективы Apochromat х20 сухой и 40x с масляной иммерсией. Выполнялся спектральный анализ аутофлуоресценции волокон полотна электроспиннинга с использованием 32-канального детектора LSM 710. Оптимальным для возбуждения был выбран полупроводниковый лазер с длиной волны 405 нм, так как эмиссия аутофлуоресценции возбужденного им полотна была максимальна. Максимальная аутофлуоресценция крайне важна, так как её точное определение дает впоследствии точную локализацию эмиссионного сигнала каждого волокна внутри конфокального объема, во время проведения последующих экспериментов.
Экспериментально снимали одновременно два канала. Первый канал – это аутофлуоресценция волокон полотна элетроспиннинга. Второй канал – детектор проходящего света, который необходим для определения точной локализации эмиссионного сигнала каждого волокна внутри конфокального объема полотна. Для анализа использовали изображения заполнения объема полотна эмиссионным сигналом аутофлуоресценции волокон, что важно для точной оценки «плотности упаковки» – количества волокон в конфокальном объеме сканирования полотна электроспиннинга.
Далее следовало получение Z-stack образца полотна электроспиннинга с последующим 3D моделированием, 3D модель обрабатывалась программным методом Maximum intensity projection программы Zen Black. Для последующего анализа количества волокон в конфокальном объеме использовали программный модуль Image analysis Zen Blue. Готовилась программа автоматических измерений изучаемых элементов изображения с использованием приемов сегментации изображения.
Выполнялся анализ углов смачивания в подготовленных образцах скаффолда в 30-секундном тесте с каплей воды.
Для анализа характера распределения и плотности клеток на скаффолде, применяли окрашивание DAPI с использованием метода последовательного сканирования исследуемого образца (Multitrack), затем применялся программный метод обработки изображений – Maximum intensity projection программы Zeiss Zen Black. Для выявления цитоскелета с меткой (phalloidin – FITC), включали аргоновый лазер, готовили трек для FITC на длине волны – 488 нм.
Для анализа характера распределения и плотности клеток на скаффолде было применено окрашивание клеток DAPI, FITC с использованием метода последовательного сканирования исследуемого образца (Multitrack). Метод последовательного сканирования образца позволяет разделить каждый краситель исследуемого образца в отдельный трек, чтобы эмиссия красителей исследуемого образца не пересекалась. Таким образом, мы имеем достоверную картину распределения клеток, где каждый элемент клетки отображен без внесения спектральных искажений. Для выявления цитоскелета с меткой (phalloidin – FITC) включали аргоновый лазер (использовалась длина волны 488 нм), настраивали детектор LSM 710 на второй трек эксперимента для отображения красителя FITC. Для понимания особенностей адгезии клеток на скаффолде использовали третий трек, который был настроен на исследования материала скаффолда и являлся отражением лазерного луча от материала поверхности исследуемого образца. Третий трек дает понимание того, что исследуемые клетки прикрепились к поверхности образца. Для определения плотности заселения скаффолда культурой мезенхимальных клеток использовали модуль ручных измерений программы Zeiss Zen Black, анализировали по 10 изображений каждого скаффолда,
Методы статистической обработки материала. Обработку полученных результатов исследования проводили с использованием вычисления описательных статистик и путем сравнения количественных параметров с использованием программного обеспечения «ORIGIN PRO 2015». Описательные статистики представлены в виде средней (М) и её стандартной ошибки (m). Статистическую значимость различий между сравниваемыми средними величинами исследуемых параметров оценивали с помощью параметрического двунаправленного t-критерия. Уровень пороговой статистической значимости (P) при этом принимали равным 0,05. Различия сравниваемых величин считали достоверными при значениях, не превышающих порогового уровня, определенного в 0,05 (P<0,05).
Результаты исследования и их обсуждение
На рис. 1 представлено изображение полотна скаффолда, полученного при использовании метода (Multitrack), на основе аутофлуоресценции волокон скаффолда и детектора проходящего света и последующим подключением метода программной обработки изображений – maximum intensity projection программы Zeiss Zen Black. Средние значения диаметров волокон скаффолда составили 0,850±0,48 мкм. Плотность упаковки волокон в объеме – 9,34±0,25 %. Угол смачивания полотна скаффолда по 30-секундному тесту с каплей воды – 54°. Модуль Image analysis Zeiss Zen Blue позволяет точно сегментировать каждое волокно, что дает точное количество волокон внутри упаковки полотна электроспиннинга, с последующим контролем получения нужных размеров волокна.
Плотность заселения скаффолда культурой мезенхимальных клеток была в пределах 220±16 клеток на мм2. Колориметрический МТТ – тест не выявил достоверной разницы по уровню растворенного формазана между клеточным материалом в контроле и при заселении скаффолда –1,0±0,03 и 1,14±0,02, соответственно. На рис. 2 представлено полотно скаффолда, заселенного мезенхимальными клетками. Результаты MTT теста показывают, что микросреда адгезированной на скаффолде культуры клеток мало влияла на митохондриальное дыхание клеток относительно клеток, адгезированных на пластике.

Рис. 1. Представлено полотно скаффолда – 0,5 % хитозана. Объектив х20, сухой. Двухканальное изображение. Верхнее изображение слева – это аутофлуоресценция волокон скаффолда. Верхнее изображение справа – детектор проходящего света, который необходим для определения точной локализации эмиссионного сигнала каждого волокна внутри конфокального объема полотна. Внизу слева – объединенные в одно изображение первый и второй каналы
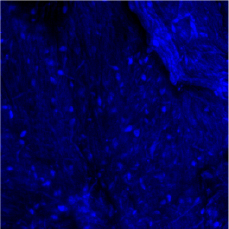
Рис. 2. Представлено полотно скаффолда – 0,5 % хитозана, заселенного мезенхимальными стволовыми клетками. Объектив х20, сухой. Окрашивание DAPI. Двухканальное изображение. Аутофлуоресценция волокон скаффолда, ядра клеток интенсивно голубые
Особенности распределения в цитоскелете F-актина адгезированной на скаффолде клеточной культуры представлены на рис. 3. Практически во всех клетках определяли диффузное распределение FITC-позитивной метки, а само распределение F-актина подчас может требовать ограничения области анализируемой поверхности для корректного считывания показаний.
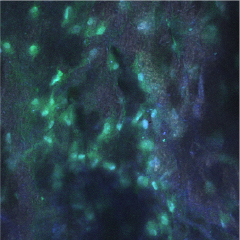
Рис. 3. Представлено полотно скаффолда – 0,5 % хитозана, заселенного мезенхимальными стволовыми клетками. Объектив х40, масляная иммерсия. Выделен фрагмент изображения с использованием цифрового увеличения (ROI) x1,4. Трехканальное изображение – аутофлюоресценция волокон, ядра окрашены DAPI, элементы цитоскелета – phalloidin-меченым FITC
Вывод
Методы конфокальной микроскопии позволяют контролировать получение полотна скаффолда в нанометровом диапазоне, изучать и анализировать плотность заселения клеток, детализировать их морфологические особенности на этапах культивирования при использовании флуоресцентных техник.

