В настоящее время наиболее перспективным направлением для переноса генетического материала представляется использование липосом, которые в настоящее время модифицируют с целью защиты и увеличения продолжительности их жизни in vivo и направленного действия на конкретные клетки-мишени. В свою очередь, аполипопротеины могут выступать эффективными переносчиками генетического материала, а именно белковый компонент ЛПВП – аполипопротеин А-I (апоА). Предпосылкой к этому является тот факт, что аполипопротеины переносят гормоны стероидной природы, которые по своей циклической структуре сходны с циклическими основаниями молекулы ДНК. Единичные работы, касающиеся данной проблемы, показывают участие апоА в составе полисом в переносе олигонуклеотидов через гемато-энцефалический барьер [1]. Показана способность рекомбинантных ЛПВП транспортировать малые интерферирующие РНК против вируса гепатита С в гепатоциты через SR-B1-рецепторный путь [2, 3]. Липидный компонент аполипопротеинов может обеспечивать формирование контейнерной структуры, аналогично липосомам, которая должна защищать экзогенную миРНК от разрушения в моделях in vivo. В литературе было показано методом малого углового рассеивания взаимодействие апоА с короткими олигонуклеотидами, в состав которых входят (GCC)n повторы (n = 3–5) [4]. Ранее в нашем институте было показано присутствие в ядрах клеток многих тканей апоА [5]. Рецепторы к апоА находятся во многих тканях организма (к настоящему моменту рецепторы обнаружены в 8 видах тканей), что очень важно для рецептор-опосредованного захвата клетками комплексов апоА-миРНК. Все это позволяет сформулировать гипотезу о том, что аполипопротеин А-I может быть использован в качестве транспортного средства для доставки миРНК в клетки млекопитающих. Для того чтобы зафиксировать действие миРНК в клетках и тем самым доказать проникновение комплекса апоА-миРНК в клетку, миРНК должны действовать на информационную РНК какого-либо легко детектируемого белка. В качестве такого белка широкое распространение получили флуоресцирующие белки, в частности зеленый флуоресцирующий белок и его различные модификации. Белок GFP легко регистрируется флуориметром в клеточной суспензии, клетки можно наблюдать непосредственно на флуоресцентном микроскопе, а флуоресценция может быть количественно измерена. Такой подход к изучению РНК-интерференции в настоящее время является наиболее популярным. В связи с этим целью нашей работы являлось исследование способности апоА-I переносить миРНК в опухолевые клетки млекопитающих.
Материалы и методы исследования
Выделение и очистку нативного апоА из плазмы крови человека проводили по методике, описанной в работе [6]. Рекомбинантный апоА получали из клеток продуцента сконструированного ранее в нашей лаборатории. Клетки E. coli разрушали ультразвуком, белок из клеточного лизата выделяли с помощью аффинной хроматографии на сорбенте «Ni-NTA Superflow» («Qiagen», США), с последующим отщеплением лидерной последовательности, как описано в работе [7].
Конъюгаты белков с флуоресцирующей меткой получали путем инкубации белков с флуоресцеин изотиоцианатом (ФИТЦ) способом, описанным в работе [8].
Измерение концентрации белков проводили спектрофотометрически в ЦКП «Спектрометрические измерения» на базе НИИ биохимии, г. Новосибирск. Измерение концентрации белков при λ = 280 нм проводили на спектрофотометре Evolution 300 («Thermo Scientific», США). Флуорометрические измерения конъюгата апоА-ФИТЦ и суспензии клеток линии 8А3 выполняли на спектрофлуорофотометре RF-5301PC («Shimadzu», Япония).
Культивирование клеток опухолевых линий. В качестве клеточной модели использовали трансформированные мышиные макрофаги линии RAW264.7 и её производный моноклон 8А3, стабильно экспрессирующий ген gfp. Клеточная линия RAW264.7 и её производный моноклон 8А3 были приобретены в фирме «Евроген» (Россия). Выращивание клеток проводили в среде RPMI-1640 с глутамином («Биолот», Россия), рН 7,4, содержащей 10 % эмбриональную сыворотку коров, 50 ед/мл пенициллина, 50 мкг/мл стрептомицина. Инкубацию проводили в СО2-инкубаторе («Cole-Parmer», США) в атмосфере, содержащей 5 % СО2 и 95 % воздуха, при температуре 37 °С, используя 24-луночные планшеты («Orange Scientific», США). Клетки снимали с планшетов 0,25 % раствором трипсина. Жизнеспособность клеток оценивали методом исключения трипанового синего, концентрацию клеток рассчитывали в камере Горяева. Музейные образцы клеток хранили в жидком азоте в среде RPMI-1640 с добавлением 40 % эмбриональной сыворотки коров и 10 % диметилсульфоксида.
Инкубацию клеток с комплексом апоА-ФИТЦ проводили в течение 6 часов, концентрация комплекса составляла 3, 9 и 27 мкг/мл. Для визуального анализа флюоресценции клеток использовали инвертированный флуоресцентный микроскоп Axiovert 40 CFL («Zeiss», Германия). Инкубацию клеток с комплексами апоА-миРНК проводили в течение 6 часов, после чего меняли среду на свежую и инкубировали клетки еще двое суток. По окончании инкубации клетки отмывали от среды, снимали с планшетов и анализировали. Каждый образец повторяли не менее трех раз.
Получение дуплекса миРНК. В работе использовали комплементарную пару олигорибонуклеотидов (по 22 нуклеотида каждый), содержащие на 3’-концах по два дезокситимидиновых остатка:
5’–CAAGCUGGAGAUCAAGUUCТТ–3’
3’-ТТGUUCGACCUCUAGUUCAAG-5’.
Данные нуклеотиды были синтезированы de novo на заказ (ЗАО «Биосан», г. Новосибирск), из них образовывали дуплекс путем эквивалентного смешения каждого олигорибонуклеотида с концентрацией 40 пмоль/мкл. В раствор дополнительно добавляли диэтилпирокарбонат до конечной концентрации 1 мкМ. Смесь инкубировали при 45–50 °С в течение 20 минут, охлаждали в ледяной бане, разливали в пробирки на мелкие порции и хранили при –70 °. При работе с олигорибонуклеотидами использовали автоклавированную воду, предварительно очищенную с помощью системы «Merck Millipore», а также наконечники для дозаторов и пробирки с маркировкой об отсутствии РНКаз («Axygen», США).
Статистическая обработка результатов производилась с помощью программы «StatPlus 2009 Professional». Статистическую значимость результатов оценивали с помощью t-критерия Стьюдента при уровне значимости p < 0,05.
Результаты исследования и их обсуждение
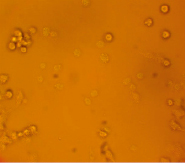
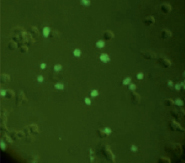
За основу модели клеток млекопитающих была выбрана мышиная клеточная макрофагальная линия RAW264.7. Поскольку известно, что макрофаги обладают рецепторами к апоА, мы предположили, что клетки линии RAW264.7 будут способны к рецептор-опосредованному поглощению комплексов апоА-миРНК. Для этого на первом этапе работы был получен конъюгат апоА с флуоресцирующим красителем ФИТЦ, а также изучено проникновение ФИТЦ-меченного белка в клетки линии RAW264.7. Для получения конъюгата использовался как рекомбинантный, так и нативный апоА. Клетки инкубировались с конъюгатом в течение ~6 часов, после чего клетки отмывались дважды раствором ФСБ и анализировались на инвертированном флуоресцентном микроскопе. Светящиеся клетки интерпретировались как клетки, поглотившие белок. Типичный пример результатов инкубации клеток линии RAW264.7 и флуоресцентно меченного апоА-I представлен на рис. 1.
А Б
Рис. 1. Микроскопия клеток RAW264.7, инкубированных с конъюгатом рекомбинантного апоА-I-ФИТЦ, в световом режиме (А) и флуоресцентном (Б) (х40)

А Б
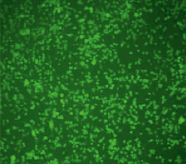
Рис. 2. Микроскопия производных клеток RAW264.7 моноклона 8А3 в световом режиме (А) и флуоресцентном (Б) (х10)
Результаты инкубации клеток с конъюгатом показали, что наибольшее количество светящихся клеток обнаруживалось при максимальной концентрации ФИТЦ-меченого белка 27 мкг/мл и составляло около одной трети от общего числа клеток. При этом количество светящихся клеток при использовании конъюгатов из нативного и рекомбинантного апоА было одинаковым.
Обнаружив факт, что клетки RAW264.7 поглощают апоА, было решено использовать их для получения модели РНК-интерференции. Клетки исходной линии RAW264.7 не продуцировали GFP, поэтому нашей задачей было встраивание гена gfp в геном клетки так, чтобы ген экспрессировался конститутивно. Для этой задачи была привлечена фирма «Евроген» (Россия). Фирмой «Евроген» с помощью лентивирусного вектора pCD-TagGFP2-Puro были получены две моноклональные клеточные линии на основе клеток RAW264.7. Пример клеточной линии моноклона 8А3, стабильно экспрессирующего ген gfp, приведен на рис. 2. Далее линия моноклона 8А3 использовалась для изучения РНК-интерференции.
В качестве олигонуклеотидов миРНК, исходя из литературных данных, была выбрана пара, описанная в работе Tschuch с соавторами [9]:
5’-GAACGGCAUCAAGGUGAACTT-3’
3’-TTCUUGCCGUAGUUCCACUUG-5’.
Выравнивание последовательности смыслового олигонуклеотида со структурой гена gfp в составе вектора pCD-TagGFP2-Puro фирмы «Евроген» выявило 5 отличных нуклеотидов (нуклеотиды подчеркнуты):
(1) 5’-CAAGCUGACCCUGAAGUUCTT-3’;
(2) 5’-CAAGCUGGAGAUCAAGUUC-3’;
где (1) – структура смыслового олигонуклеотида по статье Tschuch [9];
(2) – структура фрагмента гена gfp в составе вектора pCD-TagGFP2-Puro.
Таким образом, чтобы учесть полную комплементарность олигонуклеотида с имеющимся у нас вариантом гена gfp в составе вектора pCD-TagGFP2-Puro в структуру пары нуклеотидов были внесены соответствующие замены. Окончательная структура пары олигонуклеотидов, один из которых комплементарен мРНК гена gfp, выглядела следующим образом:
5’–CAAGCUGGAGAUCAAGUUCТТ–3’
3’-ТТGUUCGACCUCUAGUUCAAG-5’.
Данные нуклеотиды были синтезированы de novo, из них образовывался дуплекс путем эквивалентного смешения, как описано в разделе «Методы», и использовался в экспериментах по подавлению флуоресценции с помощью рекомбинантного апоА и Lipofectamine 2000. Дуплекс инкубировали с апоА при комнатной температуре в течение 20 минут и затем добавляли к клеткам моноклона 8А3. Исследовались различные соотношения миРНК/апоА: 20 пмоль/5 мкг и 80 пмоль/20 мкг. В качестве отрицательного контроля клетки инкубировали с миРНК в отсутствии апоА. В качестве положительного контроля инкубацию клеток проводили со смесью миРНК и Lipofectamine 2000. Инкубация клеток длилась ~ 6 часов, после чего проводили замену среды на свежую, не содержащую трансфицирующих реагентов. Клетки анализировали на вторые сутки эксперимента через 40 ч. Для этого клетки снимали с планшета, рассчитывали количество клеток в камере Горяева и измеряли флуоресценцию. Для сравнения интенсивности флуоресценции полученных образцов флуоресценция пересчитывалась на количество 1000000 клеток в 1 мл. Флуоресценция контрольных клеток принималась за 100 % (таблица).
В результате снижение интенсивности флуоресценции наблюдалось только в образцах клеток, инкубированных со смесью миРНК и Lipofectamine 2000. Максимальное снижение уровня флуоресценции до 47 ± 6 % от контрольного значения наблюдалось при использовании 20 пмоль/лунку миРНК и 2 мкл Lipofectamine 2000. Уровень снижения интенсивности флуоресценции GFP согласовался с литературными данными, где отмечалось, что при использовании данной пары олигонуклеотидов на клетках различного типа уровень флуоресценции снижался до 50–90 % [9]. Это подтверждает корректность подобранной нами пары олигорибонуклеотидов для изучения РНК-интерференции на клетках линии 8А3.
В клетках, инкубированных со смесью рекомбинантного или нативного апоА и миРНК, даже в максимальных соотношениях (миРНК/апоА = 80 пмоль/20 мкг) уровень флуоресценции клеток не отличался от значений флуоресценции контрольных клеток, инкубированных только с миРНК. Эти результаты говорят о том, что на данной модели апоА не способствовал РНК-интерференции.
Вероятных причин такого результата могло быть несколько. Во-первых, апоА не образовывал комплексы и/или не переносил исследуемый дуплекс миРНК в клетки линии 8А3. Несмотря на то, что ранее сотрудниками нашего института методом малоуглового рассеивания было показано взаимодействие апоА с короткими олигонуклеотидами, в состав которых входят (GCC)n повторы (n = 3–5) [4], мы предполагаем, что в данном случае олигонуклеотидный дуплекс не связывался специфически с апоА. Возможной причиной этого являлось отсутствие в используемых олигонуклеотидах GCC-повторов. Во-вторых, при проникновении комплексов переносчик – нуклеиновая кислота в клетку они в первую очередь оказываются в эндосомах, где происходит постепенное закисление внутренней среды компартмента [10, 11]. Это закисление внутренней среды эндосом приводит к деградации нуклеиновых кислот. Поэтому, если переносчик не обладает каким-либо защитным средством, как правило, это может быть фьюзогенный мотив, способствующий высвобождению комплексов из эндосом; нуклеиновая кислота в составе комплекса неспецифически гидролизуется и далее неспособна выполнять свои функции. В используемых нами переносчиках – нативном и рекомбинантном апоА, такие фьюзогенные мотивы отсутствуют, что могло быть дополнительной причиной отрицательных результатов РНК-интерференции. В-третьих, апоА мог недостаточно защищать дуплекс РНК от нуклеаз крови, присутствующих в культуральной среде, что также приводило к гидролизу РНК.
Уровень флуоресценции опытных клеток 8А3 относительно контрольных клеток
|
РНК/Lip 10 пмоль: 2 мкл |
РНК:Lip 20 пмоль: 2 мкл |
РНК:Рек. 20 пмоль: 5 мкг |
РНК:Рек. 80 пмоль: 20 мкг |
РНК:Нат. 20 пмоль: 5 мкг |
РНК:Нат. 80 пмоль: 20 мкг |
РНК 20 пмоль |
РНК 80 пмоль |
|
62 ± 7 %* |
47 ± 6 %* |
94 ± 8 % |
90 ± 9 % |
95 ± 8 % |
88 ± 9 % |
98 ± 5 % |
96 ± 7 % |
Примечание. * – достоверное различие по сравнению с контрольными клетками и клетками, инкубированными с миРНК (p < 0,05). Рек. и Нат. – рекомбинантный или нативный апоА соответственно.
Заключение
В результате выполнения работы было показано, что как рекомбинантный, так и нативный апоА человека проникает в трансформированные мышиные макрофаги линии RAW264.7, однако не способствует РНК-интерференции. Вероятной причиной этого является отсутствие специфического взаимодействия апоА с миРНК.

