Математическое моделирование – неотъемлемый инструмент современного физиологического, в частности электрофизиологического исследования. На сегодняшний день создано множество моделей сердца человека и животных [1–3], но не всегда эти модели основаны на электрофизиологических данных, полученных на одном и том же объекте исследования. Среди экспериментальных животных собака представляет особый интерес в силу сходства процессов де- и реполяризации сердца человека и собаки [4]. До настоящего времени не созданы корректные методы, позволяющие проводить исследования процессов деполяризации и реполяризации интрамуральных слоев миокарда человека. Вместе с тем изучать электрическую гетерогенность миокарда и реактивность сердца на действие различных факторов возможно на открытом сердце животных, с последующей экстраполяцией экспериментальных данных на сердце человека. Таким образом, собака является удобным объектом для создания моделей различных заболеваний сердца человека, связанных с нарушениями ритма, проводимости и сократимости.
Ранее нами был получен большой объем экспериментальных данных о формировании кардиоэлектрического поля у собаки [5–6]. Уникальность этих данных в том, что измерения на эпикарде, в интрамуральных слоях миокарда желудочков и на поверхности туловища производили на одних и тех же животных, что позволило получить максимально объективную картину. Однако если на эпикарде и поверхности туловища отводящие электроды были расположены достаточно равномерно, то количество электродов в интрамуральных слоях было ограничено в силу объективных причин.
Целью данной работы было создание детальной трехмерной модели желудочков сердца собаки, которая позволила бы обобщить имеющиеся экспериментальные данные и могла бы служить самостоятельным инструментом исследования механизмов формирования кардиоэлектрического поля.
Материалы и методы исследования
Экспериментальные данные. Формирование кардиоэлектрического поля изучали у взрослых беспородных собак обоего пола (N = 21) путем синхронной многоканальной регистрации кардиопотенциалов. Потенциалы регистрировали в униполярных отведениях относительно терминали Вильсона на эпикарде и в интрамуральных слоях желудочков сердца, а также на поверхности туловища животных [5–6]. При обращении с животными соблюдали международные правила (Guide for the Care and Use of Laboratory Animals – публикация US National Institutes of Health: NIH Publication № 85–23, ред. 1996).
Для измерения потенциалов на поверхности туловища использовали 64 подкожных игольчатых электрода, распределенных по поверхности туловища в виде равномерной сетки из 8 рядов и 8 столбцов. ЭКГ записывали при положении животных лежа на спине. Для регистрации эпикардиальных электрограмм использовали 64-электродную эпикардиальную сетку, равномерно охватывающую поверхность желудочков. В интрамуральных слоях электрограммы записывали с помощью игольчатых электродов. Одновременно (синхронно) с измерением потенциалов на поверхности туловища, эпикарде и в интрамуральных слоях желудочков записывали «контрольные» ЭКГ в отведениях от конечностей.
Модель. Разработанная нами ранее дискретная компьютерная модель желудочков сердца [7] была адаптирована для геометрии сердца и торса собаки. Расположение очагов первичной активации задавали в соответствии с экспериментальными данными [5–6]. Для каждого элемента модели значение длительности потенциалов действия (ПД) вычисляли с помощью интерполяции на основе значений, заданных в «узловых точках» модели, которые были равномерно распределены по внешней и внутренним поверхностям модели (рис. 1). «Узловые точки» были расположены в модели таким образом, чтобы было возможно моделировать градиенты длительности ПД во всех направлениях – апикобазальном, переднезаднем, межжелудочковом и трансмуральном. Значения длительности ПД в «узловых точках» задавали на основе данных измерений в интрамуральных слоях желудочков и на эпикарде [5–6].
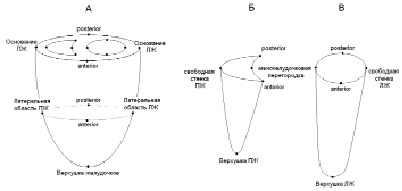
Рис. 1. Схема положения «узловых точек» в модели желудочков сердца: ЛЖ – левый желудочек, ПЖ – правый желудочек, posterior – задняя поверхность желудочков, anterior – передняя поверхность желудочков. А – внешняя (эпикардиальная) поверхность модели, Б – эндокардиальная поверхность ПЖ, В – эндокардиальная поверхность ЛЖ
Форму ПД для ячеек модели задавали на основе модели желудочкового ПД собаки [8]. Фазу реполяризации потенциала действия укорачивали/удлиняли в соответствии со значением длительности ПД для данного элемента модели. Момент окончания реполяризации для ячеек модели вычисляли как сумму времени активации и длительности ПД. Величину потенциала в точке наблюдения на поверхности торса вычисляли как
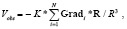
где Vobs – значение потенциала в точке наблюдения, R – вектор, соединяющий i-ю ячейку модели и точку наблюдения на поверхности торса, Gradi – градиент потенциала в i-й ячейке модели, N – суммарное число элементов модели, i – порядковый номер ячейки (i = 1...N), K – коэффициент, описывающий свойства туловища как объемного проводника.
Градиент потенциала в i-й ячейке модели вычисляли как
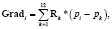
где Rk – вектор, соединяющий i-ю ячейку с одной из 12 соседних ячеек модели, pi – величина потенциала в i-й ячейке, pk – величина потенциала в соседней ячейке модели в данный момент времени, k – порядковый номер соседней ячейки модели (k = 1..12).
Положение точек на поверхности туловища, для которых вычисляли внесердечные кардиопотенциалы, задавали с учетом реалистичной формы торса собаки. При вычислениях использовали «стандартную» форму торса собаки (с умеренно заостренной грудной клеткой) и характерное для собаки соотношение величины торса и сердца, а также реалистичную пространственную ориентацию сердца: сердце было наклонено вправо (поворот продольной оси сердца во фронтальной плоскости на 30 °), а его верхушка приближена к вентральной поверхности грудной клетки (поворот продольной оси сердца в сагиттальной плоскости на 45 °). Геометрический центр сердца был расположен посередине грудной клетки и приближен к ее поверхности.
Результаты исследования и их обсуждение
Последовательность деполяризации. Смоделированная последовательность деполяризации миокарда желудочков собаки представлена на рис. 2, А. Первичные очаги деполяризации задавали в соответствии с экспериментальными данными [4–5] в следующей очередности и в следующих областях модели: (1) на границе нижней и средней трети субэндокардиальной поверхности левой стороны межжелудочковой перегородки (0 мс); (2) в основании папиллярных мышц левого желудочка (0–5 мс); (3) в основании передней папиллярной мышцы правого желудочка (0–5 мс). В модели имели место два очага выхода возбуждения на эпикардиальную поверхность: (1) нижняя (верхушечная) передняя область свободной стенки правого желудочка вблизи ее присоединения к межжелудочковой перегородке и (2) нижняя передняя область свободной стенки левого желудочка. Распространение активации шло от эндокарда к эпикарду и от верхушки к основанию желудочков, с более быстрым охватом возбуждением субэндокардиальных слоев. В межжелудочковой перегородке активация распространялась слева направо и снизу вверх. В последнюю очередь активация достигала латеральных областей в субэпикарде левого желудочка. Правый желудочек деполяризовался в целом быстрее, чем левый желудочек. Длительность деполяризации составила 42 мс. Смоделированная последовательность активации соответствует как собственным экспериментальным данным [5–6], так и данным других исследователей [4, 9].
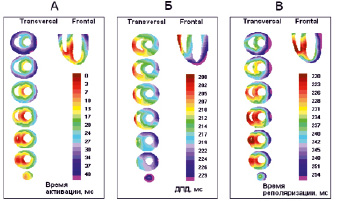
Рис. 2. Смоделированные последовательность деполяризации (А), распределение длительностей ПД (Б) и последовательность реполяризации (В) в желудочках сердца собаки в норме
Представлены трансверсальные (Transversal) и фронтальные (Frontal) проекции модели. Время де- и реполяризации указано от момента появления первых деполяризованных элементов в модели, значения длительности ПД – в абсолютных значениях.
Распределение длительности ПД. Расределение длительностей ПД в желудочках сердца собаки (рис. 2, Б) моделировали на основе экспериментальных данных [5–6]. Наиболее короткие ПД были в латеральной области эпикардиальной поверхности правого желудочка, наиболее длинные ПД – на латеральной поверхности левого желудочка.
Апикобазальный градиент длительности ПД в правом желудочке отсутствовал, а в левом желудочке составлял 10 мс (на верхушке длительность ПД была длиннее, чем в основании). Следует отметить, что другие исследователи также наблюдали более длинные ПД в области верхушки по сравнению с основанием желудочков [9], что совпадает с направлением апикобазального градиента у человека [10]. Наибольшим по величине был межжелудочковый градиент длительности ПД (30 мс). Также был достаточно выражен переднезадний градиент длительности ПД (5–10 мс): на вентральной поверхности желудочков ПД были короче, чем на дорсальной. Наименьшим был трансмуральный градиент (около 5 мс, длительность ПД в модели плавно увеличивалась от эпикарда к эндокарду). Небольшая величина трансмурального градиента длительности ПД соответствует данным других исследователей, полученных in vivo [11], в отличие от больших (до 100 мс и более) величин трансмурального градиента, зарегистрированным в экспериментах in vitro [12].
Последовательность реполяризации. Результаты моделирования последовательности реполяризации желудочков сердца собаки представлены на рис. 2, В. Основным направлением реполяризации было направление от правого желудочка к левому; основание желудочков реполяризовалось позднее, чем верхушка желудочков. Наиболее ранняя реполяризация имела место в верхушке правого желудочка и в нижней части межжелудочковой перегородки, наиболее поздняя – в основании левого желудочка. Трансмуральный градиент длительности ПД в модели по величине был меньше, чем трансмуральный градиент активации, поэтому в трансмуральном направлении реполяризация шла от эндокардиальной поверхности к эпикардиальной. Наиболее ранняя реполяризация в модели имела место на вентральной поверхности эндокардиальной стороны верхушки левого желудочка (182 мс от начала активации), наиболее поздняя – на эпикарде латеральной поверхности левого желудочка (264 мс от начала активации). Таким образом, дисперсия реполяризации в модели составила 82 мс. Смоделированная последовательность реполяризации модели находится в хорошем соответствии с экспериментальными данными [4, 9].
Кардиоэлектрические потенциалы на поверхности туловища. На протяжении периода QRS смоделированное кардиоэлектрическое поле на поверхности туловища претерпевало существенные изменения. В начале периода, на восходящей фазе зубца R на ЭКГ, зона положительных потенциалов располагалась каудально и занимала бoльшую часть вентральной поверхности туловища (рис. 3). Соответственно, зона отрицательных потенциалов была расположена в краниальной части торса и занимала бoльшую часть его дорсальной поверхности. Затем области отрицательных и положительных потенциалов постепенно смещались, в результате чего на момент, соответствующий зубцу S, на поверхности туловища имела место полная инверсия потенциала, т.е. зоны отрицательных и положительных потенциалов и их экстремумы менялись местами (рис. 3).
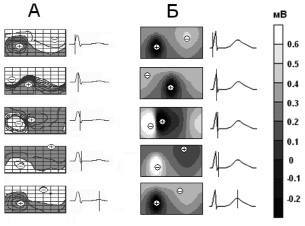
Рис. 3. Экспериментально измеренное (А) и смоделированное (Б) распределение кардиопотенциалов на поверхности торса собаки в период де- и реполяризации желудочков
В период Т-волны смоделированное распределение кардиопотенциалов на поверхности торса собаки практически не изменялось, за исключением величины потенциалов. Оно было краниокаудальным, с отрицательной краниальной и положительной каудальной областями (рис. 3). Область отрицательных потенциалов занимала бoльшую часть дорсальной поверхности торса, область положительных потенциалов – бoльшую часть вентральной поверхности торса. Положительный экстремум потенциала был расположен в средней части грудной клетки, отрицательный – на дорсальной поверхности.
Смоделированное распределение потенциала хорошо соответствовало экспериментальным данным (рис. 3) [6].
Левая половина карт соответствует вентральной поверхности торса, правая – дорсальной поверхности. На экспериментальных картах темным цветом показана область положительных потенциалов, шаг изопотенциальных линий 0,3 мВ. Экстремумы потенциала обозначены знаками «+» и «–». Справа от каждой карты приведена контрольная ЭКГ во II отведении от конечностей с маркером времени.
Заключение
Таким образом, на основе экспериментальных данных разработана модель, реалистично воспроизводящая процессы активации и реполяризации в желудочках сердца собаки и отображение этих процессов на поверхность туловища. Изменяя параметры модели, можно использовать ее для исследования таких факторов формирования кардиоэлектрического поля, как скорость проведения возбуждения, локализация первичных очагов возбуждения, длительность потенциалов действия и ее неоднородное распределение в желудочках сердца, форма торса, положение и ориентация сердца в грудной клетке.
Работа выполнена в рамках темы «Сравнительно-физиологическое исследование пространственно-временной организации электрофизиологических процессов и сократимости миокарда позвоночных животных (№ ГР АААА-А17-117012310154-6) по Программе ФНИ на 2013–2020 гг.

