Основными материалами для изготовления ортопедических и дентальных внутрикостных имплантатов являются нержавеющие стали, титан и его сплавы. Длительное пребывание металлических имплантатов в агрессивной среде организма проводит к коррозии и, как следствие, попаданию металлических ионов в окружающую ткань. Это может вызывать резорбцию костной ткани вокруг имплантата, его расшатывание, что повышает риск отторжения, воспаления, необходимости проведения дорогостоящих повторных операций. Улучшить остеоинтеграцию металлических имплантатов можно нанесением на их поверхность биологически совместимых покрытий.
Углерод – уникальный химический элемент, отличающийся разнообразием химических соединений. До недавнего времени были известны две кристаллические формы углерода – графит и алмаз. Исследования последних нескольких десятилетий привели к открытию фуллеренов, углеродных нанотрубок, графена. Кроме того, в конце 70-х гг. XX в. были осаждены пленочные углеродные структуры с набором свойств, характерных для алмаза, благодаря которым они получили название «алмазоподобные». Открытие новых углеродных материалов привело к интенсивному изучению их свойств и дало импульс к поиску областей их практического использования.
Впервые исследование биологической совместимости алмазоподобных углеродных пленок (АУП) было проведено в 1991 г. [1]. В течение последующих лет были опубликованы десятки работ, результаты которых подтвердили биосовместимость АУП с клетками различных линий. Однако вследствие большого разнообразия методов получения таких пленок в настоящее время нет систематических данных по влиянию их состава, структуры, физико-химических характеристик на биомедицинские свойства. Систематизация данных также затруднена из-за того, что в каждой экспериментальной работе применяется свой комплекс методов исследования, а также клетки различных линий.
Анализируя экспериментальные работы по АУП, можно отметить, что большинство работ посвящено исследованию адгезии клеток и их морфологии после культивирования в течение одного-трех дней. Установлено, что АУП не снижают адгезию клеток по сравнению с медицинскими пластиками (полиметилметакрилат, политетрафторэтилен, полистирол), нержавеющей сталью и титаном. Для АУП свойственны и типичные закономерности адгезии клеток, в частности повышение их гидрофильности вследствие роста шероховатости, введения других элементов, ультрафиолетовой обработки и т.д., улучшает адгезию клеток.
АУП, осажденные на гладкие полированные поверхности различных материалов, имеют шероховатость от наноуровня до микронного масштаба. На таких поверхностях клетки хорошо распластываются и имеют нормальную морфологию. Во всех работах по исследованию АУП отмечается, что адгезирующие на их поверхность клетки жизнеспособны и способны к пролиферации [2].
Для ортопедических и дентальных имплантатов предпочтительны пленки, не вызывающие резорбцию костной ткани, и улучшающие их остеоинтеграцию. Термин «остеоинтеграция» ввел P.-I. Branemark [3], который создал цельную концепцию имплантации дентальных металлических имплантатов. Позже было сформулировано биологическое определение: «остеоинтеграция – это прямая структурная и функциональная связь между структурированной, живой костью и поверхностью несущего нагрузку имплантата».
Для остеоинтеграции имплантатов желательно, чтобы их поверхность обладала остеокондуктивными, остеоиндуктивными свойствами, а также активировала остеогенез. Оригинальные исследования остеоиндуктивных свойств АУП в экспериментах in vivo при сроках имплантации до одного года показали, что они направленно действуют на дифференцирование клеток костного мозга в остеогенном направлении и способствуют формированию внеклеточного матрикса и его минерализации [4–6].
Цель настоящей работы – на практических примерах показать перспективность использования биосовместимых покрытий с алмазоподобным углеродом в биомедицине. В работе также приведены технологические особенности нанесения покрытий на разные материалы и изделия.
Материалы и методы исследования
Покрытия с алмазоподобным углеродом наносили в установке УВНИПА-001. Вакуумная камера установки снабжена источником газовых ионов, дуговым источником распыления металлов, импульсно-дуговым источником распыления графита. Для равномерного осаждения покрытий по всей поверхности имплантатов установка оснащена держателем карусельного типа.
Перкутанные фиксаторы. Для экспериментов использовали стандартные спицы для чрескостного остеосинтеза диаметром 1,8 мм из сплава железа 12Х18Н9Т и стержни диаметром 6 мм из сплава титана. Перед осаждением пленок спицы и стержни очищались в смеси дистиллированной воды и этанола в ультразвуковой камере. После высушивания на воздухе они помещались в рабочую вакуумную камеру. По достижении в рабочей камере давления Р = 6х10-2 Па включали источник газовых ионов для удаления загрязненных поверхностных слоев ускоренными (E = 4 кэВ) ионами Ar+. В результате травления с поверхности удалялся слой толщиной не более 100 нм. Далее включали источник дугового распыления металла с магнитной сепарацией потока ионов и наносили адгезионный слой титана толщиной от 20 до 30 нм. Не прерывая работу дугового источника, включали импульсно-дуговой источник. При одновременной работе двух источников осаждали титан-углеродный слой Ti-C. Повышая частоту импульсно-дугового источника от 3 до 25 Гц, получали переходный слой с градиентом концентрации углерода по толщине. По достижении нужной толщины переходного Ti-C слоя (~ 100 нм) отключали дуговой источник и осаждали верхний слой из алмазоподобного углерода. Общая толщина многослойного покрытия не превышала 1,5 мкм. В каждое напыление устанавливали образцы-свидетели для выборочного контроля толщины (сканирующая электронная микроскопия), твердости (метод наноиндентирования) и шероховатости (атомно-силовая микроскопия) покрытия. Метод Рамановской спектроскопии использовали для определения соотношения sp3/sp2, где sp3 и sp2 – тип гибридной связи между атомами углерода в алмазоподобном углеродном слое (тетраэдрическая и тригональная координация атомов соответственно).
Дентальные имплантаты. Особенность осаждения покрытия на дентальные имплантаты из титанового сплава состояла в следующем. После аналогичных для фиксаторов этапов очистки поверхности и нанесения титанового подслоя наносили многослойную наноламинарную пленку:
[(TixCy) + (а-С)]n1 + [(TixCy)+(а-С)]n2 + [(TixCy) + (а-С)]n3 + [(TixCy) + (а-С)]n4 + [(TixCy) + (а-С)]n5,
где а-С – слой алмазоподобного углерода; n – количество парных слоев; x, у – содержание титана и углерода в TixCy соответственно; n1, n2…..n5 – блоки по пять парных слоев, осажденных при частоте импульсно-дугового источника 1, 3, 5, 10 и 15 Гц соответственно.
В таких условиях осаждения количество титана в TixCy слоях одного блока остается постоянным, постепенно уменьшаясь в каждом последующем блоке за счет роста частоты импульсно-дугового источника от 1 до 15 Гц. Таким образом, блок n5 включает TixCy слои с максимальным содержанием углерода. После осаждения многослойной наноламинарной пленки дуговой источник отключался. Непрерывная работа импульсно-дугового источника приводила к осаждению верхнего слоя из алмазоподобного углерода. Общая толщина покрытия не превышала 3 мкм.
Характеристики пленок. Во всех многослойных покрытиях, осаждаемых на поверхность имплантатов, верхний слой состоял из алмазоподобного углерода. Таким образом, при хирургическом внедрении имплантатов с многослойным покрытием в живой организм биологическая ткань непосредственно контактирует только с алмазоподобным углеродом. Поэтому приведем некоторые характеристики АУП, осаждаемых приведенным выше способом. По данным Рамановской спектроскопии, количество sp3-связанного углерода в них составляет 70–80 %. Рельеф поверхности АУП включает гладкие участки с шероховатостью 20–30 нм, которые окружены цепочками пиков высотой 100–200 нм. Кроме того, осаждение АУП в условиях нефильтрованного пучка ионов углерода приводит к росту отдельных пирамидальных выступов высотой, сравнимой с толщиной пленки. Шероховатость от наноуровня до микронного масштаба способствует хорошей адгезии и пролиферации клеток [7]. Твердость пленок находилась в интервале 28–36 ГПа. Твёрдость многослойных структур в целом не превышала 21 ГПа.
Доклинические исследования in vivo, проведенные ранее, не выявили общих, воспалительных и токсических реакций на имплантаты с алмазоподобным углеродным покрытием [8, 9]. В соответствии с разрешением этического комитета ФГБУ «Уральский НИИ травматологии и ортопедии им. В.Д. Чаклина» МЗ РФ (г. Екатеринбург) была проведена ограниченная клиническая апробация имплантатов с алмазоподобным углеродным покрытием.
В 2013 г. на базе ООО «Частная Стоматология», г. Еманжелинск, была проведена первая клиническая апробация дентальных имплантатов из сплава титана с АУП. На основании положительных результатов остеоинтеграции дентальных имплантатов с АУП получен патент РФ № 2571559. В 2015 г. создано ООО «Нараяма», на базе которого выполняются проекты, направленные на исследование биомедицинских характеристик дентальных имплантатов с углеродным нанопокрытием.
Результаты исследования и их обсуждение
Апробация фиксаторов. Клиническая апробация перкутанных фиксаторов с покрытием проведена у пациентов с ложными суставами большеберцовой кости, осложненными иммобилизационным остеопорозом. У 12 пациентов применили стандартные спицы диаметром 1,8 мм из стали 12Х18Н9Т и стержни из сплава титана, а у 10 человек аналогичные спицы и стержни имели многослойное покрытие с верхним слоем из алмазоподобного углерода. Спицы вводили в голень на уровне обоих метафизов и диафиза берцовых костей, закрепляли в аппарате Илизарова и разрешали пациентам нагрузку поврежденной конечности. Голень фиксировали аппаратом до наступления сращения костных отломков. После демонтажа аппарата оценивали диаметр каждого спицевого канала, используя метод мультиспиральной компьютерной томографии. Результаты сравнительного исследования показали, что костная резорбция вокруг фиксаторов, являющаяся типичной реакцией костной ткани на металлическое инородное тело (а именно спицу), оказалась принципиально различной. При использовании спиц с АУП резорбция кости в интерфейсе «имплантат – кость» составила 11,67 %, в то время как применение стандартных спиц характеризовалось высокими цифрами костной резорбции, составившей 41,67 %. Таким образом, осаждение АУП на фиксаторы обеспечило снижение выраженности костной резорбции вокруг спиц в 3,5 раза в сравнении с пациентами, которых лечили с использованием стандартных спиц. Это позволило значимо улучшить условия сращения костных отломков даже в условиях остеопороза. Какие-либо воспалительные или аллергические реакции не были выявлены ни у одного пациента при использовании фиксаторов с АУП. Кроме того, применение покрытий с низким коэффициентом трения обеспечивает атравматичность введения стандартных фиксирующих элементов при чрескостном остеосинтезе. На рис. 1 представлены томограммы спицевых каналов после удаления фиксаторов без покрытия и с покрытием. Диаметр каналов составил 2,2 мм (рис. 1, а) и 1,8 мм (рис. 1, б) соответственно.
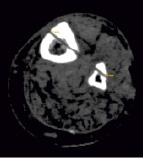
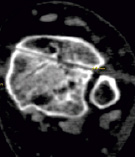
а) б)
Рис. 1. КТ спицевых каналов большеберцовой кости после удаления спиц без покрытия (а) и с покрытием (б)


а) б)
Рис. 2. Поперечное сечение многослойного покрытия толщиной 3 мкм (а) и дентальный имплантат с покрытием (б)
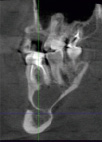
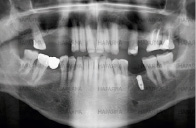
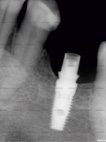
а) б) в)
Рис. 3. Клинический пример применения дентального имплантата с АУП: а – поврежденный зуб; б – рентгенологический снимок спустя 5 дней после операции; в – состояние имплантата и кости через 24 недели
Апробация дентальных имплантатов.
Многослойное покрытие наносилось на дентальные имплантаты из сплава титана (Grade 4, Grade 5) по методике, описанной выше. Излом многослойного покрытия приведен на рис. 2, а. На рис. 2, б, представлен стоматологический имплантат с покрытием.
Имплантаты с покрытием были установлены волонтерам с их письменного согласия. Имплантное ложе формировалось фрезами с возрастающей последовательностью размеров с шагом 0,5 мм при скорости не более 800 об/мин с водяным охлаждением. Установка имплантата производилась имплантологическим диспансером при усилии 20 Н и скорости вращения 50 об/мин. Контрольные сроки риска миграции (изменения местоположения) имплантата составили 2, 8 и 24 недели. Через 2 недели после установки имплантатов с покрытием наблюдалась хорошая вторичная их фиксация в имплантном ложе. В течение последующего (более 24 недель) наблюдения ни у одного из пациентов не было обнаружено признаков миграции, отторжения, воспаления, нагноения, а также аллергических реакций.
По результатам остеоинтеграции дентальных имплантатов с АУП в сложных клинических случаях приведем пример одного их них. Пациенту 45 лет с диабетом был удален 6 зуб с радикулярной кистой. Была проведена стандартная процедура очистки кисты через корневой канал. Одномоментно без использования искусственной кости был установлен имплантат 4х10 мм с многослойным покрытием. Стабильность имплантата наступила в течении 5 дней. Последующие наблюдения не выявили признаков его миграции. Приведенные на рис. 3 рентгенограммы показывают положительные результаты воздействия имплантата с покрытием на трабекулярную кость.
Заключение
Апробация опытных образцов внутрикостных имплантатов с многослойными покрытиями, верхний слой которых состоял из алмазоподобного углерода, показала перспективность их использования в биомедицине.
Работа выполнена в рамках государственного задания ФАНО России (тема «Спин», № АААА-А18-118020290104-2) при частичной поддержке РФФИ (проект № 17-58-53076).

