Большинство исследований взаимодействия полифенольных соединений растительного происхождения с липидами и липидными мембранами, представленных в литературе [1–3], проводились с использованием фосфолипидов, входящих в состав наружной стороны мембран, обычно фосфатидилхолинов, образующих бислой [2, 3]. Однако биологические мембраны состоят из широкого спектра липидов: липидов, которые образуют бислой, и липидов, которые могут принимать небислойные структуры, такие как инвертированная гексагональная фаза (HII) [4]. Фосфатидилэтаноламин, второй по распространенности фосфолипид, является примером этого небислойного класса фосфолипидов, молекулы которого в изолированном виде образуют бислойные структуры в диапазоне температур вблизи точки плавления липида. При дальнейшем нагревании липид претерпевает фазовый переход из бислоя в гексагональную НII фазу, который зависит от различных внутренних и внешних факторов [5]. Предполагается, что небислойные фосфолипиды в силу своей формы образуют локальные переходные структуры, которые, как считается, играют важную роль в жизненно важных клеточных процессах, таких как слияние мембран, образование везикул и деление клеток [6]. Помимо этих процессов, небислойные фосфолипиды воздействуют на функцию мембран, влияя на объемные свойства мембран, которые, в свою очередь, влияют на вставку, укладку и функцию некоторых интегральных мембранных белков [7]. Модулятором фазовых переходов в мембранах могут служить некоторые растительные полифенолы из большого класса флавоноидов. Например, было обнаружено, что некоторые флавоноиды способны инициировать образование небислойной фазы [8] в липидной мембране, процесс которого зависит от количества ОН-групп в молекуле [9].
Несмотря на большое количество опубликованных работ по взаимодействию флавоноидов с липидами in vitro в модельных бислоях (липосомах), действие липидов, способных формировать и изменять небислойные структуры, остается мало изученным.
Цель исследования – исследование влияния флавоноидов на термически индуцированные фазовые переходы фосфолипидов в мембранах липосом.
Материалы и методы исследования
В работе использовали фосфолипид: 1-пальмитоил-2-олеоилфосфатидилэтано-ламин (ФЭ) (Avanti Polar Lipids, USA), флавоноиды (Sigma-Aldrich, USA), Tris-HCl (Serva, Germany).
Приготовление липосом. В круглодонной колбе растворенный в хлороформе фосфолипид фосфатидилэтаноламин (ФЭ) высушивали в струе аргона до образования тонкой пленки на стенке сосуда. Для полного удаления растворителя препарат вакуумировали в течение 24 часов, затем липид гидратировали в 10 мМ Трис-HCl буфере (рН 7,4) путем механического встряхивания на вортексе или шейкере при температуре выше фазового перехода. Для полной гидратации липосом образцы медленно нагревали до температуры 90oС – выше температуры фазового перехода бислоя мембраны в небислойную структуру, охлаждали до комнатной температуры и использовали в экспериментах.
Флавоноиды (катехин, дигидрокверцетин, флоретин (рис. 1B, 1C, 1D), растворенные в 70%-ном этаноле, кверцетин (рис. 1A) – в ДМСО) добавляли в суспензию готовых липосом, встряхивая на шейкере или вортексе. Объем вносимого растворителя составлял не более 0,1%.
Плавление липидов в липосомах для термического анализа осуществляли с использованием дифференциального адиабатного сканирующего микрокалориметра ДАСМ-4 (ИБП РАН, г. Пущино, Россия). Скорость прогрева составляла 1 К/мин [10]. Температуры фазового перехода (гелевый в жидкокристаллический (Tm) или бислой в небислойную фазу (Thex)) определяли как температуру пикового максимума на термограммах сканирования липосом. Изменение энтальпии фазовых переходов (ΔH) получали по площадям под пиками переходов.
Рис. 1. Флавоноиды: A – кверцетин, B – дигидрокверцетин, C – катехин, D – флоретин
Результаты исследования и их обсуждение
На рисунках 2 и 3 представлены термограммы плавления липидов ФЭ в липосомах, характеризующихся фазовыми переходами с максимумами температуры 25,1oС (рис. 2а) и 69,4 оС (рис. 3а) в условиях измерения, приведенных в подписях к рисункам.
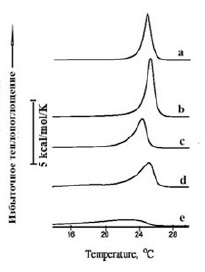
Рис. 2. Термограммы плавления липидов в липосомах из ФЭ (2 мг/мл) в диапазоне температуры плавления бислоя липосом – а. В присутствии флавоноидов (4,0х10-4М): катехин – b, кверцетин – c, дигидрокверцетин – d, флоретин – e. Среда измерения: 10 мМ Трис-HCl, рН 7,4
Два температурных диапазона (рис. 2 и рис. 3), в которых наблюдаются фазовые переходы, представлены отдельно друг от друга. В интервале температур 15–30oС (рис. 2а) действие исследуемых флавоноидов мало чем отличалось от аналогичного процесса для липосом из димиристоилфосфатидилхолина (ДМФХ) [11]. Катехин оказывал слабое влияние на плавление бислоя, тогда как действие кверцетина и дигидрокверцетина на бислой мембраны сводилось к уменьшению высоты перехода на термограммах (рис. 2c, 2d). Наиболее существенное влияние оказывал флоретин (рис. 2e), в присутствии которого снижалась энтальпия перехода с 4,39 kcal/mol до 3,52 kcal/mol, в то время как его полуширина, наоборот, увеличилась почти в 7 раз (табл. 1). Ниже в таблице 1 приведены численные значения термодинамических параметров бислойной структуры термотропных фазовых переходов ФЭ, термограммы которых представлены на рисунке 2.
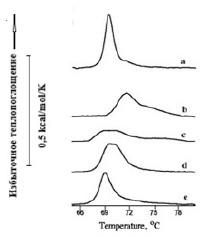
Рис. 3. Термограммы плавления липидов в липосомах из ФЭ (2 мг/мл) в диапазоне температуры перехода из бислоя в гексагональную фазу HII – a. В присутствии флавоноидов (4,0х10-4М): катехин – b, кверцетин – c, дигидрокверцетин – d, флоретин – e. Среда измерения: 10 мМ Трис-HCl, рН 7,4
Таблица 1
Термодинамические параметры фазовых переходов ФЭ
|
Флавоноид |
∆H, kcal/mol |
T, oC |
T1/2, oC |
∆Cp, kcal/mol/K |
|
ФЭ (контроль) |
4,39 |
25,1 |
1.0 |
3,29 |
|
ФЭ + катехин |
5,77 |
25,5 |
1,0 |
4,02 |
|
ФЭ + дигидрокверцетин |
4,86 |
24,5 |
1,6 |
2,13 |
|
ФЭ + кверцетин |
5,07 |
25,3 |
2,1 |
1,58 |
|
ФЭ + флоретин |
3,52 |
22,4 |
7,4 |
0,44 |
Таблица 2
Термодинамические параметры фазовых переходов ФЭ
|
Флавоноид |
∆H, kcal/mol |
T, oC |
T1/2, oC |
∆Cp, kcal/mol/K |
|
ФЭ (контроль) |
0,49 |
69,4 |
1,3 |
0,27 |
|
ФЭ + катехин |
0,45 |
71,7 |
2,9 |
0,12 |
|
ФЭ + дигидрокверцетин |
0,32 |
70,2 |
4,2 |
0,06 |
|
ФЭ + кверцетин |
0,52 |
69,6 |
2,8 |
0,15 |
|
ФЭ + флоретин |
0,43 |
69,0 |
1,8 |
0,17 |
В интервале температур 65–80oС (рис. 3) действие молекул флоретина (рис. 3e) было наименее выраженным и заключалось в снижении максимума температуры перехода.
Положение максимума температуры перехода в присутствии молекул катехина увеличивалось на 2,5оС, в 2 раза увеличилась энтальпия (рис. 3b) и значительно увеличивалась полуширина перехода (табл. 2). Ниже в таблице 2 приведены численные значения термодинамических параметров гексагональной структуры термотропных фазовых переходов ФЭ, термограммы которых представлены на рисунке 3.
В присутствии дигидрокверцетина (рис. 3d) понижалась энтальпия перехода с 0,49 kcal/mol до 0,32 kcal/mol. Несмотря на существенное изменение формы термограммы плавления липида в присутствии кверцетина (рис. 3c), значение энтальпии перехода почти не изменилось. Таким образом, исследованные молекулы разного класса из обширной группы флавоноидов по-разному действуют на фазовые переходы мембраны из ФЭ как в диапазоне температуры плавления бислоя, так и в области перехода в небислойную гексагональную фазу HII.
Молекулы флавоноидов, использованные в работе, отличаются структурой (рис. 1), следовательно, и сродством, и местом локализации в липиде. Во многих случаях молекулы флавоноидов расположены близко к полярным группам липидов [2, 12], однако в зависимости от структуры молекул расположение может варьироваться. Изменение максимума температуры плавления и формы кривых термограмм указывает на способность флавоноидов инициировать гетерогенность липидного бислоя. В частности, как отмечалось выше, флавоноиды индуцируют сегментарное упорядочение в мембране [8]. Аналогичные изменения фазового состояния липидов могут происходить и в клеточных мембранах, что способно приводить к изменению баланса между липидами и повлиять на функционирование некоторых мембранных белков. Кроме того, эти изменения могут влиять и на процессы экзоцитоза и слияния мембран внутри клетки.
Выводы
1. Кверцетин и дигидрокверцетин снижают температуру фазового перехода фосфатидилэтаноламина, происходящего при 25oС, в меньшей степени, чем халкон флоретин. Катехин также снижает температуру плавления бислоя, но повышает температуру перехода из бислоя в гексагональную HII фазу.
2. Флоретин значительно изменяет термодинамические параметры плавления бислоя, но слабо действует на переход в гексагональную HII фазу.

