Изучению ассоциации микроэлементных нарушений с патологическими процессами в организме человека в последнее время уделяется большое внимание. Это обусловлено новыми экспериментальными данными о влиянии токсичных металлов на важнейшие биологические процессы. Доказано, что при хроническом воздействии кадмия, никеля, мышьяка происходит модификация экспрессии генов, инициация мутагенеза и канцерогенеза [5, 3]. Изменения генной экспрессии под влиянием факторов окружающей среды лежат в основе патогенеза генетически детерминированных мультифакториальных заболеваний [4], к которым относится гнездная алопеция. Клиническая неоднородность, непредсказуемость течения гнездной алопеции [2], зависящие от взаимодействия многочисленных факторов внешней и внутренней среды, требуют применения многомерных методов статистического анализа при обработке материалов научных исследований. Особенность этих методов состоит в том, что они могут оценивать изучаемое явление с учетом изменчивости всех признаков одновременно, при этом, чем меньше условий требует конкретный метод, тем более вероятно, что в результате его применения будут получены выводы, адекватные поставленной цели.
Цель исследования. Целью работы явилось создание прогностической модели определения специфики микроэлементного статуса пациентов с гнездной алопецией с использованием методов кластерного анализа и классифицирующих деревьев. Применение указанных методов дает возможность распределить совокупность пациентов на группы с учетом ряда признаков и «сформулировать правило», позволяющее относить пациентов к той или иной группе. Предпосылкой к использованию описанного подхода явилось наше предположение о разнонаправленности нарушений микроэлементного статуса у пациентов с гнездной алопецией.
Материалы и методы исследования
В исследовании участвовали 45 пациентов с гнездной алопецией в возрасте от 2,5 до 62 лет, средний возраст 21,8 ± 14,5 лет и 26 здоровых лиц в возрасте от 4 до 64 лет (средний возраст 24,8 ± 14,8 лет), составивших контрольную группу. Характеристика элементного статуса основывалась на определении содержания 11 химических элементов (свинец, висмут, кадмий, никель, кобальт, медь, железо, марганец, хром, стронций и цинк) в образцах волос и крови методом атомно-абсорбционной спектрофотометрии. Исследование выполнено в санитарно-химической лаборатории Оренбургской государственной медицинской академии (лицензия № Ф-56-01-000-803). Статистическая обработка данных проведена в программе Statistica 10.0. Большая часть представленных значений микроэлементов не подчинялась законам нормального распределения (по критерию Шапиро-Уилка) и представлена в статье в виде медианы и интерквартильного размаха (25-го и 75-го процентилей), возраст пациентов выражен арифметическим средним и стандартным отклонением. Сравнение значений проведено при помощи непараметрического критерия Манна-Уитни. Статистически значимыми считались различия при р <0,05.
Результаты исследования и их обсуждение
Применение кластерного анализа позволило распределить пациентов с гнездной алопецией на 4 кластера. В основе деления пациентов на кластеры лежали такие признаки как возраст, значения уровней свинца, висмута, кадмия, никеля, кобальта, меди, железа, марганца, хрома, стронция и цинка в образцах крови и волос пациентов, – всего 23 признака. Кластер 1 включал 13 пациентов, средний возраст которых составил 19,4±11,4 года. В кластер 2 вошло 18 пациентов со средним возрастом 26,2±18,1 года. Кластер 3 был представлен 11 пациентами, их средний возраст равен 19,6±12,7 лет. В кластер 4 вошло 3 пациента с гнездной алопецией со средним возрастом 13,2±10,3 лет.
Сравнительный анализ показателей, характеризующих микроэлементный обмен в кластерах, свидетельствовал как о наличии существенных межкластерных отличий, так и отличий каждого кластера от показателей контрольной группы, которые представлены в табл. 1.
Таблица 1
Параметры признаков, определяющих кластерную принадлежность пациентов
|
Признак* |
Кластер 1 n = 13 |
Кластер 2 n = 18 |
Кластер 3 n = 11 |
Кластер 4 n = 3 |
Контроль n = 26 |
|
Возраст, годы |
19,4±11,4 |
26,2±18,1 |
19,6±12,7 |
13,2±10,3 |
24,8±14,8 |
|
Pb волосы |
0,51** [0,31; 0,69] |
0,48 [0,34; 0,56] |
0,57 [0,32; 0,98] |
2,36 [0,23; 2,7] |
0,15 [0,08; 0,4] |
|
Bi волосы |
0,1 [0,03; 0,21] |
0,18 [0,06; 0,31] |
0,29 [0,17; 0,6] |
0,26 [0,097; 0,42] |
0,16 [1,00; 0,48] |
|
Cd волосы |
0,06 [0,03; 0,09] |
0,05 [0,02; 0,09] |
0,023 [0,01; 0,05] |
0,015 [0,02; 0,06] |
0,025 [0,005; 0,09] |
|
Ni волосы |
0,76** [0,51; 0,93] |
0,76** [0,62; 0,83] |
1,02** [0,74; 1,23] |
0,62 [0,53; 0,68] |
0,125 [0,021; 0,61] |
|
Co волосы |
0,17** [0,15; 0,29] |
0,22** [0,11; 0,32] |
0,21** [0,097; 0,29] |
0,03 [0,022; 0,26] |
0,08 [0,012; 0,22] |
|
Cu волосы |
7,25 [5,0; 7,89] |
9,0 [7,38; 11,2] |
7,13 [6,19; 13,7] |
12,01 [5,4; 19,3] |
5,07 [2,63; 11,1] |
|
Fe волосы |
25,41** [25,4; 41,3] |
29,5** [21,1; 39,0] |
45,02** [36,2; 68,4] |
154,7** [152,9; 157,6] |
3,2 [0,08; 14,3] |
|
Mn волосы |
1,55 [1,4; 1,6] |
1,6 [1,22; 1,86] |
1,67 [1,04; 1,87] |
1,5 [1,4; 2,25] |
1,55 [0,9; 12,7] |
|
Cr волосы |
1,62** [1,26; 1,8] |
1,62** [1,28; 1,82] |
1,2** [0,71; 2,16] |
1,85** [1,64; 2,45] |
0,37 [0,03; 0,76] |
|
Sr волосы |
1,32 [0,59; 1,9] |
0,9 [0,61; 1,32] |
3,37** [0,84; 3,93] |
2,01 [1,67; 3,23] |
0,56 [0,17; 0,86] |
|
Zn волосы |
67,82 [57,3; 72,7] |
69,3 [66,6; 81,6] |
46,5** [42,0; 67,5] |
41,5** [22,97; 49,3] |
71,39 [64,9; 103,0] |
|
Pb кровь |
0,07** [0,03; 0,15] |
0,09** [0,06; 0,13] |
0,04** [0,007; 0,08] |
0,013** [0,003; 0,035] |
0,23 [0,18; 0,32] |
|
Bi кровь |
0,027 [0,01; 0,064] |
0,04** [0,02; 0,06] |
0,017** [0,008; 0,04] |
0,003** [0,0004; 0,014] |
0,07 [0,04; 0,13] |
|
Cd кровь |
0,004 [0,003; 0,006] |
0,005 [0,002; 0,007] |
0,001** [0,0004; 0,001] |
0,0008 [0,0004; 0,002] |
0,002 [0,002; 0,008] |
|
Ni кровь |
0,096 [0,06; 0,12] |
0,096 [0,064; 0,12] |
0,135 [0,06; 0,155] |
0,28 [0,007; 0,37] |
0,068 [0,07; 0,082] |
|
Co кровь |
0,036 [0,009; 0,08] |
0,04 [0,01; 0,07] |
0,022 [0,01; 0,03] |
0,01 [0,006; 0,013] |
0,026 [0,02; 0,04] |
|
Cu кровь |
0,92 [0,66; 1,2] |
1,09 [0,66; 1,44] |
0,25** [0,14; 0,38] |
0,199** [0,13; 0,2] |
0,78 [0,49; 0,94] |
|
Fe кровь |
147,6** [136,3; 168,5] |
85,9 [78,5; 95,1] |
31,9** [24,1; 38,3] |
23,2** [23,14; 49,9] |
111,5 [68,4; 134,3] |
|
Mn кровь |
0,23** [0,19; 0,28] |
0,25** [0,2; 0,26] |
0,14 [0,09; 0,21] |
0,098* [0,65; 0,12] |
0,19 [0,16; 0,19] |
|
Cr кровь |
0,12 [0,06; 0,22] |
0,13 [0,09; 0,21] |
0,017** [0,003; 0,04 ] |
0,017 [0,013; 0,12] |
0,05 [0,04; 0,09] |
|
Sr кровь |
0,5 [0,42; 0,67] |
0,42 [0,14; 0,64] |
0,19** [0,15; 0,25] |
0,18** [0,16; 0,21] |
0,59 [0,49; 0,8] |
|
Zn кровь |
3,04 [1,93; 4,23] |
2,05** [1,8; 2,65] |
2,3 [1,77; 2,7] |
2,99 [2,28; 3,28] |
2,73 [2,16; 3,15] |
Примечание. * – значения микроэлементов в волосах выражены в мкг/г, в крови – в мг/л. ** – статистическая значимость различий с контрольной группой при уровне р < 0,05.
Специфичность микроэлементного статуса кластеров была обусловлена, в основном, содержанием железа в волосах и железа, меди и марганца в крови, по которым определялись максимальные межкластерные различия. Кроме того, отличия между кластерами формировались и при участии ряда других микроэлементов. Так, 1 и 2 кластеры характеризовались относительно высокими уровнями кадмия, меди, железа, марганца и хрома в крови. При этом у пациентов 1 кластера отмечены более высокие показатели железа (р < 0,001) и цинка (p = 0,04) в крови по сравнению с кластером 2. В 3 и 4 кластерах при наличии низких показателей цинка в волосах и кадмия, меди, железа, марганца, хрома и стронция в крови, имелись отличия только по содержанию железа в волосах (р = 0,01), уровень которого был выше у пациентов кластера 4. Если описанные выше 1 и 2 кластеры и 3 и 4 кластеры имели ряд общих характеристик, то кластеры 2 и 4, кластеры 1 и 3 и кластеры 1 и 4 отличались друг от друга по широкому спектру микроэлементов. Например, во 2 кластере по сравнению с 4 кластером были зарегистрированы низкие уровни железа (р = 0,007) и стронция (р = 0,02) в волосах и высокие показатели содержания цинка в волосах (р = 0,02) и свинца (р = 0,04), висмута (р = 0,02), меди (р = 0,008), железа (р = 0,008) и марганца (р = 0,007) в крови. Кластер 3 отличался от кластера 1 высокими уровнями никеля (р = 0,04), железа (р = 0,02) и стронция (р = 0,04) в волосах и низкими концентрациями цинка в волосах (р = 0,02) и кадмия (р = 0,006), меди (р = 0,0002), железа (р = 0,00003), марганца (р = 0,02), хрома (р = 0,002) и стронция (р = 0,003) в крови. В кластере 1 по сравнению с кластером 4 имелись низкие значения железа (р = 0,01) в волосах и повышенные уровни цинка (р = 0,01) в волосах и кадмия (р = 0,04), меди (р = 0,01), железа (р = 0,01), марганца (р = 0,02) и стронция (р = 0,03) в крови. Интересно, что 1 и 4 кластеры имели противоположные характеристики по содержанию железа в биосредах. Если особенность 1 кластера в отличие от всех других заключалась в минимальном содержании железа в волосах при максимальной его концентрации в крови, то для 4 кластера характерным являлся максимальный уровень железа в волосах и минимальный в крови. Описанная разнонаправленность накопления железа в биосредах определяет специфичность 1 и 4 кластеров. Межкластерных различий в содержании свинца, висмута, кадмия, кобальта, меди, марганца и хрома в волосах не было отмечено, как не было статистически значимых различий в концентрации кобальта и никеля в крови.
Оценка информативности каждого из изучаемых признаков и построение модели, которая позволит относить пациентов, страдающих гнездной алопецией, к тому или иному кластеру была выполнена с помощью метода классифицирующих деревьев. При воспроизведении этого метода было построено дерево, которое позволяет по значениям признаков, включенных в модель (дерево), установить к какому кластеру относятся пациенты (см. рисунок).
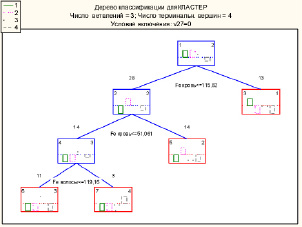
Классифицирующее дерево для определения кластерной принадлежности пациентов с гнездной алопецией на основе показателей микроэлементного обмена
Подставляя значения уровней микроэлементов, входящих в модель (т.е. показатели уровней железа в крови и волосах пациента), и двигаясь по дереву в соответствии с правилом [1], определяется терминальный узел, в котором указан номер кластера. Найденное классифицирующее дерево имеет то достоинство, что оно наглядно показывает как признаки, сформировавшие модель, дают окончательный результат в виде прогноза – кластера, к которому относится конкретный пациент. Практический интерес представляет то, что в построении модели приняли участие лишь два признака, по которым можно определить кластерную принадлежность пациента, несмотря на использование в исследовании широкого спектра микроэлементов двух биосубстратов. Неотъемлемым этапом применения метода классифицирующих деревьев является проверка качества построенной модели. Предпринятая нами оценка качества модели показала, то представленная модель прогнозирует кластерную принадлежность пациентов обучающей и всей выборочной совокупности со стопроцентным качеством.
Для многих задач более важным вопросом является не построение классифицирующего дерева, а вопрос значимости какого-либо признака в формировании изучаемого явления. При анализе ранговой значимости показателей возраста и микроэлементного состава крови и волос, установлено, что наиболее значимыми предикторами, характеризующими гнездную алопецию, являются уровни железа, меди, крови и уровень железа в образцах волос пациентов. Наименее значимыми признаками явились уровни меди, кобальта, свинца и висмута в волосах, имеющие самые низкие ранговые значения. При сопоставлении данных о ранговой значимости признаков, участвующих в построении классифицирующего дерева, и самой модели, становится очевидным, что ведущим предиктором, определяющим межкластерные различия пациентов, является уровень железа в крови и волосах. Данные об информационной значимости признаков, на основе которых строилось классифицирующее дерево, представлены в табл. 2.
Таблица 2
Показатели информационной значимости признаков, на основе которых строилось классифицирующее дерево
|
Предикторы |
Ранги |
Предикторы |
Ранги |
Предикторы |
Ранги |
Предикторы |
Ранги |
|
Fe крови |
100 |
Mn кровь |
36 |
Cr волосы |
24 |
Mn волосы |
20 |
|
Cu крови |
69 |
Cd кровь |
33 |
Bi кровь |
23 |
Cu волосы |
19 |
|
Fe волосы |
43 |
Ni волосы |
30 |
Cd волосы |
23 |
Co волосы |
17 |
|
Zn волосы |
42 |
Sr кровь |
29 |
Zn кровь |
23 |
Pb волосы |
8 |
|
Sr волосы |
41 |
Ni кровь |
28 |
Возраст |
21 |
Bi волосы |
8 |
|
Cr кровь |
36 |
Pb кровь |
25 |
Co кровь |
21 |
– |
– |
Заключение
Применение методов многомерного анализа при исследовании микроэлементного обмена пациентов с гнездной алопецией позволило выявить гетерогенность исследуемой выборки больных на основании особенностей микроэлементного статуса. Выявленная специфика каждого из кластеров является теоретической основой индивидуального подхода к коррекции выявленных нарушений микроэлементного обмена у пациентов. Предложенная прогностическая модель позволяет отнести пациента к одной из групп, характеризующейся своеобразием обмена микроэлементов, используя лишь два показателя – уровень железа в крови и в образцах волос. Это представляет практический интерес для оптимизации стандартов оказания медицинской помощи пациентам с гнездной алопецией.

