Актуальность. По данным ВОЗ в мире насчитывается 1,5 млн слепых детей и 314 млн взрослых людей, имеющих различные нарушения зрения из-за глазных заболеваний. Из них 45 млн человек являются практически слепыми. В России, как и во всем мире, сохраняется тенденция к росту количества офтальмологических заболеваний и инвалидности вследствие патологии органа зрения. При этом в России слепота и слабовидение отмечаются у 19 из 10 тысяч человек. Самой распространенной причиной необратимой слепоты в нашей стране является ВМД [6]. Во всем мире она диагностируется у 150 млн человек, кроме того, около 50 % европейцев в возрасте старше 65 лет имеют признаки этого заболевания [2]. Согласно результатам эпидемиологических исследований, возрастная макулярная дегенерация (ВМД) является ведущей причиной слепоты и слабовидения у лиц старшей возрастной группы [1, 17]. Более 90 % случаев слепоты от ВМД связано с развитием так называемой «влажной» или экссудативной формы заболевания [14]. Экссудативная форма ВМД характеризуется аномальным, патологическим ростом новообразованных сосудов, которые, беря начало из слоя хориокапилляров сосудистой оболочки, прорастают через дефекты мембраны Бруха под пигментный эпителий сетчатки и/или нейроэпителий [18]. Тем не менее, анализ доступной литературы по структуре органа зрения человека за 2010–2013 годы показал практическое отсутствие морфологических данных на фоне публикаций многочисленных результатов физиологических и молекулярно-генетических исследований глаза [1, 3]. Проблема неоваскуляризации при ВМД и диабетической ретинопатии могла бы быть решена с помощью изучения механизмов физиологической регенерации ключевых структур сосудистой оболочки, определения источников развития её структур, получения полного представления о механизмах васкуляризации и меланогенеза в сосудах и строме хориоидеи в онтогенезе человека, т.к. репаративные процессы в основе своих механизмов имеют те же ключевые звенья, что и при физиологической регенерации [4, 7]. Всё это определяет уровень актуальности выполненного исследования.
Целью нашего исследования является изучение закономерностей развития сосудистой оболочки глаза человека.
Задачами исследования послужили установление алгоритма процессов закладки, развития и функционального созревания сосудистой оболочки глаза человека, выявление механизмов её развития и мониторинг меланогенеза в структурах хориоидеи.
Материалы и методы исследования
Изучены 171 глаз эмбрионов и плодов человека. Использованы классические гистологические методы исследования с окрашиванием г/э; Victoria blue и импрегнация серебром, а также иммуногистохимические методы на выявление NADFH-диафоразы, CD4, CD8, CD 68, CD163, CD 204, TUNEL-метод на выявление апоптозирующих клеток, Ki67 для выявления пролиферативной активности, Iron hematoxilin. Анализ материала проведён с помощью микроскопа Olympus – Bx51 и цифровой камеры CD25 с фирменным программным обеспечением.
Результаты исследования и их обсуждение
Нами установлено, что в эмбриональный период сосудистая оболочка представляет собой общий с наружной соединительно-тканной оболочкой мезенхимный зачаток как на переднем полюсе, так и на заднем (рис. 1, а–в). Сосудистая оболочка и фиброзная на переднем полюсе и на заднем представлены мезенхимной тканью из звёздчатых клеток, образующих сеть с ячейками, по которым диффузно осуществляется трофическое обеспечение структур глаза человека. В плодный период, начиная с 10 недели, реализуется обособление сосудистой оболочки и её структуризация, формирование особенностей на переднем, заднем полюсе и в зоне прилегания к хрусталику. К 11 неделе пренатального онтогенеза идентифицируются радужка, цилиарное тело в виде петель из пигментных клеток и собственно сосудистая оболочка заднего полюса глаза, в которой появляются многочисленные клетки с выраженной базофилией, придающие хориоидее более яркий цвет при окрашивании гематоксилин-эозином.
Начиная с 12 недели слабо развитая сосудистая оболочка плотно прилегает к склере, цилиарное тело (ЦТ) и радужка (Р) представляют собой листки пигментного эпителия, образующие полости, мышечных волокон практически нет, цилиарное тело формирует длинные и тонкие отростки (рис. 2).

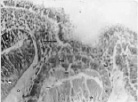

а) б) в)
Рис. 1. Структуры средней оболочки глаза человека в до сосудистый период развития: а, б, в – эмбриональный период Окраска импрегнация серебром. Микрофото. Ув. х400
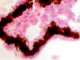
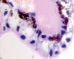
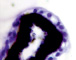
а) б) в) г) д)


е) ё) ж) з)
Рис. 2. Цилиарное тело глаза плода человека: а) глаз плода 12 недель пренатального периода развития; б) ЦТ плода 14 недель; в) плод 16 недель; г,д) – 18 недель; окраска гематоксилин-эозином. е-з) – окраска иммунная гистохимия на выявление CD68. Микрофото. Ув. е-ж х 400; з-200
Беспигментный эпителий отростков цилиарного тела в первую половину плодного периода не окрашивается гематоксилин-эозином, как и клетки Мюллеровской глии в сетчатке, стекловидном теле и собственном веществе роговицы (рис. 2, а, б, в). С 14-й недели плодного периода покрывающий отростки цилиарного тела беспигментный эпителий окрашивается гематоксилин-эозином (рис. 2, г, д). Это служит косвенным подтверждением происхождения беспигментного эпителия из радиальных глиоцитов в результате миграции астроцитарной нейроглии из нейральной сетчатки глазного бокала в дососудистый период, которая также проявляет хромофобные свойства при окрашивании красителями. Как только процесс дифференцировки заканчивается, беспигментный эпителий приобретает свойства клеток с другой специализацией, клетки становятся хромофильными. Дополнительное подтверждение происхождения пула беспигментных эпителиоцитов к нейроглии получено с помощью иммунной гистохимии при взаимодействии эпителия с маркёрами на белок S100 (рис. 3). При этом нами отмечено, что сначала появляется пигментный эпителий, а затем беспигментный (рис. 3, а). В строме цилиарного тела идентифицируются иммуноциты CD68, что свидетельствует, что в перестройке структуры и процессах васкуляризации стромы хориоидеи в целом принимают активное участие антигенпрезентирующие иммуноциты (АПК).
На 14–15 неделе пренатального развития сначала в собственно хориоидее, а затем последовательно в цилиарном теле и в радужке начинает формироваться хориоидальная сосудистая система. Ангиогенез протекает в классическом варианте:
1. Появление сосудистых лакун на месте кровяных островков (рис. 4, а, б);
2. Образование синусоидных капилляров (рис. 4, в, г);
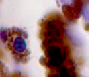
3. Период наступления функциональной зрелости хориоидальных сосудов, которая проявляется появлением всех структурных элементов, типичных для стенки артерий и вен – плоского эндотелия, эластических волокон и перицитов (рис. 4, д, е, ё);
4) дифференцировка сосудистого бассейна с образованием артериол и венул;
5) окончательное формирование хориоидального сосудистого бассейна (рис. 4, з).
Формирование сосуда в строме развивающейся сосудистой оболочки сопровождаются утратой внутренними клетками ангиогенного островка контактов на периферии островка. Происходит уплощение клеток с высоких призматических до плоских на периферии островка. Уплощение клеток соответствует началу гистогенеза мембраны на люминальной поверхности стенки формирующегося сосуда. Люминальная мембрана характеризуется прерывистостью, на светооптическом уровне идентифицируется, как однослойная. Часть внутренних клеток островка контактирует с люминальной мембраной. Также в этот период идентифицируются лейкоциты в просвете сосудов хориоидеи глаза плода человека 32 недели плодного периода пренатального онтогенеза. Появляются слабо пигментированные меланоциты в строме хориоидеи. Стенка сосуда в этот период лишена пигментоцитов. На люминальной поверхности кровеносного сосуда хориоидеи методом Victoria Blue на выявление эластических волокон идентифицируется мощный каркас в стенке сосуда. Это может быть связано с особыми физиологическими тканевыми запросами формирующихся структур и условиями функционирования.

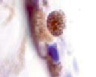

а) б) в) г)
Рис. 3. а, б, в, г. Пигментный и беспигментный эпителий цилиарного тела глаза плода человека. Иммунная гистохимия на выявление белка S100. Микрофото. Ув.х800

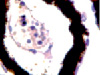

а) б) в) г)


д) е) ё) ж)

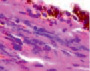
з) и) й) к)
Рис. 4. Кровеносные сосуды сосудистой оболочки глаза человека второй половины плодного периода пренатального онтогенеза. Окраска а, б, в, г, д, ё, ж, з – гематоксилин-эозином; е, и, й, к – Victoria blue. Микрофото. Ув.х400
Хориоидея глаза плода человека с 16 недели не только васкуляризуется, но и приобретает пигмент, сначала вокруг кровеносных сосудов, а затем в строме оболочки количество пигмента увеличивается (рис. 5, а–ё).
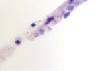
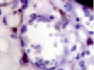
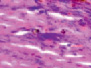
В наших исследованиях во всех растущих капиллярах почки роста имели макрофаги, которые также идентифицировались и вокруг более крупных сосудов (рис. 5, з, и). Анализ исследуемого материала с помощью иммуногистохимических методов показал, что иммунофагоциты представлены фенотипами CD163 (рис. 5, й, к).
Наличие макрофагов CD163 в структурах сосудистой оболочки свидетельствует о том, что они принимают активное участие не только в васкуляризации, но и в меланогенезе сосудов и стромы хориоидальных структур, т.к. по имеющимся литературным данным, именно макрофаги стимулируют ангиогенез, секретируя фактор роста эндотелия, а также выделяют цитокины, индуцирующие меланогенез.
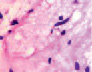
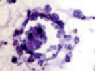
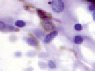
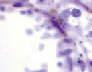
а) б) в) г)
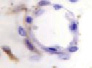
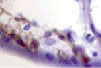

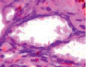
д) е) ё) ж)

з) и) й) к)
Рис. 5. Сосуды глаза человека в разные сроки пренатального периода. Окраска гематоксилин-эозином. А, е, ё, ж, к – иммунная гистохимия на выявление CD163 б, в, г, д. Микрофото. Ув.х 600
Следует отметить, что в наших исследованиях приоритет в развитии хориоидеи получают те структуры, которые в дальнейшем являются непреодолимым препятствием для разрастающихся сосудов. Мы считаем, что мембрана Бруха, пигментные эпителиоциты наружного листка глазного бокала являются мощными ингибиторами прорастания сосудов в фоторецепторный слой. Морфологическая характеристика структуры фибробластов даёт основания предполагать, что они имеют отношение по своему происхождению к нейроглиальным мигрантам из внутреннего листка глазного бокала (рис. 6, а, б). Это очень важный факт, который может способствовать разработке терапевтических методов лечения макулодистрофии, т.к. терапию ингибирования ангиогенеза при ВМД необходимо разрабатывать не с учётом мезенхимных фибробластов, а искать ключ к лечению на основе знания свойств клеток предшественников нейроглии. Калибр сосудов от мелких до крупных размеров, поэтому наши данные противоречат некоторым данным об отсутствии отличий диаметра сосудов в разных слоях сетчатки.
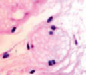
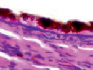
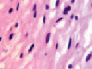
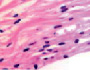
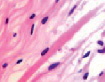
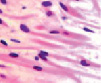
У плода 19–20 недель идентифицируются мышцы (рис. 6), расширяющие и суживающие зрачок (сфинктер и дилататор). При этом нами отмечено, что часть мышц морфологически идентична гладкомышечным клеткам, а часть, не смотря на форму гладкомышечных клеток, имеет ярко выраженную поперечную исчерченность и периферическое расположение ядра. Утолщается строма радужки и цилиарного тела. Появляется щелевидное пространство между склерой и сосудистой оболочкой (рис. 6, в, г, д, е, ё).
Также нами получены доказательства, что различные отделы сосудистой оболочки развиваются не одновременно на всём протяжении. В тот период, когда сосуды хориоидеи уже идентифицируются, в её участках, соответствующих височному и назальному секторам, кровеносные сосуды отсутствуют (рис. 7, а и б).
В периоде формирования сосудистого бассейна в хориоидее в просвете кровеносных сосудов выявляются эритроциты, часть из которых имеет ядра. С 14 недели в крови, кроме безъядерных эритроцитов обнаруживаются веретеновидные, овальные и круглые лейкоциты, причём в некоторых можно наблюдать пролиферативную активность. Иммуногистохимический анализ показал, что в крови сосудистой системы плода преобладают лейкоциты с фенотипом CD163. Этот факт позволяет сделать предположение о том, что на данном этапе перестройка ткани сосудистой оболочки нуждается в большей степени в антиген презентирующих клетках (CD68) и макрофагах (CD163), участвующих в физиологической регенерации системы кровоснабжения сосудистой оболочки глаза плода человека. По нашему мнению, роль макрофагов должна заключаться не только в секреции факторов роста эндотелия, но и в утилизации клеток, вступивших в апоптоз. Ещё одной потенциальной функцией может быть создание микрокружения для прогениторных стволовых нейроглиальных клеток, стимулирующее их дифференцировку и специализацию в нужном направлении.

а) б) в) г)

д) е) ё)
Рис. 6. Мышцы сосудистой оболочки. Окраска гематоксилин-эозином. Микрофото. Ув. х 400
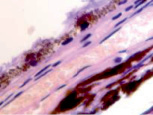
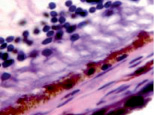
а) б)
Рис. 7. Хориоидея глаза плода человека 16 недель. Окраска гематоксилин-эозином. Микрофото. Ув. х 400
Заключение
Таким образом, источником развития сосудистой оболочки глаза служит не только нейромезенхима, окружающая глазной бокал, по нашим данным с 6 недели в зачаток сосудистой оболочки происходит миграция нейроглиальных клеток, являющихся стволовыми прекурсорными клетками для структур хориоидеи. В наших результатах новым является установление дополнительного источника развития сосудистой оболочки, в отличие от данных других авторов [12]. Ангиогенез характеризуется подобной для других структур морфологической картиной развития сосудов [5]. Закономерности васкулогенеза укладываются в рамках классической концепции развития сосудистого бассейна Куприянова В.В. (1998). Последовательно происходит образование кровяных островков из мезенхимных клеток, уплощение и дифференцировка нейромезенхимоцитов в эндотелиоциты капилляров [5]. Роль антигенпрезентирующих и фагоцитирующих иммуноцитов в апоптозе структур, являющихся временными в развитии хориоидеи глаза человека, выполняют иммуноциты CD68 и CD163, что отмечали и другие авторы [4, 15]. Установлено, что в развитии сосудистой системы участвуют митотически делящиеся эндотелиальные клетки, являющиеся местными камбиальными, расположенные непосредственно в стенке растущих капилляров, а формирование стромы радужки, хориоидеи и цилиарного тела происходит за счёт клеток – мигрантов из внутренней стенки глазного бокала. Вопросы механизмов индукции и ингибирования хориокапилляров во многом противоречивы, на современном этапе они являются предметом многочисленных исследований [9–11]. Эмбриональные механизмы ангиогенеза могут проявиться при патологических процессах, развивающихся в глазу, поэтому требуют дальнейшего глубокого изучения [2, 17]. Клинические доказательства о потенциальной перспективности применения современных препаратов в лечении глазной патологии требуют дальнейших исследований. Открытие Рева Г.В. (2011) участия прогениторных нейроглиальных клеток – мигрантов из внутренней стенки глазного бокала в развитии структур прозрачных сред глаза человека, привело к изменению концепций структуры не только хрусталика, стекловидного тела, роговицы, но и концепции развития мембраны Бруха, которую многие авторы считают более ранней, по сравнению с сосудистой, развивающейся структурой [12]. В наших исследованиях, мембрана Бруха формируется раньше других структур хориоидеи, имеет ярко выраженное клеточное строение. Уплощаясь, клетки приобретают веретеновидную форму, длинные отростки, контактирующие между собой. Как и прозрачные среды глаза, мембрана Бруха обладает свойствами барьера для неоваскуляризации и служит препятствием для прорастания сосудов из хориоидеи в фоторецепторный слой сетчатки.
Механизмы ангиогенеза рассматривались многими авторами [8, 13, 16], но так и не был решён вопрос о распределении индукторов и ингибиторов ангиогенеза в хориоидее. Часть авторов имеет данные о том, что пигментный эпителий имеет специфическое распределение ингибиторов на базальной поверхности и на основании этого был сделан вывод о том, что именно пигментные эпителиоциты вырабатывают вещества, подавляющие ангиогенез. Учитывая роль мембраны Бруха, можно сделать вывод о том, что клетки пигментного эпителия получают путём диффузии его от структур, прилежащих к пигментоцитам. Наличие в почках роста капилляров макрофагов, фенотипированных как CD68, сделан вывод о том, что главным поставщиком фактора роста эндотелия в хориоидее являются макрофаги, что не противоречит имеющимся данным о том, что при неоваскуляризации хориоидеи при патологии, макрофаги и пигментный эпителий экспрессируют ангиогенные цитокины [7].
Меланизирующиеся клетки в строме и стенке сосудов имеют контакты с макрофагами фенотипов CD68 и CD163, что позволяет сделать вывод о роли макрофагов АПК и моноцитарных в хориоидальном меланогенезе. Меланогенез стромальных пигментоцитов предшествует этим процессам у меланоцитов сосудистой стенки, что подтверждает раннее заселение меланобластами стромы сосудистой оболочки, дифференцировку и специализацию.
Выводы
1. Хориоидея человека развивается на 8 неделе эмбриогенеза. В её развитии принимают участие 2 источника: нейромезенхимный и нейроглиальный. Стволовые прекурсорные клетки нейроглиальной природы занимают положение в передней части сосудистой оболочки и служат источником мембраны Бруха. Из нейромезенхимы формируется строма сосудистой оболочки.
2. Васкуляризация происходит с 10 по 14 неделю. Усложнение структур сосудистой стенки идентифицируется с 18 недели, появляются перициты и эластический каркас.
3. Мембрана Бруха и беспигментный эпителий имеют морфологические и фенотипические признаки нейроглиальных мигрантов из внутреннего листка глазного бокала.
4. Мембрана Бруха формируется раньше кровеносных сосудов хориоидеи, т.к. функционально определяет вектор роста сосудов и препятствует прорастанию капилляров в фоторецепторный слой сетчатки глаза человека.
5. Мышцы радужки и цилиарного тела идентифицируются с 20 недель плодного периода пренатального онтогенеза. Миоциты представлены 2-мя типами клеток, гладкими и с поперечной исчерченностью.
6. Макрофаги, идентифицируемые в почках роста сосудов в ранний период формирования сосудистого бассейна хориоидеи, являются индукторами для пролиферации эндотелия и имеют фенотип СD68, что говорит об их антигенпрезентирующих свойствах.
7. Эластический каркас сосудов хориоидального бассейна глаза человека хорошо выражен с 18 недели. Это может обусловливать защитную функцию сосудистой стенки при обеспечении компенсаторно-приспособительных реакций при изменении кровяного давления в сосудах мозга и сохранности зрительных функций в неблагоприятных условиях повышенного давления.
8. ВМД – это проблема не ангиогенеза, в основе этой патологии, по нашему мнению, лежит системное нарушение физиологической регенерации нейроглии, а также её производных – каковой и является мембрана Бруха, в норме тормозящая прорастание сосудов в ФРК.
Работа выполнена при поддержке Научного Фонда ДВФУ и Международного гранта ДВФУ (соглашение № 13-09-0602-м_а от «6» ноября 2013 г.

