Известно, что гибернирующие животные проявляют уникальные адаптивные способности к неблагоприятным факторам среды (гипотермия, радиация, окислительный стресс). Во время зимовки у животных и птиц глубоко подавляется метаболизм, вследствие чего снижается температура тела, частота сердечных сокращений, замедляются другие функции [1, 2, 4]. Рыбы, которые способны адаптироваться к разным температурным условиям обитания, являются также интересным научным объектом. Например, ротан Percсottus glehni – представитель пойкилотермных гидробионтов – населяет пруды и мелкие озера, в которых вода промерзает зимой до дна, он отличается устойчивостью к различным воздействиям, низкой оксифильностью и не требует специальных условий для содержания. Основным регулирующим звеном в перестройке организма при разных адаптациях, в том числе и при длительных холодовых воздействиях, является центральная нервная система [1, 2]. Поэтому при изучении механизмов гибернации очень важно проследить за структурными изменениями в нейронах. Цель работы – исследование пластических изменений в центральных нейронах пресноводных рыб Percсottus glehni при формировании гипометаболического состоянии с использованием метода трехмерной реконструкции нейронов и ультраструктурного анализа [3, 5, 6].
Объектами исследования были маутнеровские нейроны (МН), парные симметрично расположенные в правой и левой части продолговатого мозга нервные клетки, присутствующие почти у всех костистых рыб и амфибий. МН получают окончания от разных анализаторов через многочисленные афферентные входы. Основными являются статоакустический вход и опосредованный через тектум зрительный вход [3, 9, 10]. Примечательно что, афферентные входы от этих важнейших анализаторов, оканчивающихся на МН, морфологически разделены. Слуховой вход покрывает в виде смешанных синапсов дистальную часть латерального дендрита (ЛД), вестибулярный – в виде химических синапсов всю поверхность ЛД, а также сомы. Зрительный вход [3, 10] располагается исключительно на поверхности вентрального дендрита (ВД). Аксоны нейронов иннервируют мускулатуру хвостового плавника. Каждый МН у рыб является своеобразным командным центром, управляющим специфическим поведением животных («реакция страха» [9, 10].
Наличие четкой корреляции между уровнем двигательной активности рыб и морфологическими характеристиками их МН позволяет использовать эти уникальные клетки в качестве модели для изучения взаимосвязи структуры и функции нейронов при различных состояниях организма [5, 6, 7].
Материалы и методы исследования
В работе использовали пресноводную рыбу ротан Percсottus glеhni из озера Тульчино Московской области. Половозрелых животных длиной 8-12 см и массой около 200 г, делили на группы: первая (n = 6) – контроль, активное состояние, (июль); вторая (n = 6) – период зимнего оцепенения (конец декабря). Все эксперименты проводили в соответствии с общепринятыми биоэтическими нормами. Рыб контрольной группы, выловленных летом, сразу брали в эксперимент. Рыб опытной группы, выловленных в начале зимы, хранили до конца декабря в 5-литровых сосудах в холодильной камере с температурой 1 °С (± 1 °С). На 2-3-и сутки вода в сосудах частично замерзала, что соответствовало состоянию рыб в природе в процессе зимовки: ротаны содержались в пресной холодной воде, темноте, тишине, без пищи и с ограниченным доступом кислорода, т. е. в условиях, максимально приближенных к естественным. В день эксперимента рыб доставали из воды и декапитировали на льду. Под бинокулярной лупой выделяли фрагмент продолговатого мозга, содержащий МН. Фиксировали 12 ч в 4 %-м растворе формальдегида и 2,5 %-м растворе глутаральдегида на 0,1 М какодилатном буфере (рН 7,2). Дофиксировали в 2 %-м растворе четырехокиси осмия, обезвоживали и заключали в эпоксидную смолу по стандартной методике [5, 6]. Для получения серии последовательных срезов толщиной 5 мкм эпоновые блоки резали на пирамитоме («LKB», Швеция). Гистологические срезы, содержащие сому, латеральный (ЛД) и вентральный (ВД) дендриты последовательно фотографировали при 250 под микроскопом «NU 2E» («Carl Zeiss», Германия), снабженным цифровой фотокамерой «Nikon D 5100» («Seiko», Япония). Каждый срез фотографировали по частям. Трехмерные изображения объектов выполняли с помощью программы «IGL Trace» (Dr. J. Fiala, США), количественные данные получали с помощью программы «3D View 3.5» («Actify, Inc.», США). Отдельно вычисляли объем сомы, ЛД и ВД, а также суммарный объем каждого нейрона [5, 9, 11]. Для сравнения данных применяли непараметрический критерий Манна-Уитни (U-критерий). Для ультраструктурного анализа гистологические срезы, содержащие соответствующие части МН, переклеивали на отдельные эпоновые блоки и резали ультратонко на ультратоме ЕМ UC6 (Leika, ФРГ). Окрашивали полученные ультратонкие срезы уранилацетатом и цитратом свинца просматривали в электронном микроскопе Tesla BS-500 (Чехословакия). Съемку вели на фотопленку, негативы анализировали после оцифровки с помощью сканера Epson Perfection 4990 Photo (Seiko, Япония).
Результаты исследования и их обсуждение
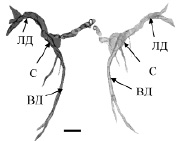
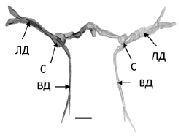
На гистологических препаратов мозга контрольных рыб (лето, июль) МН идентифицировались как две симметрично расположенные гигантские клетки с типичным строением: сома и два основных дендрита – латеральный и вентральный. Структурная организация МН, трехмерно реконструированных по серийным гистологическим срезам в разные периоды наблюдения, представлена на рис. 1. Измерения показали, что суммарный объем всех компонентов нейрона (сомы, ВД и ЛД) в контрольной группе рыб (рис. 1, а) в среднем составлял 231,3 ± 53,1х103мкм3.
При анализе структуры МН рыб, находящихся в состоянии оцепенения (зима, декабрь) были выявлены существенные изменения (рис. 1, б). Было обнаружено уменьшение их суммарных объемов до 157 ± 58,1х103мкм3 (p 0,05), причем в основном трансформировались дендриты, они истончались и укорачивались, а соматическая часть нейронов не претерпевала выраженных изменений (рис. 1, б). Примечательно, что редукция обоих основных дендритов была не пропорциональной, ВД сокращался значительно, более чем на 60 % (p 0,05), а ЛД в меньшей степени на 45 % (p 0,05).
Изучение МН контрольных рыб на ультраструктурном уровне показало, что синаптические окончания нервных волокон, приходящих от зрительного анализатора и контактирующих с ВД нейронов имеют обычный вид, синаптические пузырьки светлые, округлые, на срезе почти всех синапсов встречаются 1-2 митохондрии, иногда обнаруживаются гранулы гликогена (рис. 2, а). На ЛД, принимающих информацию от акустического и вестибулярного анализаторов, синаптические окончания также имеют обычную ультраструктуру (рис. 2, б). Цитоскелет всех дендритов умеренно рыхлый; гладкий эндоплазматический ретикулум (ГЭР) представлен в виде цистерн и канальцев, имеющих продольное и поперечное направление. В контрольных препаратах не наблюдается никаких видимых различий в плотности цитоскелета обоих дендритов, а также в структуре ГЭР.
а) б)
Рис. 1. Трехмерная реконструкция МН рыб в разные сезонные периоды: а – летний период, июль; б – зимовка, декабрь. ЛД, ВД – латеральный, вентральный дендриты, С – сома. Масштабный отрезок: 100 мкм

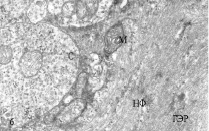
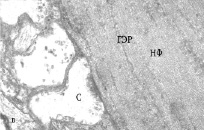
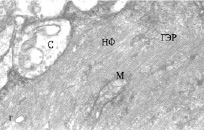
Рис. 2. Электронно-микроскопическое изучение. Ультраструктура дендритов МН с синапсами: а, б – ВД и ЛД интактных рыб, в, г – ВД и ЛД зимующих рыб; ГЭР – гладкий эндоплазматический ретикулум; М – митохондрия; С – синапс, НФ – нейрофиламенты
Изучение ультраструктуры МН зимних ротанов выявило существенные отличия, особенно заметные в отношении ВД (рис. 2, в). На всей поверхности этих дендритов обнаруживаются многочисленные запустевшие синаптические окончания, с небольшим количеством синаптических пузырьков или вовсе лишенные таковых. Структура митохондрий в запустевших бутонах выглядит поврежденной, они теряют часть крист, их матрикс просветляется. Специализированные контакты – активные зоны и десмосомоподобные контакты в таких синапсах часто не идентифицируются, хотя изредка встречаются синапсы, сохранившие свою обычную ультраструктуру. Вероятно, в период зимнего оцепенения происходит частичная разборка постсинаптических уплотнений и перераспределение рецепторных белков в мембране, аналогично тому, что обнаружено на нейронах гибернирующих сусликов [1, 8]. В цитоплазме проксимальных отделов ВД увеличивается количествово лизосом и миелиновых фигур, сама дендроплазма уплотняется, приобретает осмиофильный вид, ее объем уменьшается. Нейрофиламенты цитоскелета приобретают более упорядоченную структуру, расстояния между ними уменьшается. Структура ретикулума редуцируется, в большей степени за счет уменьшения количества поперечных компонентов. И в синапсах, и в дендроплазме отмечается большое количество гранул гликогена.
В ультраструктуре ЛД фиксируются меньшие изменения. Большинство синаптических окончаний в проксимальном отделе дендритов сохраняют свою морфологию, в них обнаруживаются многочисленные синаптические пузырьки и неповрежденные митохондрии (рис. 2, г). Однако в более дистальных отделах латеральных дендритов выявляется дисфункция синапсов: синаптические окончания полностью или частично запустевшие, немногочисленные пузырьки локализуются возле активных зон (см. рис. 2, г). Митохондрии в синапсах имеют поврежденный вид. В то же время цитоскелет в обоих латеральных дендритах также уплотняется за счет более строгой ориентации и уменьшения расстояния между филаментами. Выявленные изменения морфологии дендритов МН зимующих рыб свидетельствуют о пониженной способности нейронов принимать в этот период афферентные сигналы.
В процессе приспособления к сложным условиям среды обитания (холод, голод, сниженная сенсорная информация и др.) у животных формируются необходимые адаптивные механизмы [2, 4]. В основе этого лежит специфический процесс метаболического регулирования, связанный с необходимостью экономии энергетических резервов. Установлено, что при входе сусликов в спячку в тормозятся процессы, требующих больших энергетических трат, каковыми, в частности, является поддержание структуры и функции нейронов: подавляются биоэлектрическая и белоксинтезирующая активность клеток, уменьшаются размеры нейронов и степень ветвления дендритов, происходит ретракция шипиков, уменьшается активная зона синапсов [1, 2, 8]. Достоверно установлено, что благодаря этому такие животные во время зимней спячки экономят более 80 % энергии, которая требуется для поддержания обычного уровня метаболизма [2]. Мы предполагаем, что в нашем эксперименте, у рыб, находящихся в состоянии гипометаболизма именно необходимость экономии энергетических ресурсов в условиях длительного охлаждения приводит к значительному сокращению объемов МН. Однако мы обнаружили, что структурные изменения в разных локусах МН выражены в разной степени. Вероятно, это может быть обусловлено разным уровнем функциональной активности синапсов в разных частях нейронов. Очевидно, что в зимний период года функция зрения рыб из-за низкой освещенности становится мало актуальной и поступление информации от зрительных анализаторов практически прекращается. Лишенные афферентной импульсации синаптические бутоны запустевают, ультраструктура дендроплазмы трансформируется. Поскольку известно, что зрительный вход располагается исключительно на поверхности ВД [3, 10], понятно, что именно эти дендриты оказываются в состоянии практически полной естественной депривации. Логично предположить, что в данных условиях отсутствует необходимость поддерживать в активном состоянии весь дендрит, вследствие чего объемы значительно редуцируются. С другой стороны, структура ЛД также трансформируется, хотя и в меньшей степени. Известно, что на поверхности данных дендритов оканчиваются входы от акустического и вестибулярного анализаторов, причем важно – слуховой вход имеет синапсы на дистальной части ЛД, а вестибулярный на всей поверхности ЛД и сомы [7, 9]. Слуховая информация, как и зрительная, в период зимовки становится также неактуальной, в связи с чем дистальная часть дендритов редуцируется и меняются ультраструктурные характеристики данного отдела ЛД. С другой стороны, поддержание нормального стабильного положения тела рыбы в толще воды важно в любое время года, поэтому избирательно сохраняется функциональная активность вестибулярного анализатора и ультраструктурные характеристики синаптических окончаний и дендроплазмы в проксимальном отделе ЛД трансформируются в значительно меньшей степени (рис. 2).
Это предположение косвенно подтверждается работами нашей лаборатории. В ряде экспериментов было показано, что искусственно вызванная деафферентации МН рыб путем энуклеации, приводит к значительному уменьшению объема их ВД [5], при этом результаты электронно-микроскопического анализа свидетельствуют о перестройке ультраструктуры ВД [3], аналогично данным, полученным в нашем эксперименте. Повреждение рецепторной выстилки внутреннего уха, т.е разрушение статоакустического входа, соответственно приводит к сокращению объемов ЛД [7].
Мы полагаем, что выявленные изменения структуры МН не являются следствием патологических проявлений, но отражают определенную фазу нормальных метаболических процессов в МН при гипометаболизме, они закономерны и физиологически целесообразны. Очевидно, на объем МН главным образом влияет гипометаболизм, а деафферентация нейронов вносит дополнительный вклад в этот процесс.
Пластические изменения в структуре нейронов зимоспящих млекопитающих, находящихся в состоянии гибернации, были обнаружены еще в начале 90-х годов прошлого века. Однако исключительное разнообразие и численность клеточного состава мозга млекопитающих затрудняет получение данных о роли отдельных клеток; исследование структурных перестроек на уровне одного нейрона в процессе проведения нескольких экспериментов невозможно или сильно затруднено. Рыбы для подобных исследований являются более удачной моделью. Использование идентифицированных нейронов Маутнера при изучении сложных механизмов адаптации клеток в процессе гибернации позволяет исследовать структурные изменения не только на отдельном нейроне, но даже в отдельных локусах клетки.
Выводы
В экспериментально созданных условиях зимовки рыб Percсottus glehni с использованием метода трехмерной реконструкции было выявлено существенное изменение объема и ультраструктуры маутнеровских нейронов. Возможно, что в условиях воздействия длительной гипотермии в сочетании с естественной деафферентацией маутнеровских нейронов определяющим фактором пластических перестроек в нейронах является снижение метаболической активности вследствие необходимости экономии энергетических ресурсов животного. В условиях гипометаболизма, а также в результате снижения потоков афферентной информации объем МН уменьшается, поскольку отсутствуют условия и необходимость поддерживать их в полноценном состоянии.

