Воспаление – это патологическая реакция, возникающая в организме в ответ на повреждение, представляет собой защитный процесс, включающий в себя каскад сложных биохимических и биологических реакций, одной из ступеней которого является активация специфических ферментов – циклооксигеназ. Фермент циклооксигеназа является мишенью соединений обладающих противовоспалительной активностью [1–3]. Анализируемыми соединениями в исследованиях количественной зависимости «структура – свойство» являются производные антраниловой кислоты [4, 5]. Соединения из ряда производных антраниловой кислоты проявляют различные виды биологической активности [6], в том числе и противовоспалительной [7]. Для проведения исследований взаимодействия биологически активных соединений производных антраниловой кислоты с выбранными мишенями – циклооксигеназой 1 и 2, использовали молекулярный докинг. Экспериментальное проведение молекулярного докинга, с использованием специализированных программ, занимает длительное время. Высокопроизводительный скрининг включает в себя сокращение временных затрат, при сохранении исходной эффективности. Поэтому актуальным является создание моделей структура – свойство, позволяющих используя информацию о структуре рассчитать скоринговые функции исследуемого ряда соединений.
Цель исследования: проведение теоретического расчёта скоринговых функций, полученных методом молекулярного докинга по циклооксигеназам (ЦОГ) 1 и 2 амидов и гидразидов N-ароил галоген(Н)антраниловых кислот с помощью количественных моделей «структура – свойство» зависимости скоринговых функций от квантово-химических и структурных дескрипторов.
Объектом исследования являются замещенные амиды и гидразиды N-ароил галоген (Н) антраниловых кислот 22 (соединения).
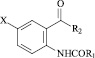
X = H, R1 = C6H4 (4–Br),
R2 = NHCH2CH = CH2; (1)
X = H, R1 = 2–фурил,
R2 = NHCH2CH = CH2; (2)
X = Br, R1 = C6H4 (2–COOH), R2 = NH2 ; (3)
X = Br, R1 = 2–фурил,
R2 = NHC6H11 (циклогексил); (4)
X = I, R1 = 2–фурил, R2 = NHCH2C6H5; (5)
X = H, R1 = C6H4 (4–NO2),
R2 = NHCH2CH = CH2 ; (6)
X = Br, R1 = 2–фурил,
R2 = NHNHCOCH2Cl; (7)
X = Br, R1 = 2–фурил,
R2 = NHCH2CH2CH(CH3)2; (8)
X = Br, R1 = 2–фурил, R2 = NHCH3 ; (9)
X = Br, R1 = 2–фурил, R2 = NHCH2C6H5; (10)
X = I, R1 = 2–фурил, R2 = NHCH3; (11)
X = H, R1 = C6H2 (3, 4, 5–(OCH3)3),
R2 = NHCH2CH = CH2; (12)
X = Br, R1 = 2–фурил,
R2 = NHNHCOCH2CH2CH3; (13)
X = Br, R1 = 2–фурил,
R2 = NHNHCO(2-фурил); (14)
X = Br, R1 = 2–фурил,
R2 = NHNHCOCH2C6H5; (15)
X = Br, R1 = 2–фурил,
R2 = NHNHCO C6H4 (2–COOH); (16)
X = I, R1 = 2–фурил, R2 = N(CH3)2; (17)
X = Br, R1 = C6H4 (2–OCH3), R2 = NH2; (18)
X = Br, R1 = C6H4 (3–NO2), R2 = NH2; (19)
X = Br, R1 = 2–фурил, R2 = NHNH2; (20)
X = H, R1 = C6H4 (4–OCH3),
R2 = NHCH2CH = CH2; (21)
X = I, R1 = C6H5, R2 = NHCH2CH2OH. (22)
Материалы и методы исследования
Проведение квантово-химических расчётов анализируемых структур лигандов и оптимизацию структуры проводили программой Gaussian 03 полуэмпирическим методом РМ3. Конвертирование оптимизированных структур в 3D-формат (.pdb) выполняли с использованием ChemBio3D Ultra 12,0. Расчёт структурных дескрипторов проведен с помощью программы ChemAxon.
Моделирование взаимодействия анализируемых лигандов с рецептором проводили с использованием программы AutoDock 4.0 в составе программы MGL Tools 1.5.6, с использованием Ламарковского генетического алгоритма. При проведении молекулярного докинга были использованы трёхмерные модели молекул фермента, информация о которых получена из базы данных RCSB Protein Data Bank ЦОГ 1 (PDB ID code: 3N8X [8]) и 2 (PDB ID code: 1PXX [9]). Перед проведением молекулярного докинга были удалены молекулы воды из структуры белка. Файлы лигандов и рецептора были конвертированы в формат PDBQT-файла, с добавлением недостающих атомов водорода и частичных атомных зарядов по методу Гастейгера.
Результаты исследования и их обсуждение
Для проведения исследований «структура – свойство» с целью получения значений скоринговых функций по ЦОГ 1 и 2, выполнили моделирование взаимодействия лиганда с рецептором программой AutoDock 4.0 в составе программы MGL Tools 1.5.6.
В результате проведенного докинга по ЦОГ-1 и 2 получены скоринговые функции: энергия связывания (Binding energy (BeЦОГ1 и BeЦОГ2)) и межмолекулярная энергия (Intermolecular energy (ImeЦОГ1)), характеризующие взаимодействие лиганда с рецептором (ЦОГ-1 и 2) (табл. 1).
Таблица 1
Значения скоринговых функций по ферментам ЦОГ 1 и 2 амидов и гидразидов N-ароил галоген (Н) антраниловых кислот
|
№ |
BeЦОГ1 |
ImeЦОГ1 |
BeЦОГ2 |
|
1 |
–6,27 |
–7,77 |
–5,63 |
|
2 |
–7,71 |
–9,20 |
–7,79 |
|
3 |
–7,65 |
–9,15 |
–7,83 |
|
4 |
–9,08 |
–10,27 |
–9,00 |
|
5 |
–8,54 |
–10,03 |
–7,78 |
|
6 |
–2,15 |
–3,94 |
1,81 |
|
7 |
–7,04 |
–8,53 |
–7,35 |
|
8 |
–6,94 |
–8,73 |
–6,2 |
|
9 |
–5,56 |
–6,45 |
–5,28 |
|
10 |
–9,12 |
–10,61 |
–8,46 |
|
11 |
–6,69 |
–7,59 |
–6,12 |
|
12 |
–2,66 |
–5,05 |
–5,56 |
|
13 |
–6,41 |
–8,20 |
–6,21 |
|
14 |
–7,40 |
–8,89 |
–6,43 |
|
15 |
–3,67 |
–5,46 |
–5,73 |
|
16 |
–4,83 |
–6,92 |
–5,56 |
|
17 |
–7,48 |
–8,38 |
–7,44 |
|
18 |
–7,62 |
–8,81 |
–6,71 |
|
19 |
–7,65 |
–8,84 |
–7,59 |
|
20 |
–6,92 |
–8,11 |
–6,70 |
|
21 |
–5,34 |
–7,12 |
–6,56 |
|
22 |
–5,42 |
–7,21 |
–5,22 |
Квантово-химические дескрипторы рассчитаны программой Gaussian 03 с полной оптимизацией геометрии молекул. Для изучения зависимости BeЦОГ1, BeЦОГ2, ImeЦОГ1 от структуры мы использовали суммарные значения на атомах кислорода, азота, углерода: напряженности Σ(Е), потенциала Σ(φ) и величины заряда в модуле Σ(|q|) (табл. 2).
Таблица 2
Квантово-химические и структурные дескрипторы амидов и гидразидов N-ароил галоген (Н)антраниловых кислот для исследования «структура – свойство» в прогнозировании BeЦОГ1, ImeЦОГ1, BeЦОГ2
|
№ |
О(|q|) |
C(X)D |
O(X)D |
H(Z)D |
Sum(O)D |
C(Y)D(+) |
Sum(C)D |
H(X)D |
Sum(C)D(+) |
|
1 |
0,713 |
–27,14 |
–2,86 |
2,58 |
–9,72 |
38,68 |
–49,99 |
–23,42 |
111,03 |
|
2 |
0,788 |
–6,28 |
–1,82 |
–9,13 |
–5,82 |
35,70 |
–23,65 |
–5,02 |
103,59 |
|
3 |
1,335 |
–20,75 |
–5,05 |
23,51 |
3,81 |
39,39 |
26,55 |
–10,04 |
106,79 |
|
4 |
0,720 |
7,06 |
–1,86 |
–6,15 |
–1,70 |
42,96 |
0,44 |
10,35 |
121,88 |
|
5 |
0,721 |
–1,04 |
–1,85 |
32,66 |
8,65 |
42,12 |
18,54 |
–6,59 |
156,36 |
|
6 |
1,901 |
–34,22 |
1,48 |
15,97 |
–12,68 |
38,16 |
–86,60 |
–43,96 |
96,69 |
|
7 |
1,011 |
12,32 |
1,20 |
–16,24 |
–8,21 |
42,97 |
–33,98 |
14,62 |
114,67 |
|
8 |
0,719 |
12,40 |
–2,09 |
8,46 |
0,61 |
53,22 |
42,11 |
19,14 |
140,97 |
|
9 |
0,716 |
–0,30 |
–1,76 |
–9,15 |
–2,68 |
35,78 |
0,79 |
4,53 |
94,26 |
|
10 |
0,720 |
–1,15 |
–1,84 |
32,64 |
8,67 |
42,00 |
18,75 |
–6,50 |
156,20 |
|
11 |
0,784 |
–0,20 |
–1,76 |
–9,12 |
–2,70 |
35,90 |
0,57 |
4,44 |
94,42 |
|
12 |
1,245 |
–70,99 |
–11,71 |
–49,04 |
–42,11 |
36,89 |
–169,49 |
–77,57 |
113,17 |
|
13 |
1,018 |
28,82 |
1,14 |
20,06 |
0,21 |
64,92 |
5,54 |
25,40 |
168,27 |
|
14 |
1,064 |
16,85 |
0,92 |
–17,54 |
–8,20 |
38,56 |
–23,55 |
21,00 |
107,79 |
|
15 |
1,028 |
12,11 |
1,07 |
24,55 |
3,16 |
49,49 |
–3,95 |
4,93 |
175,97 |
|
16 |
1,744 |
25,76 |
0,26 |
–9,83 |
–6,10 |
37,77 |
–14,05 |
23,63 |
129,54 |
|
17 |
0,703 |
1,04 |
–1,60 |
–14,36 |
–4,87 |
37,61 |
–13,07 |
2,86 |
103,36 |
|
18 |
0,897 |
0,44 |
0,42 |
–8,19 |
–3,59 |
43,40 |
–26,46 |
23,85 |
115,64 |
|
19 |
1,905 |
–24,32 |
–9,64 |
–1,41 |
–5,82 |
49,24 |
–50,55 |
–32,06 |
106,79 |
|
20 |
0,690 |
15,32 |
0,93 |
–24,25 |
–6,96 |
42,01 |
–34,51 |
17,16 |
109,86 |
|
21 |
0,905 |
–8,19 |
–0,24 |
–12,43 |
–8,71 |
50,71 |
–41,45 |
–5,45 |
159,46 |
|
22 |
0,975 |
–1,98 |
–2,80 |
20,67 |
–3,45 |
44,79 |
–7,94 |
–3,34 |
122,26 |
Расчёт структурных дескрипторов проведен программой ChemAxon, в результате получали файл в формате .pdb. Полученная трёхмерная структура в формате файла .pdb содержит структуру вещества в декартовых координатах, описывающих пространственную структуру молекулы соединения по осям x, y и z. Для проведения исследований «структура – свойство», рассчитаны пространственные дескрипторы, основанные на суммировании декартовых координат по осям x (Tot(X)D), y (Tot(Y)D) и z (Tot(Z)D) и по атомам C (C(X)D, C(Y)D, C(Z)D), O (O(X)D, O(Y)D, [O(Z)D), N (N(X)D, N(Y)D, N(Z)D), H (H(X)D, H(Y)D, H(Z)D) и сумма (Sum) всех Tot (Sum(Tot)D), C (Sum(C)D), O (Sum(O)D), N (Sum(N)D), H (Sum(H)D), их значений в модуле: по осям x (Tot(X)D(+)), y (Tot(Y)D(+)) и z (Tot(Z)D(+)) и по атомам C (C(X)D(+), C(Y)D(+), C(Z)D(+)), O (O(X)D(+), O(Y)D(+), O(Z)D(+)), N (N(X)D(+), N(Y)D(+), N(Z)D(+)), H (H(X)D(+), H(Y)D(+), H(Z)D(+)) и сумма (Sum) всех Tot (Sum(Tot)D(+)), C (Sum(C)D(+)), O (Sum(O)D(+)), N (Sum(N)D(+)), H (Sum(H)D(+)) (табл. 2).
С целью составления количественной модели «структура – свойство», проведен множественный линейный регрессионный анализ с помощью Statistica 6, зависимости BeЦОГ1, BeЦОГ2, ImeЦОГ1 от квантово-химических и структурных дескрипторов.
В результате проведенного анализа найдено свыше 69 уравнений множественной регрессии, из которых были отобраны 3 наиболее значимых уравнения 1–3 (табл. 3) зависимости BeЦОГ1, BeЦОГ2, ImeЦОГ1 от квантово-химических и структурных дескрипторов.
Таблица 3
Уравнения регрессии связи BeЦОГ1, ImeЦОГ1, BeЦОГ2 с квантово-химическими параметрами и структурными дескрипторами амидов и гидразидов N-ароил галоген(Н)антраниловых кислот
|
№ |
Уравнение регрессии |
R |
F |
S |
p |
N |
|
1 |
BeЦОГ1рассч. 1 = –6,1980 – 0,3231×Sum(O)D – – 0,3231×H(Z)D + 0,0455×C(X)D – 0,0395×C(Y)D(+) |
0,787 |
6,92 |
1,28 |
0,00169 |
22 |
|
2 |
ImeЦОГ1рассч.2 = –9,0519 + 0,0306×Sum(C)D + 0,4080×O(X)D – – 0,0545×H(X)D – 0,1840×Sum(O)D + 1,4376×О(|q|) |
0,799 |
5,65 |
1,15 |
0,00344 |
22 |
|
3 |
BeЦОГ2рассч.3 = –2,3365 – 0,00274×Sum(C)D + + 0,4212×O(X)D + 0,1222×H(Z)D – 0,2862×Sum(O)D – – 0,0379×Sum(C)D (+) + 0,0023×C(X)D |
0,874 |
8,10 |
1,20 |
0,00050 |
22 |
Установлено, что найденные уравнения имеют наибольшие значения коэффициента корреляции (R), критерия Фишера (F) и минимальные значения среднеквадратичной ошибки (S) и уровня значимости р не превышающего 0,05 (табл. 3).
Заключение
Выполнены исследования взаимодействия анализируемых производных с ЦОГ 1 и 2 методом молекулярного докинга, в результате получены скоринговые функции BeЦОГ1, BeЦОГ2, ImeЦОГ1.
Рассчитаны квантово-химические и структурные дескрипторы для проведения множественного линейного регрессионного анализа с использованием программы Statistica 6. По результатам проведенного анализа выбраны дескрипторы с высоким коэффициентом корреляции по отношению к исследуемым скоринговым функциям (BeЦОГ1, BeЦОГ2, ImeЦОГ1): О(|q|), C(X)D, O(X)D, H(Z)D, Sum(O)D, C(Y)D(+), Sum(C)D, H(X)D, Sum(C)D(+).
Получены уравнения регрессии с использованием множественного линейного регрессионного анализа программой Statistica 6, зависимости BeЦОГ1, BeЦОГ2, ImeЦОГ1 от квантово-химических и структурных дескрипторов, в результате получены три модели в виде уравнений 1–3.
Значимость составленных уравнений зависимости «структура – свойство» была доказана с использованием критерия Фишера и вычисленного значения р, при α = 0,05. Вычисленные значения р для всех трёх уравнений не превышают уровень значимости α = 0,05.
Таким образом, полученные модели «структура – свойство» могут быть использованы для моделирования молекулярного докинга по ЦОГ 1 и 2, прогнозированием скоринговых функций соединений производных антраниловой кислоты, которые планируется синтезировать.
Библиографическая ссылка
Андрюков К.В., Коркодинова Л.М. ИССЛЕДОВАНИЕ ЗАВИСИМОСТИ «СТРУКТУРА – СВОЙСТВО» В РЯДУ АМИДОВ И ГИДРАЗИДОВ N–АРОИЛЗАМЕЩЕННЫХ ГАЛОГЕН(Н) АНТРАНИЛОВЫХ КИСЛОТ ПРИ ПОСТРОЕНИИ РЕГРЕССИОННЫХ МОДЕЛЕЙ МОЛЕКУЛЯРНОГО ДОКИНГА ПО ФЕРМЕНТАМ ЦИКЛООКСИГЕНАЗА 1 И 2 // Международный журнал прикладных и фундаментальных исследований. 2019. № 12-2. С. 192-196;URL: https://applied-research.ru/ru/article/view?id=12978 (дата обращения: 18.12.2025).

