К лекарственным средствам предъявляются следующие требования: высокая активность, быстрота достижения эффекта, отсутствие токсичности, минимум побочных эффектов. Производные гидроксибензойных кислот отвечают поставленным требованиям и являются перспективными для получения высокоактивных лекарственных препаратов с широким диапазоном терапевтического действия и практически отсутствием токсичности. Сами по себе или в сочетании с другими лекарственными средствами они широко используются в целях терапии или профилактики различных заболеваний.
Салициловая кислота обладает противовоспалительным и нейротропным действием, ацетилсалициловая кислота относится к нестероидным противовоспалительным средствам.
Амид салициловой кислоты применяют как болеутоляющее и жаропонижающее средство; оксафенамид усиливает выделение желчи, оказывает спазмолитическое действие; тиаприд проявляет антидофаминергическую активность, является обезболивающим и противовоспалительным средством [2], салицилморфолид обладает противовоспалительной активностью [1].
Производные 3-гидроксибензойной кислоты являются активаторами фермента глюкокиназы, в результате уровень глюкозы в крови понижается и в то же время увеличивается захват глюкозы из крови [3]; входят в состав препаратов, ингибирующих ВИЧ-протеазу [4].
Производные 4-гидроксибензойной кислоты проявляют антибактериальную и противоопухолевую активность [5]; соли, сочетающие в своем составе фрагменты п-гидроксибензойной кислоты и гетероциклических соединений, способствуют выведению мочевой кислоты [6]. Проксиметакаин используется в качестве местного анестетика, нифуроксазид проявляет антимикробную активность [7]. Исходя из вышеизложенного, перспективны работы в области синтеза производных гидроксибензойных кислот.
Целью нашей работы был синтез N-(гидроксибензоил)-4-аминобензойных кислот и получение из них растворимых в воде литиевых и калиевых солей, физиологически более доступных.
Исходные хлорангидриды гидроксибензойных кислот получены взаимодействием гидроксибензойных кислот (1-5) и их производных с избытком оксалилхлорида в присутствии апротонного растворителя ДМФА [1]. Процесс проводили при 50 °C и постоянном перемешивании реакционной смеси.
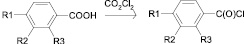
(1-5) (6-10)
R1 = -OH, R2 = R3 = H (6)
R1 = R3 = H, R2 = -OH (7)
R1 = R2 = H, R3 = -OH (8)
R1 = R2 = H, R3 = -OC(O)CH3 (9)
R1 = -OC(O)CH3, R2 = R3 = H (10)
Галогенангидриды (6-10) без непосредственного выделения из реакционной смеси были использованы в синтезе N-(гидроксибензоил)-4-аминобензойных кислот (11-15), полученных по реакции Шоттен-Баумана. Выход N-(гидроксибензоил)-4-аминобензойных кислот составил 30-76 %.
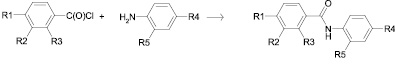
(6-10) (11-15)
R1 = -OH, R2 = R3 = R5 = H, R4 = -COOH (11)
R1 = R3 = R5 = H, R2 = -OH, R4 = -COOH (12)
R1 = R2 = R5 = H, R3 = -OH, R4 = -COOH (13)
R1 = R2 = R5 = H, R3 = -OC(O)CH3, R4 = -COOH (14)
R1 = -OC(O)CH3, R2 = R3 = R4 = H, R5 = -C(O)OC2H5 (15)
В целях повышения растворимости и увеличения физиологического действия, полученные соединения были переведены в литиевые и калиевые соли, проявляющие высокую фармакологическую активность: литиевые соли оказывают психотропный эффект; калиевые соли нормализуют сердечный ритм. Соли N-(гидроксибензоил)-4-аминобензойных кислот обладают крайне низкой токсичностью.
В таблице приведены физические константы полученных соединений.
Физические константы полученных соединений
|
Название соединения |
Бруто- формула |
Выход, % |
Температура плавления, °С |
Rf (система) |
|
N-(4-гидрокси-бензоил)-4-амино- |
C14H11O4N |
65,3 |
208-210 |
0,52 (этанол – гексан 2:1) |
|
N-(3-гидрокси-бензоил)-4-амино- |
C14H11O4N |
55,7 |
278-280 |
0,60 (этанол) |
|
N-(2-гидрокси-бензоил)-4-амино- |
C14H11O4N |
76 |
157-159 |
0,65 (этанол) |
|
N-(2-ацетокси-бензоил)-4-амино- |
C16H13O5N |
50 |
184-185 |
0,75 (этанол – гексан 2:1) |
|
этиловый эфир N-(4-ацетокси-бензоил)-2-аминобензойной кислоты |
C18H17O5N |
30 |
280-282 |
0,67 (этанол – гексан 2:1) |
Синтез N-(4-гидроксибензоил)-4-аминобензойной кислоты. Смесь 13,8г (0,1моль) 4-гидроксибензойной кислоты, 17,15мл (0,2моль) оксалилхлорида в присутствии каталитических количеств ДМФА нагревают при температуре 50 °C до растворения 4-гидроксибензойной кислоты, что приводит к получению хлорангидрида 4-гидроксибензойной кислоты, который не выделяют, а используют непосредственно. К смеси 15,08 г (0,11 моль) 4-аминобензойной кислоты, 16,0 г (0,4 моль) NaOH в 50 мл воды приливают по каплям при 5 °C и постоянном перемешивании приготовленную выше смесь хлорангидрида 4-гидроксибензойной кислоты. Процесс протекает в течение 2-х часов. К охлажденному во льду раствору приливают концентрированную HCl до pH 5-6. Полученный осадок отфильтровывают, промывают водой до отрицательной реакции на хлориды и сушат. Выход – 16,78 г (65,3 %). Т. пл. = 208-210 °С. Соединение перекристаллизовывают из спирта. ТСХ в системе этанол – гексан 2:1 (Rf = 0,52). Спектр ЯМР 1Н (ДМСО-d6, 300 МГц), δ, м. д.: 6.94 д (2H, Ph), 7.69 д (2H, Ph), 7.72 д (2H, Ph), 8.22 д (2H, Ph), 8.36 с (1H, NH), 10.22 с (1H, OH), 11.42 с (1H, COOH).
Синтез N-(3-гидроксибензоил)-4-аминобензойной кислоты. Получена аналогично N-(4-гидроксибензоил)-4-аминобензойной кислоты. Выход – 14,31 г (55,7 %). Т. пл. = 278-280 °С. Соединение перекристаллизовывают из спирта. ТСХ в системе этанол (Rf = 0,60). Спектр ЯМР 1Н (ДМСО-d6, 300 МГц), δ, м. д.: 6.69 д (1H, Ph), 7.30 т (1H, Ph), 7.42 с (1H, Ph), 7.44 с (1H, Ph), 7.69 д (2H, Ph), 8.22 д (2H, Ph), 8.39 с (1H, NH), 10.41 с (1H, OH), 11.44 с (1H, COOH).
Синтез N-(2-гидроксибензоил)-4-аминобензойной кислоты. Получена аналогично N-(4-гидроксибензоил)-4-аминобензойной кислоты. Выход – 19,53 г (76,0 %).
Т. пл. = 157-159 °С. Соединение перекристаллизовывают из спирта. ТСХ в системе этанол (Rf = 0,65). Спектр ЯМР 1Н (ДМСО-d6, 300 МГц), δ, м. д.: 6.94 д (1H, Ph), 7.03 т (1H, Ph), 7.34 т (1H, Ph), 7.68 с (1H, Ph), 7.69 д (2H, Ph), 8.22 д (2H, Ph), 9.75 с (1H, NH), 10.56 с (1H, OH), 11.54 с (1H, COOH).
Синтез N-(2-ацетоксибензоил)-4-аминобензойной кислоты. Получена аналогично N-(4-гидроксибензоил)-4-аминобензойной кислоты. Выход – 14,95 г (50,0 %). Т. пл. = 184-185 °С. Соединение перекристаллизовывают из спирта. ТСХ в системе этанол – гексан 2:1 (Rf = 0,75). Спектр ЯМР 1Н (ДМСО-d6, 300 МГц), δ, м. д.: 2.25 с (3H, CH3), 7.17 д (1H, Ph), 7.38 т (1H, Ph), 7.48 т (1H, Ph), 7.71 д (2H, Ph), 7.84 д (1H, Ph), 8.22 д (2H, Ph), 9.65 с (1H, NH), 11.52 с (1H, COOH).
Синтез этилового эфира N-(4-ацетоксибензоил)-2-аминобензойной кислоты. Получен аналогично N-(4-гидроксибензоил)-4-аминобензойной кислоты. Выход – 10,53 г (30,0 %). Т. пл. = 280-282оС. Соединение перекристаллизовывают из спирта. ТСХ в системе этанол – гексан 2:1 (Rf = 0,67). Спектр ЯМР 1Н (ДМСО-d6, 300 МГц), δ, м. д.: 1.37 т (3H, CH3), 2.26 с (3H, CH3), 4.31 к (2H, CH2), 7.22 д (2H, Ph), 7.27 т (1H, Ph), 7.46 д (1H, Ph), 7.57 т (1H, Ph), 7.86 д (2H, Ph), 8.03 д (1H, Ph), 9.65 с (1H, NH).
Синтез дилитиевой соли N-(4-гидроксибензоил)-4-аминобензойной кислоты.
В 150 мл C6H6 с защитой от влаги и углекислого газа кипятят около часа 1,2 г (0,05 моль) LiOH, добавляют еще 150 мл C6H6, 6,39 г (0,025 моль) N-(4-гидроксибензоил)-4-аминобензойной кислоты и кипятят в течение 2-х часов до образования в насадке Дина-Старка 0,9 мл (0,05моль) воды. Избыток бензола отгоняют под вакуумом. Продукт отделяют фильтрованием, удаляют остатки растворителя. Выход – 6,21 г (92,3 %). Т. пл. > 330 °С (разл.).
Синтез дилитиевой соли N-(3-гидроксибензоил)-4-аминобензойной кислоты.
Получена аналогично дилитиевой соли N-(4-гидроксибензоил)-4-аминобензойной кислоты. Выход – 6,27 г (93,2 %). Т. пл. > > 330 °С (разл.).
Синтез дилитиевой соли N-(2-гидроксибензоил)-4-аминобензойной кислоты.
Получена аналогично дилитиевой соли N-(4-гидроксибензоил)-4-аминобензойной кислоты. Выход – 6,10 г (90,5 %). Т. пл. > > 330 °С (разл.).
Синтез монолитиевой соли N-(2-ацетоксибензоил)-4-аминобензойной кислоты. Получена аналогично дилитиевой соли N-(4-гидроксибензоил)-4-аминобензойной кислоты. Выход – 6,93 г (90,82 %). Т. пл. > > 330 °С (разл.).
Синтез дикалиевой соли N-(4-гидроксибензоил)-4-аминобензойной кислоты.
1,95 г (0,05 моль) металлического калия растворяют в 7,0мл абсолютного C2H5OH, добавляют 200 мл C6H6, 6,39 г (0,025 моль) N-(4-гидроксибензоил)-4-аминобензойной кислоты, кипятят в течение 2-х часов с защитой от влаги и углекислого газа. Избыток бензола отгоняют под вакуумом. Продукт отделяют фильтрованием, удаляют остатки растворителя. Выход – 7,92 г (95,1 %). Т. пл. > 330 °С (разл.).
Синтез дикалиевой соли N-(3-гидроксибензоил)-4-аминобензойной кислоты.
Получена аналогично дикалиевой соли N-(4-гидроксибензоил)-4-аминобензойной кислоты. Выход – 7,84 г (94,2 %). Т. пл. > > 330 °С (разл.).
Синтез дикалиевой соли N-(2-гидроксибензоил)-4-аминобензойной кислоты.
Получена аналогично дикалиевой соли N-(4-гидроксибензоил)-4-аминобензойной кислоты. Выход – 7,76 г (93,2 %). Т. пл. > > 330 °С (разл.).
Синтез монокалиевой соли N-(2-ацетоксибензоил)-4-аминобензойной кислоты. Получена аналогично дикалиевой соли N-(4-гидроксибензоил)-4-аминобензойной кислоты. Выход – 7,62 г (90,4 %). Т. пл. > > 330 °С (разл.).
Спектры ЯМР 1Н (ДМСО-d6) регистрировали на спектрометре Bruker DRX500, внутренний стандарт – ГМДС.
Температуры плавления определяли капиллярным методом на приборе Stuart SMP-30 при скорости нагрева 10 град/мин.

