Мистиксин-7 (МТН) является синтетическим эндогенным КРФ – подобным гектапептидом. Он относится к классу регуляторных пептидов с молекулярной массой 1.041 kDa; со следующей аминокислотной структурой: p-anisoyl-Arg-Lys-Leu-Leu-D-Thi-IIe-D-Leu-NH2 [1]. Ранее нами было показано, что МТН обладает выраженной нейротрофической активностью на срезах мозга. Пептид обратимо тормозил активности АМПА- и НМДА-зависимых механизмов дозо-зависимым образом. Эффекты МТН были обратимыми, и после удаления пептида из омывающей среды активности этих рецепторов восстанавливались. Эти данные показали, что МТН можно рассматривать как обратимый неспецифический ингибитор АМПА и НМДА рецепторов [2].
Очевидно, благодаря этим свойствам пептид надежно блокировал эпилептоформную активность в пентилентетразольной модели эпилепсии [3]. Кроме того, МТН протектировал активности АМПА и НМДА рецепторных механизмов от ишемии, вызванной депривацией из инкубационной среды глюкозы и кислорода [4]. Основываясь на этих данных, мы предположили, что МТН имеет более широкий диапазон протективных действий на различные нарушения деятельности мозга, которые связаны с развитием глутаматной эксайтотоксичности: гипоксия, ишемия, эпилепсия, а также таких неврологических заболеваний как болезнь Альцгеймера, Хантингтона, Паркинсона, шизофрении и других [5].
Глутамат является главным возбуждающим нейромедиатором в центральной нервной системе млекопитающих. Это вещество играет ключевую роль в различных адаптивных функциях, таких как обучение, память, сенсорное восприятие, контроль движений [6]. Однако сильное стрессорное воздействие (травма, ишемия, эпилепсия, аноксия) вызывает массивное выделение внутриклеточного глутамата во внеклеточное пространство. Это приводит к гиперактивации глутаматных рецепторов и возрастанию потоков ионов кальция внутрь клеток. В целом это характеризуется развитием глутаматной эксайтотоксичности и последующей гибелью нейронов. Для защиты клеток от глутаматной эксайтотоксичности использование специфических блокаторов глутаматных рецепторов является неадекватным, поскольку вызывает побочные эффекты [7]. Полагаем, что химические молекулы с высокой скоростью диффузии по межклеточному пространству, обладающие кратковременным и обратимым ингибированием ионотропных рецепторов могут быть потенциальными протективными препаратами для защиты деятельности мозга от эксайтотоксических повреждений.
В связи с этим, цель настоящего исследования заключалась в изучении протективных эффектов МТН на модели глутаматной эксайтотоксичности с использованием срезов мозга. Для этой цели мы использовали регистрацию активностей АМПА- и НМДА-зависимых механизмов на срезах обонятельной коры мозга крыс в сочетании с нейрохимической обработкой МТН и нами была разработана модель глутамат-вызванной эксайтотоксичности на срезах мозга.
Эксперименты проведены на крысах-самцах линии Вистар массой 180–200 г с соблюдением рекомендаций по этике работы с животными, предложенными European Communities Council Direction (86/609 EEC). Из мозга крыс изготавливали переживающие тангенциальные срезы толщиной 400–500 мкм. Срезы помещали в камеру и непрерывно перфузировали со скоростью 2 мл/мин искусственной церебральной жидкостью следующего состава (мM): NaCl – 124,0; KCl – 5,0; CaCl2 – 2,6; KH2PO4 – 1,24; MgSO4 – 1,2; NaHCO3 – 3,0; глюкоза – 10,0; трис–НCl – 23,0. Перфузионный раствор продували кислородом, температуру поддерживали на уровне 37 °С, рН – 7.2–7.3.
В срезах регистрировали фокальные потенциалы (ФП) стеклянными микроэлектродами, заполненными 1 M NaCl сопротивлением 1–5 мОм в ответ на одиночные ортодромные электрические импульсы (прямоугольной формы, длительностью 0,1 мс, интенсивностью 1–3 В, с частотой 0,003 Гц) латерального обонятельного тракта (ЛОТ), который является главным афферентным входом к клеткам структур обонятельной коры. Индифферентный серебряный электрод располагали в регистрационной ячейке.
ФП усиливали (усилитель НТО, Россия), оцифровывали при помощи аналого-цифрового устройства (МД 32, Россия) с частотой квантования 20 кГц и обрабатывали на компьютере с помощью специальной программы. Анализировались амплитуды возбуждающих компонентов ФП с соответствующими процессами генеза и опосредуемые разными рецепторными механизмами: суммарный потенциал действия латерального обонятельного тракта (ПД ЛОТ) (пресинаптический компонент ФП); среди постсинаптических – АМПА и НМДА глутаматергические рецепторные компоненты возбуждающего постсинаптического потенциала (ВПСП). Первый из них активируется a-амино-3-гидрокси-5-метилизоксазол-4-пропионовой кислотой (АМПА ВПСП), второй – N-метил-D-аспартатом (НМДА ВПСП).
В данной работе изучались протективные эффекты аппликации пептида мистиксина-7 (University Berkeley, USA), в концентрации 50 мг/мл на срезах мозга. Мистиксин растворяли в инкубационной среде непосредственно перед опытом. Схема эксперимента была следующей. В течение 15 мин регистровали ФП в срезах при инкубации контрольной средой, затем воздействовали раствором с МТН в концентрации 50 мг/мл в течение 30 мин. Далее срезы отмывались контрольной инкубационной средой без пептида в течение 20 мин. Частота раздражения ЛОТ в контроле и при действие мистиксина была 0,003 Гц.
Статистическую обработку полученных результатов проводили по непараметрическому критерию (U-критерий, Вилкоксона-Манна-Уитни). Различия признавались достоверными при р ≤ 0.05.
Глутамат–вызванная токсичность является широко используемой экспериментальной моделью нейронального повреждения. Для того чтобы, имитировать развитие острой стадии неврологических заболеваний, связанных с токсичностью L-глутамата и проверить защитные свойства МТН мы использовали концентрацию экзогенного L-глутамата в концентрации 20 мМ. Было обнаружено, что L-глутамат индуцировал увеличение амплитуд АМПА и НМДА ВПСП с максимальными значениями на 20-й мин действия агониста. Гиперактивация АМПА и НМДА рецепторов при действии токсических концентраций L-глутамата была различной. Так, активность АМПА рецепторов возрастала в среднем на 20 ± 8 %. Гиперактивация НМДА рецепторов была значительнее и составляла 140 ± 15 %.
Эти данные свидетельствуют о развитии острой стадии глутамат-вызванной эксайтотоксичности для ионтропных глутаматных рецепторов. Однако восприимчивость этих рецепторных механизмов к L-глутамату оказалась различной. НМДА рецепторы проявили максимальную чувствительность к токсическому действию L-глутамата.
Предварительная обработка срезов МТН в концентрации 50 мг/мл сопровождалась ингибированием активностей АМПА и НМДА рецепторов к 20-й мин на 76 и 94 %, соответственно (рисунок). Эти данные подтверждают ранее обнаруженные свойства МТН о неспецифическом ингибировании ионотропных глутаматных рецепторов [2]. Аппликация L-глутамата на срезы индуцировала незначительную активацию АМПА и НМДА рецепторов. К 20-й мин действия L-глутамата активности этих рецепторов составляли в среднем 40 и 36 %, соответственно. Эти данные указывают, что гиперактивации этих рецепторных механизмов при действии токсической концентрации L-глутамата не развивались. После прекращения действия L-глутамата (при отмывании) происходило восстановление активностей АМПА и НМДА рецепторов.
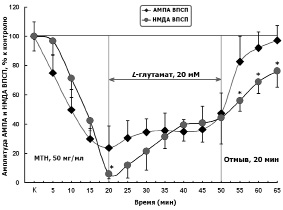
Нейропротективные эффекты предварительной обработки срезов обонятельной коры МТН в концентрации 50 мг/мл на изменения амплитуд АМПА и НМДА рецепторов при действии токсической концентрации L-глутамата (20 мМ). На левой части графика – изменения усредненных амплитуд АМПА и НМДА ВПСП (n = 16) при действии МТН. В средней части графика – действие L-глутамата. В правой части графика – отмывание срезов контрольной инкубационной средой после действия L-глутамата. Серая горизонтальная линия – усредненное контрольное значение амплитуд АМПА и НМДА ВПСП до воздействие МТН и L-глутамата. Вертикальные серые линии – интервал действий МТН, L-глутамата и отмывание.
По оси абцисс: К – контроль до воздействия, цифры – время воздействия препаратов.
* p ≤ 0.05 по сравнению с контролем, U-критерий Вилкоксона-Манн-Уитни
Для того чтобы, доказать специфичность действия МТН была использована энзиматическая обработка ферментом трипсином. После такой обработки защитные эффекты МТН были протестированы по той же схеме, что и действия нативного пептида. Известно, что трипсин расщепляет пептиды, содержащие аминокислоты аргинин и лизин, которые являются компонентами МТН. Мы полагали, что такая обработка пептида снизит его защитные свойства на действие L-глутамата в токсической концентрации. Было обнаружено, что предварительная ферментативная обработка МТН снижала, но не полностью исключала глутамат-вызванную гиперактивацию АМПА рецепторов. В отличие от АМПА рецепторов протеолитическая обработка пептида сохраняла возникновение гиперактивации НМДА рецепторов на действие L-глутамата. Эти данные доказывают, что при развитии глутаматной эксайтотоксичности протективные эффекты индуцируются МТН.
Таким образом, представленные данные демонстрируют, что пептид МТН оказывает протективный эффект в переживающих срезах обонятельной коры в модели глутаматной эксайтотксичности. Пептид эффективно и надежно защищал активности АМПА и НМДА рецепторов от повреждающего действия L-глутамата в токсической концентрации.
Для того чтобы, понять молекулярные механизмы протективных свойств МТН необходимо отметить, что пептид имеет структурное подобие с фрагментом ламина α1 цепи [8]. Известно, что ламинины являются гликопротеинами базальных мембран. В ЦНС ламинины участвуют в формировании и поддержании гематоэнцефалического барьера и механических повреждениях мозга [9]. Некоторые структурные производные ламинин имеют выраженные нейротрофические свойства. Так, KDI пептид (Lys-Asp-Ile), производный из гамма 1-ламинина, индуцировал торможение активностей АМПА и НМДА рецепторов и, тем самым, устранял глутаматную эксайтотоксичность [9, 10]. Отметим, что МТН, также как и KDI, проявлял нейропротективные эффекты на активности АМПА и НМДА рецепторов в модели глутаматной эксайтотоксичности. Следовательно, эти данные можно рассматривать как доказательство на структурное и функциональное сходство МТН с ламининами.
Мы полагаем, что наши результаты, касающиеся защитных эффектов пептида МТН, будут способствовать разработке эффективных терапевтических препаратов для лечения неврологических заболеваний, связанных с развитием глутаматной эксайтотоксичности, таких как инсульт, аноксия, эпилепсия.

