Известно, что сульфонилазотсодержащие соединения, в том числе их гетероциклические производные, имеют не только препаративный интерес, но и обладают значительной биологической активностью, находя применение в качестве лекарственных препаратов, эффективных сахарозаменителей, пестицидов нового поколения [1, 3, 6]. Поскольку применяемые в таких производствах методы получения дороги и экологически небезвредны, разработка новых путей синтеза сульфонилазотсодержащих циклических и ациклических соединений, более доступных и простых, является важной проблемой современной химии. В качестве структурных блоков для получения сульфонилазотсодержащих соединений в последние годы целесообразно используются аддукты, комплексы, различные интермедиаты, легко образующиеся при взаимодействии цианогруппы нитрилов и других цианосодержащих соединений с SO3. Перспективными и интересными в этом отношении представляются 2,6-дизамещенные 1,4,3,5-оксатиадиазин-4,4-диоксиды (I), имеющие несколько реакционных центров, что определяет многообразие возможных путей их реагирования [5].
Они легко взаимодействуют с цианоамидами с образованием новой интересной гетероциклической системы – 2,4,6-тризамещенных 1,2,3,5-оксатиадиазин-2-оксидов (II) [4].
Целью данной работы является изучение гидролитических превращений оксидов (II) при различных условиях. В настоящей работе было показано, что оксиды (II) при нагревании (60 °C) в течение 5 ч с эквимольным количеством воды в бензоле, толуоле, хлороформе превращаются в аммониевые соли 2,6-бис(трихлор-
метил)-1,2,4,6-тиатриазин-1,1-диоксида (IIIа, б).
По истечение времени реакции бензол упаривался, продукт промывался гексаном.
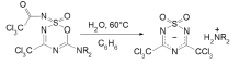
IIа, б IIIа, б
NR2 = пиперидино (а); пирролидино (б)
Рассматриваемый процесс, по-видимому, включает гидролиз трихлорацетамидного фраг-мента и рециклизацию с необычным замещением (по сравнению с известными данными [2]) донорной группы NR2 на сильноакцепторную группу CCl3 выделившейся при гидролизе трихлоруксусной кислоты.
Состав и строение полученных солей (IIIа, б) доказаны данными элементного анализа, ИК, ЯМР 1Н спектров и химическими превращениями. Так, при действии на соли (IIIа, б) серной кислоты (15 мин, 25 °C ) получен 2,6-бис(трихлорметил)-1,2,4,6-тиатриазин-1,1-диоксид (IVа), при смешивании которого с эквимольными количествами пиперидина и пирролидина выделены соли (IIIа) и (IIIб) соответственно:
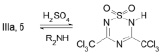
IVа
NR2 = пиперидино (а); пирролидино (б)
Выходы, температуры плавления, ИК-спектры полученных солей (IIIа, б) и триазина (IVа) приведены в табл. 1, спектры ЯМР 1Н и элементный состав – в табл. 2. ИК-спектры записаны на спектрофотометре UR-20. Спектры ЯМР 1Н записаны на спектрометре Gemini 300 (рабочая частота 300 МГц) в ацетоне d6, внутренний стандарт – ГМДС.
Таблица 1
Выходы, температуры плавления и ИК-спектры соединений (IIIа, б) и (IVа)
|
№ соединения |
Выход, % |
Т. пл., °C |
ИК-спектр, ν, см-1 |
||
|
SO2 |
N-C-N-C-N |
C=N |
|||
|
IIIа |
81 |
154 |
1170, 1390 |
1590 |
– |
|
IIIб |
53 |
130 |
1165, 1390 |
1590 |
– |
|
IVа |
95 |
> 220 (разл.) |
1170, 1390 |
– |
1600, 1640 |
Таблица 2
Спектры ЯМР 1Н и данные элементного анализа комплексов (IIIа, б) и (IVа)
|
№ соединения |
Спектр ЯМР 1Н, δ, м. д. |
Найдено/вычислено, % |
Формула |
||||
|
С |
Н |
Hlg |
N |
S |
|||
|
IIIа |
1.64-1.90 м [6Н, СН2], 3.28-3.40 м [4Н, (СН2)2N] |
23.41 23.86 |
2.52 2.67 |
46.54 46.96 |
12.01 12.37 |
7.91 7.73 |
C9H12Cl6N4O2S |
|
IIIб |
1.59-1.88 м [4H, СН2], 3.26-3.39 м [4Н, (СН2)2N] |
22.23 21.89 |
2.35 2.30 |
48.10 48.46 |
12.25 12.36 |
7.30 7.30 |
C8H10Cl6N4O2S |
|
IVа |
5.89-6.65 м, 6.81 с, 6.90 с, |
13.56 13.06 |
0.32 0.28 |
57.01 57.82 |
11.12 11.42 |
8.95 8.70 |
C4HCl6N3O2S |
Таблица 3
Выходы, температуры плавления и ИК- спектры диоксидов (Iа, б) и тиатриазинов (IVб, в)
|
№ соединения |
Время, ч (CH2Cl2) |
Выход, % |
Т. пл., °C |
ИК-спектр, ν, см-1 |
||
|
SO2 |
C=N |
N-H |
||||
|
Iа |
20а |
96 |
138 |
1162, 1370 |
1550, 1650 |
– |
|
Iб |
20а |
98 |
175 |
1200, 1365 |
1545, 1623 |
– |
|
IVб |
1б |
97 |
96 |
1170, 1345 |
1580 |
3030-3340 |
|
IVв |
1б |
95 |
90 |
1165, 1345 |
1570 |
3050-3350 |
Примечание. а При 15 °C. б При 40 °C.
Таблица 4
Спектры ЯМР 1Н и данные элементного анализа диоксидов (Iа, б) и тиатриазинов (IVб, в)
|
№ соединения |
Спектр ЯМР 1Н, δ, м. д. (ДМСО-d6) |
Найдено/вычислено, % |
Формула |
||||
|
С |
Н |
Hlg |
N |
S |
|||
|
Iа |
1.40-2.54 м [6Н, СН2], 3.43-3.93 м [4Н, (СН2)2N] |
28.69 28.72 |
2.99 3.01 |
31.82 31.70 |
12.52 12.56 |
9.59 9.58 |
C8H10Cl3N3O3S |
|
Iб |
1.52-2.21м [6Н, СН2], 3.50-3.99 м [4Н, (СН2)2N] |
20.61 20.54 |
2.19 2.15 |
52.50 52.54 |
9.01 8.98 |
6.83 6.86 |
C8H10Br3N3O3S |
|
IVб |
1.30-1.72 м [6Н, СН2], 3.15-3.22 т [4Н, (СН2)2N], 5.89-6.55 м, 6.80 с, 6.91 с, 7.51с (1H, N-H) |
28.83 28.81 |
3.40 3.32 |
31.84 31.89 |
16.83 16.79 |
9.65 9.61 |
C8H11Cl3N4O2S |
|
IVв |
1.44-1.80 м [6Н, СН2], 3.35-3.75 т [4Н, (СН2)2N], 5.91-6.66 м, 6.82 с, 6.92 с, 7.66с (1H, N-H) |
20.63 20.59 |
2.35 2.38 |
51.41 51.36 |
11.86 11.99 |
6.80 6.87 |
C8H11Br3N4O2S |
В продолжение исследований гидролитического превращения оксидов (II) было исследовано поведение гетероциклической системы (II) на оксиде алюминия (γ-форма). Выявлено, что гидролиз оксидов (IIа, в) водой, связанной с Al2O3 протекает избирательно по двум направлениям: с сохранением 1,2,3,5-оксатиадиазинового цикла (направление 1) и с рециклизацией этого цикла в 1,2,4,6-тиатриазиновый (направление 2):
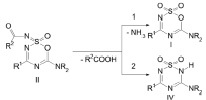
II, R1 = R2 = CCl3; NR2 = пиперидино (а); R1 = R2 = CBr3; NR2 = пиперидино (в);
I, R1 = CCl3; NR2 = пиперидино (а);
R1 = CBr3; NR2 = пиперидино (б);
IV, R1 = CCl3; NR2 = пиперидино (б);
R1 = CBr3; NR2 = пиперидино (в)
При комнатной температуре и ниже гидролиз протекает с образованием диоксидов (Iа, б), трихлоруксусной (либо трибромуксусной) кислоты и аммиака (направление 1). При более высокой температуре (30–50 °C) отщепление ацильной группы сопровождается рециклизацией 1,2,3,5-оксатиадиазинового цикла (II) в 1,2,4,6-тиатриазиновый с образованием 3,5-дизаме-щенных 1,2,4,6-тиатриазин-1,1-диоксидов (IVб, в) (направление 2). Судя по данным ИК, ПМР спектроскопии полученные тиатриазины (IVб, в) существуют в виде нескольких таутомерных форм, образующихся при миграции водородного атома между атомами азота в гетероцикле.
Соединения (Iа, б) экстрагировались с оксида алюминия ацетоном, затем растворитель отгонялся. Для выделения соединений (IVб, в) оксид алюминия обрабатывался 25 % раствором аммиака (водн.), вода упаривалась. Очистка соединений (Iа, б) и (IVб, в) проводилась кристаллизацией из смеси метиленхлорид-гексан (1:1).
Состав и строение полученных соединений доказаны данными элементного анализа, ИК, ЯМР 1Н спектров. Выходы, температуры плавления, ИК-спектры полученных соединений (Iа, б) и (IVб, в) приведены в табл. 3, спектры ЯМР 1Н и элементный состав – в табл. 4.
Таким образом, в результате работы установлено, что гидролиз 2,4,6-тризамещенных 1,2,3,5-оксатиадиазин-2-оксидов (II) протекает в зависимости от условий проведения с образованием соединений разных классов: сопровождается (либо не сопровождается) трансформацией исходного гетероцикла, протекает с сохранением или замещением донорного заместителя NR2 в исходном оксиде (II) на сильноакцепторный, то есть является многовариантным и управляемым превращением.

