Интересным, интенсивно развивающимся в последние годы направлением органической химии является образование стабильных многокомпонентных соединений. Частицы или молекулы в подобных соединениях прочно связаны между собой силами межмолекулярного нековалентного взаимодействия в единую систему (супрамолекулу). Свойства полученной супрамолекулярной системы резко отличаются от свойств входящих в нее исходных компонентов [1, 4–6].
Получение новых структурных форм супрамолекулярных систем, изучение особенностей их строения и свойств является важной задачей органической химии.
Ранее нами было показано, что 2,6-дизамещенные 1-окса-4-тиа-3,5-диазин-4,4-диоксиды (I) легко реагируют при 20 °C с эквимолекулярным количеством дизамещенных цианоамидов с образованием 2,4,6-тризамещенных 1-окса-2-тиа-3,5-диазин-2-оксидов (II) [2].
При взаимодействии одного из представителей этого класса – 6-пиперидино-2-трихлорацетиламино-4-трихлорметил-1-окса-2-тиа-3,5-диазин-2-оксида (II, R = CCl3, R’ = пиперидино) с цианопиперидином в бензоле получена структурная система (IIIа), состоящая из 2,4,6-трис(пиперидино)-1,3,5-триазина, 2,6-бис(трихлорметил)-1-окса-4-тиа-3,5-диазин-4,4-диоксида и бензола в соотношении 2:2:1. Строение этой кристаллической супрамолекулы подтверждено методом РСА [3]. Было показано, что молекулы диоксида (I), триазина и бензола связаны в структуру (IIIа) ван-дер-ваальсовыми взаимодействиями. Циклы диоксида (I) и триазина в данной системе представлены энергетически выгодными конформациями «полукресло» и «кресло» соответственно [3].
С целью выявления синтетических возможностей и некоторых закономерностей протекания реакции (как то – влияние природы заместителей в циклах диоксида, оксида и в цианоамиде, соотношения исходных веществ) изучено взаимодействие диоксидов (Iа, R = CCl3; Iб, R = CBr3) с цианоамидами (N-цианопиперидин, N-цианоморфолин, N,N-диэтилцианоамид) в различных растворителях (C6H6, C6H5CH3, C6H5Cl, C6H5CN, CHCl3, ТГФ).
К раствору соответствующего диоксида (I) в бензоле при перемешивании прибавлялся в трехкратном мольном избытке цианоамид (раствор в бензоле) и смесь выдерживалась при 60˚С определенное время. Растворитель удалялся, остаток обрабатывался смесью гексан-диэтиловый эфир, 2:1. Получены комплексы (III а-е).
При взаимодействии диоксида (Iа) с избытком диэтилцианоамида при 60 ˚C в бензоле получен комплекс (IIIж), состоящий из диоксида (Iа) и 2,4,6-трис(диэтиламино)-1,3,5-триазина в эквимольном соотношении.
Ступенчатым проведением реакции диоксида (Iа) с цианопиперидином в бензоле (образование оксида (IIа) на первой стадии и взаимодействие последнего с диэтилцианоамидом – на второй) получен комплекс (IIIз), состоящий из диоксида (Iа) и 2,4-бис(диэтиламино)-6-пиперидино-1,3,5-триазина в эквимольном соотношении. В спектрах ЯМР комплексов (IIIж, з) отсутствуют сигналы, характерные для бензола.
Индивидуальность полученных соединений и ход реакции контролировалась методом ТСХ на пластинках Silufol UV-254, элюент – ацетон-гексан, 1:1 по объему, проявление парами йода. Кристаллизация полученных комплексов (IIIа-з) проводилась в бензоле.
ИК-спектры соединений записаны на спектрофотометре Specord 80-M в метиленхлориде. Спектры ЯМР 1Н записаны на спектрометре Gemini 300 (рабочая частота 300 МГц) в (CD3)2CO, внутренний стандарт – ТМС.
Продолжительность реакций, выходы, температуры плавления, ИК-спектры комплексов (III а-з) приведены в табл. 1, спектры ЯМР 1Н и элементный состав представлены в табл. 2.
Таблица 1
Продолжительность реакции, выходы, температуры плавления и ИК-спектры комплексов (III а-з)
|
№ соединения |
Время, ч (60˚C, C6H6) |
Выход, % |
Т. пл., °C |
ИК-спектр, ν, см-1 |
|
|
SO2 |
C=N |
||||
|
IIIа* |
6 |
90 |
150 |
1185, 1385 |
1625, 1725 |
|
IIIб* |
6 |
87 |
151 |
1175, 1375 |
1630, 1725 |
|
IIIв* |
6 |
86 |
149 |
1170, 1365 |
1620, 1725 |
|
IIIг* |
6 |
82 |
139 |
1160, 1355 |
1625, 1730 |
|
IIIд |
6 |
89 |
125 |
1185, 1365 |
1635, 1730 |
|
IIIе |
7 |
53 |
162 |
1165, 1365 |
1635, 1725 |
|
IIIж |
9 |
92 |
115 |
1175, 1370 |
1635, 1745 |
|
IIIз |
3 |
70 |
75 |
1170, 1360 |
1625, 1730 |
Примечание. *Комплексы (IIIа-г) были так же получены взаимодействием оксида (IIа) с двухкратным мольным избытком цианопиперидина (6–8 ч, 60 °C) в бензоле, толуоле, хлорбензоле, бензонитриле с выходами 83, 85, 80. 75 % соответственно.
Таблица 2
Спектры ЯМР 1Н и данные элементного анализа комплексов (IIIа-з)
|
№ соединения |
Спектр ЯМР 1Н, δ, м. д. |
Найдено/вычислено, % |
Формула |
||||
|
С |
Н |
Hlg |
N |
S |
|||
|
IIIа |
1.50-1.65 м [18Н, 3(СН2)3], 3.60-3.85 т [12Н, 3(СН2)2N], 7.33с (3H, 0.5 C6H6) |
40.60 40.64 |
4.55 4.50 |
29.14 28.86 |
15.51 15.65 |
4.30 4.34 |
C50H66Cl12N16O6S2 |
|
IIIб |
– |
41.10 41.06 |
4.50 4.59 |
28.65 28.59 |
15.15 15.02 |
4.31 4.30 |
C51H68Cl12N16O6S2 |
|
IIIв |
– |
39.75 39.71 |
4.37 4.33 |
30.50 30.55 |
14.87 14.82 |
4.20 4.24 |
C59H65Cl13N16O6S2 |
|
IIIг |
– |
40.70 40.76 |
4.41 4.36 |
28.12 28.38 |
15.79 15.84 |
4.30 4.27 |
C51H65Cl12N17O6S2 |
|
IIIд |
1.45-1.75м [18H, 3(CH2)3], 3.65-3.85т [12Н, 3(СН2)2N], 7.35с (3H, 0.5C6H6) |
29.90 29.88 |
3.35 3.31 |
47.74 47.70 |
11.10 11.15 |
3.20 3.19 |
C50H66Br12N16O6S2 |
|
IIIе |
– |
35.46 35.48 |
3.68 3.65 |
28.70 28.63 |
15.00 15.04 |
4.32 4.30 |
C44H54Cl12N16O12S2 |
|
IIIж |
1.12-1.43т [18H, 6CH3], 3.45-3.70м [12Н, 6СН2] |
34.31 34.38 |
4.60 4.56 |
32.18 32.13 |
16.81 16.88 |
4.87 4.83 |
C19H30Cl6N8O3S |
|
IIIз |
1.10-1.35т [12H, 4CH3], 1.60-1.80 м [6Н, (СН2)3], 3.50-3.70 м [8H, 2(CH2)2N], 3.70-3.85 т [4H, (CH2)2N] |
35.60 35.54 |
4.45 4.47 |
31.61 31.55 |
16.62 16.58 |
4.71 4.74 |
C20H30Cl6N8O3S |
Таким образом, в результате работы установлено, что при взаимодействии диоксидов (Iа, б) с N-цианопиперидином и N-цианоморфолином в соотношении 1:3 при 60 °C в ароматических растворителях (C6H5X, X = H,CH3, Cl, CN) образуются комплексы (IIIа-з), включающие молекулы диоксида (Iа, б), соответствующего триазина и ароматического растворителя C6H5X в соотношении 2:2:1. При использовании же в реакции диэтилцианоамида в состав комплексов (IIIж, з) растворитель не вовлекался. Можно полагать, что молекулы растворителя (C6H5X) в супрамолекуле (III) заполняют имеющиеся в структуре «пустоты». По-видимому, эту роль выполняют и группы C2H5 при взаимодействии диоксида (Iа) с диэтилцианоамидом в бензоле.
Комплексы (III) также были получены взаимодействием оксидов (II) с цианоамидами, взятыми в мольном соотношении 1:2. Таким образом, превращение диоксидов (I) и цианоамидов в комплекс (III) можно представить ступенчатым процессом, включающим образование оксидов (II) на первой стадии и взаимодействие последних с цианоамидом – на последующих (рисунок).
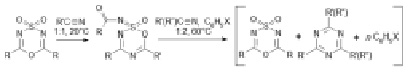
Iа, б IIа, б IIIа-з
I, R = CCl3 (а), CBr3 (б); II, R = CCl3, R’ = пиперидино (а), R = CBr3, R’ = пиперидино (б); III, R = CCl3, R’ = пиперидино, X = H (а), CH3 (б), Cl (в), CN (г); R = CBr3, R’ = морфолино, X = H (е); R’ = CCl3, R = Et2N (ж); R = CCl3, R’ = пиперидино, R’’ = Et2N (з); n = 0.5 (IIIа-е), 0 (IIIж,з)
Действительно, при нагревании диоксида (Iа) в избытке цианопиперидина (1:3) в бензоле в течение 30 мин при 60 °C в смеси найдено 18 % оксида (IIа). В параллельном опыте при дальнейшем нагревании этой смеси получен с высоким выходом комплекс (IIIа).
Следует отметить, что полученные комплексы (IIIа-з) являются более устойчивыми структурами, чем входящие в их состав соединения. Их не удалось разделить на отдельные компоненты. Так, комплекс (IIIа) не изменяется после нагревания при 90 °C в течение 15 ч во влажном бензоле, тогда как входящий в состав этого комплекса диоксид (Iа) легко гидролизуется при растворении в холодной воде.
Комплексы (III) в отличие от диоксидов (I) не реагируют с цианоамидами. После 30 ч нагревания при 70˚C смеси комплекса (IIIв) и цианопиперидина (1:2) в хлорбензоле из смеси выделили 96 % исходного комплекса. Супрамолекулярные системы (III) не образуются при проведении реакции в ТГФ и CHCl3. Комплексы (III) не удалось получить из исходных диоксидов (I) и триазинов.

