Арилметилиденовые производные 3Н-фуран-2-онов, содержащие в своем составе несколько неравнозначных электрофильных центров способны участвовать в разнообразных превращениях и представляют интерес в плане создания сложноорганизованных органических молекул [1-5].
Введение дополнительных функциональных групп (особенно тионной) в структуру изучаемых соединений приводит к появлению новых химических и физических свойств, открывает возможности для реализации новых направлений гетероциклизации и позволяет значительно расширить практические свойства вновь полученных веществ.
Изучено взаимодействие фуран-2-ононов с реактивом Лавессона (2,4-бис-(п-метоксифенил)-1,3-дитиафосфетан-2,4-дисульфидом).
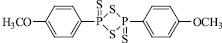
Ранее незамещенные в 3 положении фуран-2-тионы, имеющие в 5 положении объемный алкильный заместитель, были получены с использованием более жесткого тионирующего агента – пентасульфида фосфора [6], а также с использованием реагента Лавессона в достаточно жестких условиях осуществления реакции.
Показано, что при кипячении исходных продуктов с пентасульфидом фосфора в ксилоле, в течение 2 часов приводит к образованию смеси продуктов реакции 5R-3H-тиофен-2-онов, 5R-3H-фуран-2-тионов, 5R-3H-тиофен-2-тионов. Из них преобладающими и единственно выделенными из реакционной смеси является 5R-3H-тиофен-2-оны.

R=C4H9, C5H11
При использовании в качестве тионирующего агента реактива Лавессона реакция идет более селективно – происходит замена карбонильной группы в исходных 3Н-фуран-2-онах на тиокарбонильную с образованием 5R-3H-фуран-2-тионов, с выходом до 45 %.
5-R-3-арилметилиден-3H-фуран-2-оны в данной реакции изучены не были. Осуществление реакции при кипячении реагентов в безводном толуоле (бензоле) при трёхкратном избытки реагента Лавессона в течение 25 часов ни привело к ожидаемым результатам. Выделить конечный продукт реакции не удалось.
Данное взаимодействие было изучено в условиях микроволновой активации. Микроволновый нагрев отличатся от традиционного высокими объемным и временными градиентами, а также неодинаковой способностью различающихся по составу растворов и компонентов гетерогенных систем к поглощению энергии излучения. Кроме того, в электромагнитном микроволновом поле происходит ориентация заряженных частиц и диполей, присутствующих в растворе, что влияет на их взаимодействие. Синтез в условиях микроволновой активации позволяет отказаться от растворителей, в данном случае температура реакционной смеси не ограничивается температурой кипения растворителя и реакция протекает значительно быстрее. Все это приводит как к изменению выхода продуктов реакции, скорости протекания процесса, возможности отказа от высококипящих и токсичных растворителейВ последнее время возрос интерес исследователей к проведению реакции с использованием микроволновой активации. С целью повышения выхода продуктов, изменения хода протекания процесса нами были разработаны условия конденсации с использованием микроволнового нагрева.
Использование микроволновой активации позволяет значительно сократить время реакции, отказаться от использования токсичных растворителей.
Взаимодействие арилметилиденовых производных фуран-2-она (1 a-c) и реагента Лавессона проводилось при смешении эквимолярных количеств реагентов, при нагревании в течение 15 минут.
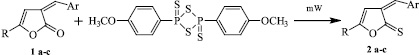
R = C6H5, p-CH3-C6H5, p-OCH3-C6H5; Ar = C6H5-Cl-2
В результате реакции выделены 5R-3арилметилиден-3Н-фуран-2-тионы (2 a-c), с выходами до 87 %.
Наличие в спектрах ЯМР1Н двух синглетов: протона фуранонового цикла и протона экзоциклической связи С=С, расположенного в более слабом поле, чем аналогичных протон для исходного соединения позволяют говорить о образовании замещенных 3Н-фуран-2-тионов.
Наличие нескольких неравнозначных реакционных центров в молекулах исходных соединений дает возможность предположить образование разнообразных продуктов реакций.
Вероятно при нагревании происходит раскрытие черырехчленного кольца реагента Лавессона, с образованием двух реакционноспособных дитиофосфинилидов.
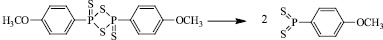
Дальнейшее взаимодействие образовавшегося дитиофосфинилида с исходным фуран-2-оном по карбонильному атому приводит к образованию конечного продукта реакции.
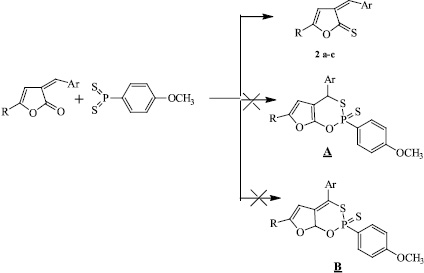
Не исключалась реализация альтернативных направлений реакции, а именно образование фурооксотиофосфинин-2-сульфида либо 4Н-формы (структура А), либо 7аН-формы (структура В), либо смеси двух данных форм, однако спектральные данные полученных соединений позволяют исключить данное направление реакции.
Спектры ЯМР1Н получены на спектрометре Varian-400 при 20-25 °С в CDCl3, внутренний стандарт ТМС. Рабочая частота 400 МГц. ТСХ проводили на пластинах Silufol UV-254, элюент – гексан-этилацетат-хлороформ, 2:2:1, проявитель – пары иода.
Реактив Гриньяра получали по нижеприведенной методике.
В трехгорлую колбу на 100 мл, снабженную мешалкой, обратным холодильником и капельной воронкой помещают 0,005 моль магния (стружка) в 10 мл диэтилового эфира, затем в течение 10 мин прикапывают 0,005 моль бромбензола, растворенного в 7 мл эфира.
5R-3-арилметилиден-3Н-фуран-2-тионы (II). В термостойком бюксе смешивают 0,01 моль 5R-3-арилметилиден-3Н-фуран-2-она, 0,01 моль реактива Лавессона нагревают в микроволновой печи при максимальной мощности в течение 15 минут. Реакционную массу промывают последовательно изопропиловым спиртом и гексаном. Полученные кристаллы сушат на фильтре Шотта.
3-(2-хлорбензилиден)-5-фенилфуран-3Н-фуран-2-тион (2а) Выход 78 %, Т.пл. 143-145 °С. ЯМР1Н, δ, м.д.: 6.35 с., (1Н), 6.94-7.86 м, (9Н, аром.), 8.95 с (1Н). Найдено %: С 68.75; Н 3.45; S 11.10. С17H11ClOS. Вычислено %: С 68.34; Н 3.71; S 10.73.
3-(2-хлорбензилиден)-5-(п-толил)фуран-3Н-фуран-2-тион (2b) Выход 83 %, Т.пл. 131-133 °С. ЯМР1Н, δ, м.д.: 2.15 с., (3Н, CH3), 6.28 с., (1Н), 7.05-7.75 м, (8Н, аром.), 8.74 с (1Н). Найдено %: С 69.36; Н 3.96; S 10.79. С18H13ClOS. Вычислено %: С 69.11; Н 4.19; S 10.25.
3-(2-хлорбензилиден)-5-(4-метоксифенил)фуран-3Н-фуран-2-тион (2c) Выход 69 %, Т.пл. 157-159 °С. ЯМР1Н, δ, м.д.: 3.65 с., (3Н, ОCH3), 6.15 с., (1Н), 6.87-7.23 м, (8Н, аром.), 8.25 с (1Н). Найдено %: С 66.13; Н 4.27; S 10.12. С18H13ClO2S. Вычислено %: С 65.75; Н 3.99; S 9.75.
Исследование выполнено за счет гранта Российского Научного Фонда (проект № 15-13-10007).

