Непрерывный поиск и исследование новых функциональных материалов является важнейшим фактором развития современной науки и техники. Получения нано- и микрочастиц материалов сложного состава и создания научных основ их синтеза, первую очередь требует исследования условий получения их в среде органических растворителей.
Тиостаннаты серебра относятся к числу перспективных функциональных материалов, обладающих полупроводниковыми, фотоэлектрическими и термоэлекрическими свойствами. В системе Ag–Sn–S известны соединения составов Ag2SnS3, Ag2Sn2S5, Ag4Sn3S8 и Ag8SnS6. Эти соединении является уникальными полупроводниковыми свойствами. В последнее время получение этих соединений в виде наночастиц преставляет большой интерес. Это показывает актуальность фундаментальных исследовании в получении наночастиц соединения Ag2SnS3 в системе AgNO3–SnS2–C2H4(OH)2.
Соединение Ag8SnS6 плавится конгруэнтно при 1125К [1]. Температура полиморфного превращения равна 444К [2]. Обе модификации Ag8SnS6 изоструктурны с соответствующими кристаллическими модификациями Ag8GeS6 и имеют следующие параметры решетки: а = 1,5298, b = 0,7548, с = 1,0699 нм [3-5]. Ag2SnS3 плавится конгруэнто при 936 К и кристаллизуются в моноклинной сингонии (Пр.г.: Pna21; п.р.: a = 0,627, b = 0,5796, c = 1,3179 нм, b = 93,270). Соединения Ag2Sn2S5 характеризуются инконгруэнтным плавлениями при 955 К. Ag4Sn3S8 плавится инконгруэнто при 927 К и имеет кубическую структуру: (Пр.г.: P4132) п.р.: a = 1,0799 нм и Z = 4 [1].
Основной целью работы является создание физико-химических основ получения наночастиц соединения Ag2SnS3 методом химического осаждения в среде этиленгликоля.
В качестве исходных компонентов для синтеза соединения Ag2SnS3 были использованы AgNO3 и SnS2. Для синтеза SnS2 взяли соединение SnCl2.2H2O и растворили в концентрированной соляной кислоте, а затем окислили пероксидом водорода до SnCl4. В полученный SnCl4 прилили раствор тиоацетамида и получили осадок SnS2. Затем осадок SnS2 промыли дистиллированной водой и высушили в вакууме при температуре 353 К.
Согласно уравнению реакции на аналитических весах были взвешаны 0,118 г SnS2 и 0,1465 г AgNO3, перемешаны и к этой смеси прилили 20 мл этиленгликоля. Уравнение реакции имеет следующий вид:
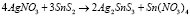 .
.

Рис. 1. Микрофотографии наночастиц соединения Ag2SnS3 при температурах а) 353 К; б) 403 К; в) 453 К
Раствор перемешивали в течении 30 минут, затем каждый из образцов переместили в 3 автоклава, и в течение 48 часов нагревали при температурах 353, 405 и 453 К. После синтеза осадок фильтровали. Для извлечения излишки олова сперва промыли 0,1 М раствором азотной кислоты, затем дистиллированной водой и этанолом. Очищенный осадок в течение 1 часа высушивали в вакууме при 353 К.
Полученный осадок сперва исследовали микроструктурным анализом (в микроскопе фирмы HITACHI TM 3000). Было установлено, что при 353 К получены наночастицы с сильной адгезией. При 403 и 453 К наблюдается формирование наночастиц. Полное формирование наночастицей наблюдается при 453 К с размером 38-107 нм. Практически было установлено, что размеры наночастиц изменяется в зависимости от концентрации компонентов и времени термической обработки.
Рис. 2. Кривая ДТА соединения Ag2SnS3
Индивидуальность синтезированных соединений контролировали методами дифференциально-термического (ДТА) (пирометр НТР-70, прибор Термоскан-2) и рентгенофазового (РФА) (2D PHASER «Bruker», CuKa, 2q, 20-80 град.) анализов. На кривой ДТА соединения Ag2SnS3 обнаруженный эндотермический эффект при 935 К соответствует температуре плавления соединения Ag2SnS3 (рис. 2). Полученные результаты соответствуют литературным данным, представленным выше.
По данными РФА установлено, что при 353-453 К полученное соединение Ag2SnS3 в основном находится в аморфном состоянии (рис. 3). После термической обработки интенсивность дифракционных линий соединения Ag2SnS3 согласуются с литературными данными (рис. 3). В результате их расшифровки получены следующие параметры орторомбической решетки (Пр.г.: Pna21; п.р.: a = 0,6272, b = 0,5795, c = 1,3181 нм, b = 93,310).
Было изучено влияние pH среды и температуры на полное осаждение соединения Ag2SnS3. Для этого при различных значениях pH среды и в температурном интервале 343-453 К был изучен выход продукта. Установлено, что максимальный выход соединения Ag2SnS3 наблюдается при pH = 3,5–4 и температуре 343 К. При pH > 5 в системе получается соединение Sn(NO3)4. Продукты гидролиза этого соединения перемешиваются с Ag2SnS3. Для получения в растворе кислотной среды используют азотную кислоту. Установлено, что при pH < 2 соединение Ag2SnS3 разлагается. Влияние pH среды и температуры на полное осаждение соединения Ag2SnS3 представлено в нижеследующей таблице (табл. 1).
Таблица 1
Влияние pH-среды и температуры на выход соединения Ag2SnS3
|
Температура, К |
pH |
Масса соединения Ag2SnS3, мг |
Выход соединения Ag2SnS3, % |
|
323 |
3 |
253,4 |
93,2 |
|
343 |
3,5 |
263,02 |
96,52 |
|
353 |
3.8 |
266,07 |
97,64 |
|
373 |
4 |
259,88 |
95,37 |
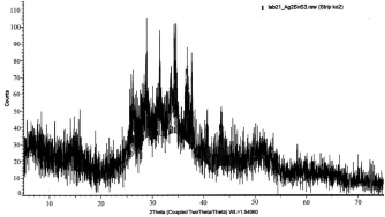
Рис. 3. Дифрактограмма наночастиц соединения Ag2SnS3
Таблица 2
Результаты элементного анализа соединения Ag2SnS3
|
Соединения |
Количество элементов, вес. % |
|||||
|
Ag |
Sn |
S |
||||
|
теор. |
прак. |
теор. |
прак. |
теор. |
прак. |
|
|
Ag2SnS3 |
50,12 |
50,11 |
27,61 |
27,59 |
22,27 |
22,30 |
Химическим и термогравиметрическим (NETZSCH STA 449F3) методами анализа был установлен химический состав соединения Ag2SnS3. Согласно результатам анализа, первая потеря массы наблюдается при 395 К. Дальнейшее потеря массы наблюдается в температурном интервале 500-950 К. Согласно потери массы и химическому анализу продуктов окисления, был установлен элементный состав соединения (табл. 2).
Из результатов анализа установлено, что в составе соединения Ag2SnS3 присутствует излишнее количество серы (0,01-0,03 %). Это количество не влияет на температуру плавления соединения.
Вывод: было получено индивидуальное соединения Ag2SnS3, в результате реакции обмена в среде этиленгликоля. Исследованы некоторые физико-химические свойства (температура плавления, параметры кристаллической решетки) этого соединения и были сравнены с литературными данными. Полученные результаты доказывают, что другие же тиостаннаты серебра можно получить этим методом.

