Процесс внутриутробного развития человека является предметом многочисленных исследований, проводимых в области гематологии, эмбриологии, акушерства, педиатрии (в т.ч. неонатологии), анатомии, гистологии, возрастной физиологии, трансплантологии. Такой интерес вызван выявлением и изучением факторов, влияющих на процессы развития плода, и условий, необходимых для рождения здорового ребенка. Одним из таких факторов является стадиоспецифическая гетерогенная система гемоглобина, включающая множество изотипов этого белка, спектр которых претерпевает изменения как в онтогенезе, так и при различных патологических состояниях [6, 7].
Особый интерес для изучения представляют антенатальные типы гемоглобина – эмбриональный (HbP) и плодовый (или фетальный – HbF), являющиеся основными типами гемоглобина во внутриутробном онтогенезе. Динамика их продукции на данном этапе развития изучена недостаточно. Одним из свойств этих белков является повышенное сродство к кислороду, что позволяет в условиях относительной внутриутробной гипоксии обеспечивать адекватное снабжение тканей плода кислородом [3, 4, 7, 10].
В последнее десятилетие отмечается повышение интереса к изучению отдельных изотипов гемоглобина и моделированию помощью иммунохимических тест-систем на эти белки [1, 2, 9]. Неоспоримым преимуществом иммунохимических методик индикации белков является их высокая специфичность и чувствительность. Кроме того, эти методы позволяют исследовать сложные биологические смеси без какой-либо предварительной очистки и выделения исследуемого протеина.
На основании вышеизложенного представляется целесообразным иммунохимическое изучение количественного соотношения эмбрионального и плодового гемоглобинов для пополнения фундаментальных сведений по динамике продукции этих белков в антенатальном онтогенезе человека в норме.
Цель исследования: иммунохимический анализ продукции эмбрионального и плодового гемоглобинов в раннем эмбриогенезе человека.
Материалы и методы исследования
Исходным биоматериалом для анализа служил абортивный материал сроком 4-12 недель, сбор которого проводили только с письменного согласия пациенток. В целях исключения негативного влияния патологических факторов внутриутробного состояния, потенциально способных исказить картину результатов данного исследования, отбор материала осуществляли только по плановым абортам, без сопутствующей патологии, проводимым с целью прерывания незапланированной беременности. В силу известных ограничений клинических показаний к плановым абортам по срокам, сбор материала со сроками гестации: до 4 недель и после 12 недель не проводился.
Материал сразу по прибытии в лабораторию промывали и подвергали сортировке при участии квалифицированных гистологов и биоморфологов. Суть процесса состояла в тщательном отделении тканей эмбриона от материнских и оболочечных тканей. Оставшиеся части взвешивались и подвергались гомогенизации механически-термическим способом. Полученная кашица подвергалась двукратному замораживанию и оттаиванию.
Экстрагирование цитозольных белков проводили добавлением в полученную гомогенную кашицу 0,9 % раствора NaCl в объемном соотношении 1:2. Для избавления от клеточных обломков взвесь центрифугировали при 8000 g в течение 30 мин, после чего осадок отбрасывали.
В ходе сбора и обработки биоматериала было получено 174 образца эмбриональных тканей, совокупность которых была разделена на 9 групп по срокам эмбриогенеза (в неделях гестационного возраста) (табл. 1).
Таблица 1
Выборка эмбрионального материала по срока гестации
|
Срок (в неделях) |
Число индивидуальных образцов |
|
4 |
14 |
|
5 |
15 |
|
6 |
18 |
|
7 |
22 |
|
8 |
21 |
|
9 |
26 |
|
10 |
24 |
|
11 |
19 |
|
12 |
15 |
|
Всего |
174 |
Для количественной калибровки стандартных проб проводили контроль концентрации HbP и HbF в них следующими способами:
- Полуколичественное определение концентрации эмбрионального гемоглобина в пробе методом иммунодиффузионного титрования по Оухтерлони, исходя из пороговой чувствительности полученной тест-системы на этот белок (4,23 ± 0,21 мг/л).
- Оптическое определение количества общего гемоглобина в пробе, определяемое унифицированным гемоглобинцианидным методом при длине волны 540 нм и толщине слоя 1 см против дистиллированной воды на спектрофотометре SPEEKOL-11 (по инструкции, утвержденной руководителем Департамента государственного контроля качества, эффективности, безопасности лекарственных средств и медицинской техники МЗ РФ 17.06.2000);
- Оптическое определение количества HbF и HbР в очищенных препаратах этих белков, определяемое аналогично.
Специфика работы с подобным биоматериалом состоит в том, что из тканей эмбрионов (4-12 недель) таких малых размеров невозможно получение их крови в чистом виде. Поэтому расчет концентрации исследуемых белков проводили не на единицу объема (мг/л), а на единицу массы исследуемого субстрата (мг/кг), конвертируемые затем для наглядности в относительные массовые доли ( %) от общего гемоглобина. При сравнительном анализе динамики продукции антенатальных гемоглобинов (HbP и HbF) в раннем эмбриогенезе, определение концентрации плодового и эмбрионального гемоглобинов проводили на единицу объема (мг/л).
Для количественного анализа изучаемых белков в биоматериале использовали специфические иммунохимические тест-системы на HbP и HbF, полученные и стандартизированные авторами самостоятельно [1, 8]. Рассчитанный порог чувствительности смоделированной тест-системы на HbP оказался равным 2,18 ± 0,32 мг/л, на HbF – 1,73 ± 0,28 мг/л.
Определение уровня HbP проводили методикой радиальной иммунодиффузии по Манчини в модификации Фехей и Мак-Келви с использованием полученного калибровочного графика.
Количественный анализ плодового гемоглобина проводили самостоятельно разработанным и запатентованным способом ракетного иммуноэлектрофореза с додецилсульфатом натрия [8].
Для оценки статистической значимости результатов исследования использовали лицензионный пакет прикладных программ статистического анализа Excel-2007 (Microsoft) и Statistica 6.0 (Stat Soft, Inc.). Для каждой выборки вычисляли средние величины (М), среднее квадратичное отклонение (σ), средние ошибки средней арифметической (m). С целью определения значимости (р) различий сопоставляемых величин применяли критерий (t) Стьюдента с поправкой Бонферрони и однофакторный дисперсионный анализ с вычислением критерия F Фишера. Различия считали значимыми при р < 0,05. Для оценки межгрупповой зависимости проводили линейный корреляционный анализ Пирсона (коэффициент корреляции – r). Корреляция считалась высокой при приближении модульной величины r к единице [5].
Результаты исследования и их обсуждение
Ниже приводятся данные по продукции и динамики концентрации эмбрионального гемоглобина в раннем эмбриогенезе человека.
Экстраполяция полученных результатов иммунохимического определения HbP показывает (табл. 2), что этот, онтогенетически самый ранний тип гемоглобина, достигает пика своей продукции на 5-й неделе гестационного возраста (ГВ), после чего его уровень неуклонно экспоненциально снижается, достигая минимума к 12-й неделе. Проведенный корреляционный анализ по Пирсону показал высокую обратную зависимость между продукцией эмбрионального гемоглобина и сроком гестации (r = – 0,879) в диапазоне с 4 по 12 неделю.
Иммунохимический количественный анализ HbF в исследуемых образцах по гестационным группам дал следующие результаты (табл. 3).
Приведенные данные дают ориентировочные сроки начала синтеза плодового гемоглобина: 4-5-я недели гестации и свидетельствуют о неуклонном экспоненциальном росте темпа продукции этого белка в раннем эмбриогенезе человека. Дисперсионный анализ свидетельствует о высокой сходимости результатов. Линейный корреляционный анализ Пирсона показал высокую степень прямой зависимости между продукцией фетального гемоглобина и сроком гестации (r = 0,932).
Проведен сравнительный анализ продукции HbF и HbP в раннем эмбриогенезе человека (4-12 недели гестации). Результаты динамики концентрации HbF и HbP в указанном диапазоне ГВ (рисунок) позволили провести анализ корреляции продукции этих протеинов по отношению друг к другу. Линейный анализ Пирсона по данным показателям показал высокий уровень обратной корреляции (r = – 0,94).
Таблица 2
Продукция HbP в раннем эмбриогенезе человека
|
Срок (в неделях) |
n |
Концентрации HbP (мг/кг) |
Стандартное отклонение (σ) |
|
4 |
13 |
61 ± 2,4 |
1,76 |
|
5 |
16 |
74 ± 3,5 |
2,2 |
|
6 |
19 |
41 ± 1,9 |
1,33 |
|
7 |
21 |
29 ± 1,4 |
0,93 |
|
8 |
20 |
22 ± 1,5 |
1,92 |
|
9 |
27 |
18 ± 1,3 |
0,86 |
|
10 |
22 |
15 ± 0,9 |
0,63 |
|
11 |
18 |
12 ± 0,9 |
0,65 |
|
12 |
14 |
9 ± 0,4 |
0,58 |
Примечание. σ по генеральной совокупности средних концентраций HbP (мг/кг) 0,55. Коэффициент дисперсии (F) = 5,7.
Таблица 3
Динамика продукции фетального гемоглобина в раннем эмбриогенезе человека
|
Срок (в неделях) |
n |
Концентрации HbF (мг/кг) |
Стандартное отклонение (σ) |
|
4 |
13 |
0,0 ± 0,0 |
0.0 |
|
5 |
16 |
4,2 ± 0,21 |
0,15 |
|
6 |
19 |
7,2 ± 0,53 |
0,36 |
|
7 |
21 |
12,1 ± 0,9 |
0,63 |
|
8 |
20 |
13,3 ± 1,2 |
2,1 |
|
9 |
27 |
13,5 ± 1,7 |
1,12 |
|
10 |
22 |
14,4 ± 1,6 |
1,22 |
|
11 |
18 |
15,6 ± 1,7 |
1,26 |
|
12 |
14 |
16,5 ± 1,8 |
1,36 |
Примечание. σ по генеральной совокупности средних концентраций HbF (мг/кг) 0,174, коэффициент дисперсии (F) = 6,4.
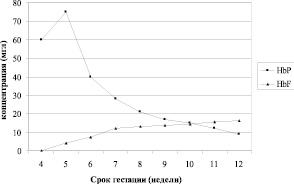
Динамика концентраций эмбрионального и плодового типов гемоглобина в раннем эмбриогенезе человека
Результаты параллельного количественного определения HbP и HbF свидетельствуют о том, что в образцах исследуемого материала оба белка выявлялись в 100 % случаев, начиная уже с 5-й недели гестации (табл. 2 и 3). На четырехнедельном сроке гестации выявляли лишь HbР в высокой концентрации, хотя пика его значения достигали на 5-й неделе ГВ. Иммунохимически зафиксировано первое появление плодового гемоглобина в эмбриональных тканях на 5-ой неделе гестации. Динамика изменений количественных показателей HbР и HbF носила разнонаправленный характер: уровень HbР плавно снижался по ходу эмбрионального развития, составляя на 8-й неделе ГВ всего 12 % от максимального значения, а уровень HbF неуклонно возрастал, превысив к 12 неделям начальные значения в 4 раза (рис. 1). Такое угасание синтеза HbР можно объяснить начинающимися после 5-й недели внутриутробного развития атрофическими процессами в желточном мешке, который является местом синтеза данного белка. Продукция HbF связана с новым этапом в развитии гемопоэза – эмбриональное и фетальное кроветворение стартует с 5-ой недели, продолжаясь до конца гестационного периода и, в отличие от внеэмбрионального, имеет органную локализацию – печень, функционирующую наиболее активно после 12-й недели внутриутробного периода.
Заключение
Показана высокая достоверная зависимость продукции антенатальных гемоглобинов от сроков гестации в раннем эмбриогенезе человека (4-12 недель гестации): для эмбрионального гемоглобина корреляция является высокой отрицательной (r = – 0,88); для плодового – высокой положительной (r = 0,93). Установлены сроки начала продукции эмбрионального гемоглобина: с 4-й недели гестационного возраста, плодового гемоглобина: с 5-й недели.

