Неотъемлемой частью сложного процесса автоматизированного проектирования медицинских технологических процессов является совершенствование инструментов характеризующих ключевые характеристики этих процессов, их качество, эффективность, безопасность. Для реализации оценки необходимо иметь полную и достоверную информацию, а также набор объективных показателей, позволяющих сравнить результаты работы медицинской организации использующей в своей работе средства автоматизированного проектирования с другими медицинскими учреждениями. В целом это одна из актуальных проблем современной клинической практики – корректное сравнение деятельности медицинских организаций, для чего используются методики бенчмаркинга.
За рубежом сравнение показателей деятельности МО находится в центре внимания общественности и профессиональных сообществ не одно десятилетие. Ввиду высокой популярности и общественной значимости больничных рейтингов, их разработчики стремятся к максимальной научной обоснованности и сбалансированности методики бенчмаркинга, использованию развитого математического аппарата и информационных технологий.
По общему признанию специалистов, бенчмаркинг является важным инструментом улучшения качества медицинской помощи, позволяет выявить стратегические пробелы в деятельности медицинской организации и обосновать направления совершенствования деятельности и тем самым улучшить конкурентоспособность учреждения на рынке медицинских услуг.
Бенчмаркинг подразумевает систематическое сравнение индикаторов (структуры, процесса и результатов) с МО, обладающими лучшими клиническими практиками, выявление межгоспитальных различий и выработку на этой основе путей совершенствования лечебной работы. Успешность бенчмаркинга опирается на надежные и актуальные данные, сбор которых не слишком обременителен для персонала. Источником данных являются медицинские информационные системы [1].
Например, в США журнал U.S. News&WorldReport с 1990 г. публикует рейтинг «Лучшие больницы Америки» по 16 терапевтическим и хирургическим специальностям [2]. Сначала методику рейтинга(«Индекс качества больниц» – IHQ)разрабатывал Национальный центр по изучению общественного мнения при Чикагском университете. С 2005 г. ее продолжает совершенствовать компания RTIInternational. В последние годы, кроме репутационного рейтинга и трех составляющих качества медицинской помощи (структуры, процессов и результата), при определении лучших больниц учитываются показатели безопасности пациентов [3]. Аналогичным европейским примером может служить Elsevier’s‘TheBestHospitals’ – рейтинг больниц Нидерландов, включающий 542 показателя, которые объединены в единый индекс по методике, разработанной совместно Организацией экономического сотрудничества и развития (ОЭСР) и Отделом прикладной статистики и эконометрики Объединенного исследовательского центра ЕС [4].
В данной работе методика бенчмаркинга применена для оценки результатов лечения пациентов с ОКС в двух медицинских организациях г. Москвы.
Сердечно-сосудистые заболевания являются лидирующей причиной смертности во многих странах мира. На долю острого коронарного синдрома(ОКС) приходится примерно 10-20 % из них в странах Европы и 5-8 % в России [5]. В результате в многочисленных крупномасштабных исследований были доказаны преимущества новых подходов к лечению ОКС, включая антиагрегантную и тромболитическую терапию, безотлагательную реваскуляризацию с помощью чрескожных коронарных вмешательств (ЧКВ). Научные достижения нашли отражение в клинических практических руководствах, содержащих четкие рекомендации для клиницистов. Выполнение этих рекомендаций имеет доказанный положительный эффект на выживаемость, частоту осложнений и качество жизни пациентов с ОКС [6]. Вместе с тем, существуют национальные и региональные особенности эпидемиологии, диагностики и течения заболевания, тактики реваскуляризации и протоколов оказания медицинской помощи этим пациентам, что так же предопределяет и некоторые различия в национальных клинических руководствах.
Кроме того, сравнение между собой результатов ЧКВ в различных учреждениях в одной или нескольких странах наталкивается на значительные трудности. Индивидуальные характеристики пациентов могут значительно увеличить риск неблагоприятного исхода, который растет непропорционально быстро увеличению тяжести ОКС [7]. Усредненные показатели исхода без поправки на тяжесть состояния пациента и другие факторы риска могут искажать истинные показатели работы, что в свою очередь может привести к незаслуженной потере репутации учреждения и ошибочным управленческим решениям [8]. Для решения этой проблемы во всём мире существует практика создания крупных проспективных кардиологических регистров. Данные регистров служат основой для построения прогностических моделей, которые позволяют анализировать результаты лечения с учетом профиля риска пациентов (case-mix), пролеченных в конкретном учреждении [9]. В последние десятилетия в мире организовано свыше 30 национальных регистров ОКС, работающих с использованием информационных технологий [10]. Опыт функционирования этих регистров показывает, что они могут быть инструментом объективной оценки результатов медицинской помощи пациентам с инфарктом миокарда и нестабильной стенокардией. В числе наиболее известных регистров по ЧКВ можно назвать CathPCI [7] как часть национального сердечно-сосудистого регистра США, международные регистры European Heart Survey ACSI и II, GRACE и EURHOBOP (EURopeanHOspitalBenchmarkingbyOutcomesin ACS Processes) [11].
Последняя версия американского регистра CathPCI содержит свыше 250 полей данных, определения и спецификации, включая демографические, клинические данные и факторы риска, показатели состояния пациента при поступлении, сведения о терапии и исходах. На базе CathPCI разработано уже четвертое обновление прогностических моделей, базирующихся на данных свыше 1,2 млн ЧКВ, выполненных в 1252 клиниках США с июля 2009 г. по июнь 2011 г. Для оценки риска внутрибольничного летального исхода с помощью логистической регрессии были разработаны 3 модели: полная (включающая данные о сосудистом поражении по результатам коронарной ангиографии), предкатетеризационная (без учета деталей сосудистого поражения) и упрощенная шкала оценки риска «у постели больного» [12]. Например, в упрощенной модели предикторными факторами риска летального исхода были: тип ОКС (с подъемом сегмента ST), возраст старше 60 лет, сниженный индекс массы тела или ожирение, заболевания периферических артерий, цереброваскулярные расстройства, хронические заболевания легких, сахарный диабет, ЧКВ в анамнезе, почечная недостаточность, IVфункциональный класс по NYHA, сниженная фракция выброса левого желудочка, остановка сердца в последние сутки, кардиогенный шок /экстренность ЧКВ. Во всех моделях в качестве факторов риска использовались наличие или отсутствие кардиогенного шока, остановка сердца, а также возраст старше 70 лет. Прогностическая точность составила 0,930 для полной модели, 0,929 – для предкатетеризационной и 0,925 для упрощенной.
Помимо факторов риска летального исхода, на основе данных регистра CathPCI были разработаны модели риска кровотечений, [13] сосудистых осложнений в области бедренного доступа, [14] почечной недостаточности после ЧКВ, [15] а также повторной госпитализации в течение 30 дней после вмешательства [16]. Авторы указывают, что помимо бенчмаркинга разработанные модели риска могут использоваться для консультирования пациентов перед вмешательством, а также разработки стандартов и программ оценки качества ЧКВ. Кроме того, регистр является бесценным хранилищем клинических данных для проведения научных исследований.
Исследование EURHOBOP было организовано для того, чтобы изучить влияние национальных особенностей лечения пациентов с ОКС в странах севера и юга Европы (Германии, Греции, Испании, Италии, Португалии, Финляндии и Франции), включая социально-экономические факторы, поскольку результаты клинических исследований свидетельствуют о существенных различиях в исходах лечения пациентов с ОКС в разных странах, а также между регионами одной страны [17]. Из 6 европейских стран в исследование EURHOBOP было отобрано по 8-10 центров, пролечивших не менее 200 пациентов с диагнозом инфаркт миокарда или нестабильная стенокардия за 2008-2010 гг. (всего 12 231 пациент). При разработке одной из моделей – риска внутрибольничной смерти после ЧКВ с помощью логистической регрессии было проанализировано 13 факторов, включая 8 пациент-специфичных (возраст, пол, гипертония, сахарный диабет, цереброваскулярные расстройства в анамнезе, тип ОКС, наличие кардиогенного шока, острого отека легких и почечной недостаточности при поступлении), а также 5 параметров, касающихся организации медицинской помощи (наличие отделения /коронарного блока интенсивной терапии, лаборатории катетеризации и кардиохирургии, университетский статус больницы). Наиболее значимыми предикторами внутрибольничной летальности после ЧКВ были возраст, диабет, тип ОКС и показатели тяжести инфаркта миокарда. Прогностическая точность модели составила 0,81 при внутренней перекрестной проверке и 0,745 при межгоспитальном тестировании [18].
Авторы полагают, что разработанная ими система бенчмаркинга, позволяет клиницистам и руководителям здравоохранения сравнивать результаты своей работы с аналогичными показателями других европейских клиник на веб-сайте быстро, просто, точно и анонимно по агрегированным данным.
У нас в стране проблема совершенствования кардиологической помощи стоит крайне остро. Россия, вместе с другими странами Восточной Европы и Центральной Азии продолжает лидировать по смертности от ишемической болезни сердца [19]. По данным Российского статистического ежегодника за 2015 г. смертность от болезней системы кровообращения в 2014 г. составила 653,9 на 100 тыс. населения, что примерно в 4,5 раза выше, чем в среднем по странам ОЭСР [20].
Государственная система здравоохранения РФ прилагает серьезные систематические усилия по повышению качества медицинской помощи пациентам с сердечно-сосудистыми заболеваниями. Снижение смертности от болезней системы кровообращения является одной из основных задач Концепции демографической политики Российской Федерации на период до 2025 года, утвержденной указом Президента Российской Федерации № 1351 от 9 октября 2007 года, и национального проекта «Здоровье». С 2008 г. в 12 пилотных регионах России начата реализация федеральной целевой программы по совершенствованию организации медицинской помощи больным с сосудистыми заболеваниями, подразумевающей оснащение медицинских учреждений новым оборудованием, подготовку и переподготовку медперсонала. В 2010 г. к ним присоединилось еще 14 регионов [21]. В рамках «сосудистой программы» оказание помощи больным с ОКС и инсультом осуществляется в региональных сосудистых центрах и первичных сосудистых отделениях. В печати появились первые работы с оценками результативности этой работы. Выявлено повышение доступности медицинских услуг, снижение опережающими темпами смертности от причин, зависящих в большей степени от деятельности системы здравоохранения (ИБС и цереброваскулярные болезни в сравнении с «другими болезнями сердца»), увеличение среднего возраста умерших от этих причин [5, 21, 22].
Для сбора данных по оказанию помощи больным с ОКС в России осенью 2008 г. сотрудниками Российского кардиологического научно-производственного комплекса (Москва) и Саратовского НИИ кардиологии при поддержке Минздравсоцразвития РФ был организован регистр ОКС [23]. Это масштабная программа с предпочтительным участием региональных сосудистых центров, осуществляемая в рамках нацпроекта «Здоровье». В настоящее время «Федеральный регистр ОКС» является многопользовательской информационной системой, функционирующей в режиме удаленного доступа через Интернет. Он призван быть инструментом учета и анализа качества медицинской помощи больным с ОКС, оказанной на догоспитальном и госпитальном этапах. Регистр предусматривает расчет индикаторов процесса для оценки выполнения рекомендованных лечебных мероприятий, а также внутрибольничную летальность пациентов с ОКС. Согласно отчету за 2014 г., включившему данные 37304 пациентов, пролеченных в 213 учреждениях 36 регионов РФ, внутрибольничная летальность варьировалась от 0 до 10,8 % [24].
Одним из первых независимых российских регистров ОКС по инициативе лаборатории клинической кардиологии ФГУ «НИИ физико-химической медицины» был создан регистр РЕКОРД за которым последовали РЕКОРД-2 и РЕКОРД-3. Основные принципы организации этих регистров: отсутствие специального отбора участников, привлечение центров самого разного уровня и оснащенности, добровольное участие и отсутствие их заинтересованности в получении того или иного результата [25].
Попытка построения прогностических моделей, позволяющих сделать поправки на индивидуальные факторы риска, была предпринята только в одной из многочисленных публикаций, посвященных анализу данных отечественных регистров ОКС [26]. Были проанализированы данные первого Московского регистра ОКС, который был организован как краткосрочная наблюдательная программа, включающая всех пациентов с ОКС, госпитализированных в стационары Москвы с 19 по 25 ноября 2012 г. Данные были получены из 32 больниц, для анализа были доступны 584 случая. Шестимесячные исходы удалось проследить у 135 пациентов, выписанных из стационара живыми (25 %). С помощью многофакторного регрессионного анализа выявлены независимые предикторы развития смерти через 6 мес. от начала ОКС. Ими стали назначение петлевых диуретиков в стационаре (отношение шансов [ОШ] 9,05; при 95 %-ном доверительном интервале [ДИ]: 1,30-62,94; P = 0,026) и неназначение клопидогрела в стационаре (ОШ = 12,81; ДИ: 1,80 – 91,21; P = 0,011). Автор отмечает, что частота смертельных исходов, развившихся после выписки из стационара, составила 8,8 % (6,3 % при ОКСпST и 9,7 % при ОКСбпST), что гораздо выше, чем в российском регистре РЕКОРД (4,8 %).
Целью настоящего исследования явилось сравнение результатов лечения ОКС и изучение возможности проведения бенчмаркинга в двух МО г. Москвы, сопоставимых по ресурсному обеспечению и оснащению. В обеих организациях в течение 4 лет проводился анализ качества медицинской помощи пациентам с ОКС, при этом в одной из них использовались элементы автоматизации медицинских технологических процессов – система автоматизации клинических руководств и аудита лечения (САКРАЛ), автоматически формирующая регистр по качеству [27].
Материалы и методы исследования
Характеристика пациентов
В исследование были включены 1514 пациентов с диагнозом инфаркт миокарда, нестабильная стенокардия или ОКС и со сроком госпитализации больше 24 часов, пролеченных в 2012-2015 гг. 1115 пациентов были госпитализированы в Национальный медико-хирургический центр им. Н.И. Пирогова (НМХЦ), 399 пациентов – в Медицинском центре Банка России (МЦ).
Диагноз устанавливали в соответствии с медународными критериями. [28]Клиническая характеристика пациентов представлена в табл. 1.
Таблица 1
Клиническая характеристика пациентов
|
Показатель |
МЦ, n = 399 |
НМХЦ, n = 1115 |
р |
|
Средний возраст (M ± m) |
70,6 ± 11,7 |
59 ± 9 |
> 0,05 |
|
Женщины, абс. ( %) |
161 (40,5 %) |
256 (23 %) |
< 0,001 |
|
Факторы риска, абс. ( %) |
|||
|
Курение |
85 (21,4 %) |
557 (50 %) |
< 0,001 |
|
Сахарный диабет |
143 (35,9 %) |
167 (15 %) |
< 0,001 |
|
Артериальная гипертензия |
379 (95,2 %) |
914 (82 %) |
< 0,001 |
|
Дислипидемия |
292 (73,4 %) |
923 (82,8 %) |
< 0,001 |
|
Заболевания/состояния, абс. ( %) |
|||
|
Инфаркт миокарда в анамнезе |
179 (45,0 %) |
167 (15 %) |
< 0,001 |
|
НМК в анамнезе |
56 (14,1 %) |
56 (5 %) |
< 0,001 |
|
Стентирование в анамнезе |
103 (25,9 %) |
187 (16,8 %) |
< 0,001 |
|
АКШ в анамнезе |
22 (5,5 %) |
23 (2,1 %) |
< 0,001 |
|
Оценка состояния пациентов при госпитализации, абс. ( %) |
|||
|
ОКС с подъемом ST |
56 (14 %) |
653 (58 %) |
< 0,001 |
|
ОКС безподъема ST |
343 (86 %) |
462 (42 %) |
< 0,001 |
|
Остраясердечнаянедостаточность |
226 (56,6 %) |
134 (12 %) |
< 0,001 |
|
– 2-й класспоKillip |
22 (11,3 %) |
9 (7 %) |
0,320 |
|
– 3-й класспоKillip |
9 (4,6 %) |
3 (2 %) |
0,370 |
|
– 4-й класспоKillip |
7 (3,6 %) |
4 (3 %) |
0,950 |
|
АВ-блокада II–III степени |
11 (2,8 %) |
33 (3 %) |
0,840 |
|
GRACE 140 баллов, абс ( %) |
143 (42,3 %) |
207 (45 %) |
0,378 |
|
TIMI (STEMI) 6 баллов, абс ( %) |
29 (60,4 %) |
124 (19 %) |
< 0,001 |
Примечания. АКШ – аорто-коронарное шунтирование, НМК – нарушение мозгового кровообращения, ОКС – острый коронарный синдром. Где n – число пациентов; p – достоверность различий.
В целом, пациенты, госпитализированные в МЦ, были старше, достоверно чаще имели сопутствующие артериальную гипертензию и сахарный диабет, а также инфаркт миокарда, нарушения мозгового кровообращения и стентирование коронарных артерий в анамнезе. При этом доля больных с ОКСпST была достоверно выше в НМХЦ.
Анализ выполнения рекомендованных лечебно-диагностических рекомендаций у пациентов с ОКС
Анализ качества медицинской помощи пациентам с ОКС проводили в соответствии с индикаторами качества, отражающими процесс, результаты и безопасность лечения. В качестве индикаторов процесса, отражающих выполнение клинических рекомендаций по ведению пациентов с ОКС, были использованы:
1) доля больных с ОКС (ОКСпST и ОКСбпST), которым проводилось ЧКВ;
2) доля больных с ОКСпST, которым проведена тромболитическая терапия (ТЛТ);
3) доля больных с ОКСпST, которым ЧКВ выполнено в течение 90 минут после развития симптомов;
4) доля больных с ОКС, получавших в стационаре и при выписке:
а) ацетилсалициловую кислоту;
б) клопидогрел/тикагрелор;
в) низкомолекулярные гепарины /нефракционированный гепарин;
г) β-адреноблокаторы;
д) ингибиторыангиотензин-превращающего фермента /антагонисты рецепторов ангиотензина II (И-АПФ/АРА);
е) двойную антиагрегантную терапию (ДААТ);
ж) статины;
з) комбинации лекарственных средств (ДААТ + β-АБ + иАПФ/АРА + статины).
Для всех индикаторов доля рассчитывалась от количества пациентов, не имеющих противопоказаний для соответствующей терапии.
Индикаторы безопасности включали:
1) осложнения, связанные с сосудистым доступом;
2) тромбоз стента в период госпитализации;
3) катетер-ассоциированная инфекция кровотока.
В качестве индикаторов результата анализировали:
1) внутрибольничную летальность;
2) развитие нового инфаркта миокарда в период госпитализации, в т.ч. ассоциированного с ЧКВ;
3) развитие инсульта/ ТИА в период госпитализации;
4) крупные кровотечения (по критериям BARC – Bleeding Academic Research Consortium Definition);
Кроме того, вычисляли агрегированные индикаторы:
1) средний показатель выполнения рекомендаций;
2) суммарный показатель неблагоприятных клинических (сердечно-сосудистых) исходов;
3) суммарный показатель безопасности.
Источником данных для анализа служили в МЦ – САКРАЛ, в НМХЦ – медицинская информационная система MSClinic.
Для поправок на риск использовали модели прогноза внутрибольничной летальности и кровотечений, разработанные на базе данных регистра CathPCI [12, 13].
Статистическая обработка результатов проведена с использованием программы IBM SPSS Statistics 20. Категориальные и номинальные переменные сравнивали с помощью критерия (χ2) – Пирсона. При малом числе наблюдений для таблиц 2*2 применялся точный критерий Фишера. Для сравнения средних по независимым выборкам использовался t-критерий Стьюдента. Различия считались достоверными при р < 0,05.
Таблица 2
Поправка для результатов чрескожных коронарных вмешательств в МЦ (по моделям риска CathPCI)
|
Внутрибольничная смерть |
Кровотечения |
|
|
Фактическоезначение (Ф) |
5,0 % |
4,8 % |
|
Прогнозное значение (П) |
2,1 % |
7,5 % |
|
Поправка на риск (Ф/П) |
2,38 |
0,64 |
|
Показатель с поправкой на риск |
3,3 % |
3,7 % |
Результаты исследования и их обсуждение
Процессные индикаторы
В обоих учреждения уровень соблюдения рекомендаций по лечению пациентов с ОКСпST был достаточно высоким, за исключением тромболитической терапии в МЦ, которая была выполнена лишь трем пациентам (5,8 %) и назначения НМГ/НФГ – 54 пациентам (66,1 %) (р < 0,001). В НМХЦ ТЛТ выполнялась значимо чаще – 425 (65,1 %) пациентам (р < 0,001), в т.ч., 56,5 % с положительным клиническим эффектом (рис. 1).
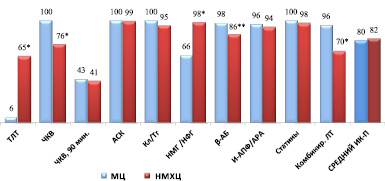
Рис. 1. Процент выполнения индикаторов процесса прилечении пациентов с ОКСпST в стационаре. Примечания: * – достоверность различий р < 0,001; ** – достоверность различий р < 0,05. Сокращения: АСК: ацетилсалициловая кислота; β-АБ: бета-адреноблокаторы; И-АПФ /АРА: ингибиторы ангиотензин-превращающего фермента /антагонисты рецепторов ангиотензина II; Кл /Тг: Клопидогрел /тикагрелор, Комбир. ЛТ: комбинированная лекарственная терапия: ДААТ+ β-АБ + иАПФ/АРА + статины; МЦ: Медицинский центр Банка России; НМГ/НФГ: низкомолекулярные гепарины /нефракционированный гепарин; НМХЦ: Национальный медико-хирургический центр; ТЛТ: Тромболитическая терапия, ЧКВ: чрескожное коронарное вмешательство
В свою очередь, в НМХЦ достоверно реже выполняли ЧКВ и назначали комбинированную терапию в стационаре (р < 0,001 для обоих индикаторов). В первые 90 мин ЧКВ было выполнено 42,9 % пациентам с ОКСпST в МЦ и 40,7 % пациентов в НМХЦ (р = 0,322). Среднее время от поступления до выполнения первичного ЧКВ составило 5,2 ± 4,7 ч в МЦ и 2,5 ч в НМХЦ. Усредненная величина индикаторов процесса при лечении пациентов с ОКСпSTсоставила 80,5 % в МЦ и 82,2 % в НМХЦ (различия недостоверны) (рис. 1).
Для пациентов с ОКСбпST средний процент выполнения рекомендаций был достоверно выше в МЦ, хотя частота назначения НМГ /НФГ была выше в НМХЦ (рис. 2).
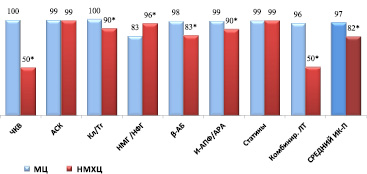
Рис. 2. Процент выполнения индикаторов процесса при лечении пациентов с ОКСбпST в стационаре. Примечания: * – достоверность различий, р < 0,001. Сокращения: как на рис. 1
В обоих стационарах ЧКВ чаще всего выполнялось в первые 24 ч от развития симптомов (59 % и 68 %, соответственно).
В обоих стационарах отмечен высокий уровень назначения рекомендованной медикаментозной терапии при выписке пациентов с ОКС из стационара (рис. 3).
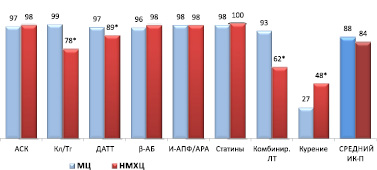
Рис. 3. Процент выполнения индикаторов процесса при выписке пациентов из стационара (ОКСпST + ОКСбпST). Примечания: * – различия достоверны, р < 0,001. Сокращения: как на рис. 1
Достоверные различия наблюдались только по назначению И-АПФ/АРА, ДАТТ, комбинированной терапии. Кроме того, письменные рекомендации по отказу от курения были даны 27,1 % курящих пациентов в МЦ и 47,5 % пациентов в НМХЦ (р < 0,001).
Индикаторы безопасности
Суммарная частота специфических осложнений, связанных с ведением пациента после ЧКВ (индикаторы безопасности), была достоверно выше в НМХЦ, чем в МЦ (3,9 % против 16,1 %, соответственно, р = 0,0001) (рис. 4).
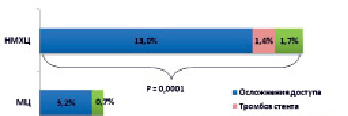
Рис. 4. Индикаторы безопасности у пациентов с ОКС
При этом основной вклад в снижение безопасности в НМХЦ внесли осложнения, связанные с сосудистым доступом (95 случаев, 13,0 %). В МЦ доля использования радиального доступа за анализируемый период постепенно увеличивалась, и этим, вероятно, объясняется достоверно меньшее значение этого показателя.
Индикаторы результата
Суммарная частота неблагоприятных клинических исходов, включая внутрибольничную смерть, повторный ИМ, инсульт /ТИА и крупные кровотечения в МЦ были достоверно выше по сравнению с НМХЦ (13,3 % против 7,1 %, соответственно, р = 0,0005), несмотря на то, что выполнение рекомендаций по лечению пациентов с ОКС в двух организациях было сравнимым, а показатели безопасности в МЦ были достоверно лучше (рис. 5).
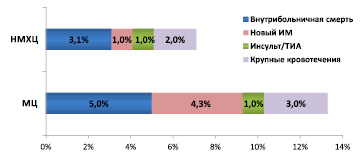
Рис. 5. Частота неблагоприятных исходов у пациентов с ОКС
Госпитальная летальность среди пациентов с ОКСпST составила 7,1 % в ММЦ и 3,6 % в НМХЦ (р = 0,2), среди пациентов с ОКСбпST – 4,7 % и 2,4 %, соответственно (р = 0,075).
Новый инфаркт миокарда в период госпитализации в МЦ развился у 3,6 % пациентов с ОКСпST и у 4,4 % пациентов с ОКСбпST. В НМХЦ частота развития нового ИМ в период госпитализации у пациентов с ОКСпST составила 1,2 % (р = 0,72), у пациентов с ОКСбпST – у 0,6 % (р < 0,001). Случаи нарушение мозгового кровообращения отмечались у 1 % пациентов с ОКС в МЦ и в НМХЦ (р = 0,978).
Случаи крупных кровотечений отмечены у 12 (3 %) пациентов, госпитализированных в МЦ, и у 22 (2 %) пациентов в НМХЦ (р = 0,231).
Более высокий уровень летальности пациентов с ОКС в МЦ по сравнению с НМХЦ, возможно, объясняется тем, что пациенты были старше, имели больше сопутствующей патологии, а также более тяжелое течение ОКС при поступлении. В частности, из 179 пациентов, у которых риск неблагоприятного исхода по шкале GRACE был высоким (>140 баллов), внутрибольничная летальность составила 2,8 % (n = 5), что не превышает прогнозируемый данной шкалой уровень в 3 % [29].
Для проверки этой гипотезы по данным всех пролеченных в ММЦ пациентов с ОКС был рассчитан риск внутрибольничной летальности и кровотечений с использованием соответствующих моделей, разработанных на базе регистра CathPCI.
Прогнозируемая внутрибольничная летальность составила 2,1 % (табл. 2).
Как и ожидалось, наибольший вклад в повышение риска для выборки пациентов ММЦ внесли факторы возраста, наличия сердечной недостаточности и экстренности вмешательства. Чтобы получить величину внутрибольничной летальности с поправкой на риск, необходимо соотношение фактической к прогнозируемой летальности умножить на усредненный показатель летальности. В выборке, на которой была разработана модель, он был равен 1,4 %; таким образом, стандартизованная летальность для ММЦ составит 3,3 % (1,4*5,0/2,1), что соответствует10-му процентилю среди больниц, участвовавших в регистре CathPCI по отчету за 2014 г.
Прогноз геморрагических осложнений в МЦ оказался значительно выше реальной частоты кровотечений – 7,5 % против 4,8 %, соответственно (табл. 2). Заметим, что согласно определению CathPCIк геморрагическим осложнениям относились не только крупные кровотечения, но и гематомы в области сосудистого доступа, а также кровотечения ЖКТ. Усредненный показатель частоты кровотечений по модели был равен 5,8 %, таким образом, частота кровотечений с поправкой на риск для МЦ составила 3,7 %. По этому показателю МЦ оказался в 75-м процентиле среди больниц регистра CathPCI.
Количественное измерение качества медицинской помощи, клинических регистров по качеству, измерение результатов оказания медицинской помощи, автоматизированное проектирование медицинских технологических процессов являются взаимосвязанными проблемами. В клинических регистрах накапливают данные, которые служат основой не только для оценки качества медицинской помощи, но и позволяют широко применять интеллектуальный анализ данных для моделирования характера течения и исходов заболеваний, оценки эффективности различных методов лечения, систем организации медицинской помощи.
Между тем, сбор данных из различных медицинских учреждений в межгоспитальных регистрах приводит к своеобразному внутреннему «конфликту» данных, порождаемому различной лечебно-тактической ситуацией в каждой из больниц, направляющих данные в регистр. Безусловно, выравнивание степени оснащенности больниц, повсеместное использование клинических руководств, способствующих «естественной» унификации оказания медицинской помощи, в известной степени нивелирует остроту этой проблемы.
Кроме того, ведение клинических регистров требует существенных дополнительных усилий со стороны практикующих врачей, особенно, если данные в регистр собираются «вручную». Ретроспективное внесение данных чревато неточностями и искажениями. Автоматизация проектирования планов ведения пациентов, проспективное заполнение и автоматическое формирование регистра, во многом облегчает эти трудности.
Данные клинических регистров используются не только для исследовательских целей. Частично данные регистров стали доступны широкой общественности для составления рейтингов медицинских учреждений. Они активно используются страховыми и финансирующими организациями. Стандартизация индикаторов качества и внесение корректирующих поправок позволяют сделать корректное сравнение деятельности больниц. Например, в данной работе выполнение индикаторов процесса и индикаторы безопасности в двух сравниваемых больницах было примерно одинаковым или лучше в МЦ, но при этом суммарная частота неблагоприятных исходов ЧКВ в МЦ была достоверно выше (13,3 % против 7,1 % в НМХЦ). Напрашивается предположение о влиянии исходных характеристик пациентов (старший возраст, сопутствующая патология, тяжесть ОКС) на результаты лечения, но без строгих количественных поправок это предположение остается недоказанным.
Создатели клинических регистров за рубежом уделяют много внимания разработке моделей поправок на риск при вычислении показателей деятельности. Использованная в данной работе поправка на риск, рассчитанная для регистра CathPCI, уменьшила показатель внутрибольничной летальности в МЦ примерно на одну треть – с 5 % до 3,3 %. Применение «чужих» прогностических моделей при вычислении стандартизованных показателей, с одной стороны, дает возможность сравнить результаты деятельности с зарубежными больницами, но с другой стороны, может неадекватно учитывать набор и вклад прогностических факторов, влияющих на исходы лечения в отечественных стационарах. В частности, при сравнении с данными регистра CathPCI мы не учитывали такие факторы, как размер больницы и число выполняемых процедур, поэтому приведенные расчеты можно рассматривать только как пример бенчмаркинга. В связи с этим, необходима разработка моделей и методик поправок на риск по данным российских клинических регистров.
Выводы
1. Сравнительный анализ лечебных учреждений, одно из которых использовало систему автоматического заполнения регистра по качеству средствами автоматизирования клинических руководств показал, что автоматизация важнейшего элемента лечебно-диагностического процесса (принятие решения о выборе плана лечения) не ведет к ухудшению качества оказания медицинской помощи, но освобождает врача от рутинной работы по заполнению регистра.
2. Использование поправок на риск важнейший элемент корректного бенчмаркинга. Установлено, что их применение существенно (66 %) изменяет величину оценочной характеристики (согласно данным табл. 2).
3. Использование стандартизованных индикаторов качества для сравнения деятельности больниц позволяет оценить реальное положение дел в учреждении, выявить резервы для совершенствования организации медицинской помощи. При расчете стандартизованных показателей необходимо максимально использовать данные больничных информационных систем и систем поддержки принятия решений.

