Pseudomonas aeruginosa обладает различными факторами вирулентности, одним из которых является липополисахарид (ЛПС). Он накапливается в организме при лизисе бактериальных клеток и вызывает разнообразные поражения организма. При этом в окружающую среду выделяются и разнообразные ферменты, в частности, ферменты энергетического обмена. Ранее для крыс было показано in vitro выделение гепатоцитами АСТ и АЛТ в ответ на ЛПС изолятов P. aeruginosa и влияние этих ферментов на дыхание активированных данными ЛПС перитонеальных клеток (ПК), при этом дыхание зависит от активности АЛТ и АСТ [1]. Также было показано, что дыхание перитонеальных клеток морской свинки при фагоцитозе клеток Mycobacterium bovis стимулируется АЛТ и АСТ in vitro [2].
Целью данной работы было обнаружение способности культур вирулентных и авирулентных изолятов P. aeruginosa выделять в среду ферментативные активности АСТ и АЛТ, и определение характера влияния указанных ферментов на дыхание перитонеальных клеток мыши и морской свинки в присутствии ЛПС указанных изолятов псевдомонад.
Материалы и методы исследования
В работе использовались изоляты P. aeruginosa 4, 8 (вирулентные), 11, 12, (авирулентные). Из суточных культур изолятов на жидкой среде № 8 (Оболенск) получали очищенные центрифугированием (20000g, 40 мин) культуральные жидкости (КЖ) и клетки бактерии. В полученных супернатантах определяли концентрацию белка, активность АСТ, АЛТ и рассчитывали отношение АСТ/АЛТ (коэффициент Де Ритиса) [3]. Из клеток изолятов получали ЛПС по Вестфалю [6].
Определяли дыхание перитонеальных клеток (ПК) в тесте восстановления нитросинего тетразолия (тест НСТ) [5, 7, 8] при ответе на ЛПС P. aeruginosa 8 в зависимости от концентрации пирувата и α-кетоглутарата. ПК мыши и морской свинки (от 10 животных каждого вида) суспендировали в среде ДМЕМ до концентраций 1 млн клеток/мл; в суспензии вносили нитросиний тетразолий (НСТ) до конечной концентрации 0,01 %. Суспензии ПК делили на ряд аликвот, в аликвоты, кроме контрольной, вносили ЛПС P. aeruginosa 8 до конечной концентрации 4 мкг/мл. В аликвоты суспензий ПК добавляли пируват в концентрациях 54 – 120 мкМ/л, α-кетоглутарат – от 23 до 51 мкМ/л и их сочетания. Суспензии ПК инкубировали 1 час при 37 °С, определяли накопление формазана спектрофотометрически.
Влияние культуральных жидкостей изолятов P. aeruginosa на дыхание ПК определяли аналогично описанному выше. ПК мыши и морской свинки суспендировали в среде 199, добавляли 1/10 объема КЖ, получая суспензии 1 млн клеток/мл, вносили ЛПС соответствующего изолята до 4 мкг/мл и определяли накопление формазана в тесте НСТ.
Определяли коэффициенты корреляции Пирсона и множественной корреляции между дыханием ПК в тесте НСТ и концентрациями пирувата и α-кетоглутарата, а также активностями АЛТ, АСТ и значениями коэффициента Де Ритиса [4].
Результаты исследования и их обсуждение
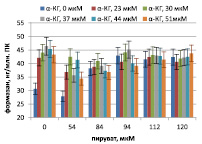
Накопление формазана в тесте НСТ ПК мыши и морской свинки, стимулированных ЛПС P. aeruginosa 8, в присутствии пирувата и α-кетоглутарата представлено на рисунке. ЛПС стимулирует дыхание, дыхание контрольных ПК мыши составляет 27 ± 6 нг/млн. клеток, контрольных ПК морской свинки – 34 ± 5 нг/млн. клеток. А-кетоглутарат и пируват стимулируют дыхание ПК, причем первый заметно сильнее при 37 мкМ, второй – при 94 мкМ. При этом максимум дыхания ПК как мыши, так и морской свинки достигается при сочетании пируват/αp>
Корреляционный анализ более отчетливо выявляет связь дыхания с пируватом и α-кетоглутаратом (табл. 1).
А Б
Дыхание перитонеальных клеток мышей (А) и морских свинок (Б), стимулированных ЛПС P. aeruginosa 8, в присутствии пирувата и α-кетоглутарата (α-КГ)
Таблица 1
Значения коэффициентов корреляции Пирсона (r) и множественной корреляции (R) дыхания перитонеальных клеток мыши и морской свинки с пируватом и α-кетоглутаратом в присутствии ЛПС P. Aeruginosa 8
|
НСТ ПК мыши |
НСТ ПК морской свинки |
||
|
Пируват, r |
С чистым пируватом |
+ 0,83 |
+ 0.46 |
|
В присутствии α-кетоглутарата |
+ 0,96 |
+ 0.89 |
|
|
α-кетоглутарат, r |
С чистым α-кетоглутаратом |
+ 0,86 |
+ 0.43 |
|
В присутствии пирувата |
+ 0,93 |
+ 0.87 |
|
|
Корреляция с парой пируват/α-кетоглутарат, R |
0,96 |
0.90 |
|
Примечание: жирным шрифтом выделены достоверные значения коэффициентов корреляции (p < 0.05).
Дыхание ПК мыши связано с обеими кетокислотами вместе и с каждой из них в отдельности, однако и дыхание ПК морской свинки в присутствии обеих кетокислот связано с каждой из них. Об этом же свидетельствуют высокие достоверные коэффициенты множественной корреляции дыхания ПК с парой пируват/α-кетоглутарат, т.е. обе кетокислоты стимулируют дыхание ПК обоих видов животных. Результат вполне объясним тем, что эти кетокислоты утилизируются в цикле Кребса, рост их концентрации в среде позволяет усилить дыхательный метаболизм ПК при ответе на антиген.
Изоляты P. aeruginosa выделяют в культуральную жидкость заметное количество белка и активности АСТ и АЛТ (табл. 2). Выделение ферментативных активностей соотносится с выделением белка и не имеет выраженной связи с вирулентностью изолята.
Таблица 2
Биохимические параметры культуральных жидкостей изолятов P. aeruginosa
|
изолят |
Белок, г/л |
АСТ, нкат/л |
АЛТ, нкат/л |
Коэффициент Де Ритиса |
|
|
вирулентные |
4 |
0,49 ± 0,1 |
0,47 ± 0,1 |
0,20 ± 0,1 |
2,31 ± 0,3 |
|
8 |
1,82 ± 0,3 |
3,92 ± 0,5 |
1,00 ± 0,2 |
3,91 ± 0,5 |
|
|
авирулентные |
11 |
0,99 ± 0,2 |
2,60 ± 0,4 |
0,45 ± 0,1 |
5,67 ± 0,6 |
|
12 |
1,53 ± 0,2 |
0,73 ± 0,2 |
0,33 ± 0,1 |
2,26 ± 0,3 |
Культуральные жидкости в сочетании с ЛПС изолятов P. aeruginosa оказывают стимулирующее влияние на дыхание ПК, причем это влияние мало зависит от вирулентности изолята (табл. 3).
Таблица 3
Накопление формазана перитонеальными клетками (ПК) морской свинки и мыши в присутствии культуральных жидкостей (КЖ) и липополисахарида (ЛПС) изолятов P. aeruginosa, нг формазана на млн. ПК
|
Вирулентные изоляты |
Авирулентные изоляты |
Среда ДМЕМ |
|||
|
КЖ + ЛПС изолята 4 |
КЖ + ЛПС изолята 8 |
КЖ + ЛПС изолята 11 |
КЖ + ЛПС изолята 12 |
||
|
ПК морской свинки |
14,1 ± 1,6 |
19,7 ± 6,1 |
20,6 ± 4,7 |
17,9 ± 2,6 |
11,9 ± 1,5 |
|
ПК мыши |
8,4 ± 0,6 |
8,9 ± 0,7 |
8,7 ± 0,9 |
8,4 ± 0,7 |
7,8 ± 0,5 |
Примечание: жирным шрифтом выделены значения, достоверно отличающиеся от контроля (p < 0.05).
Дыхание перитонеальных клеток положительно связано с активностями АЛТ и АСТ, а также с коэффициентом Де Ритиса, о чем свидетельствуют значения коэффициентов корреляции Пирсона между дыханием ПК и указанными биохимическими параметрами КЖ (табл. 4).
Таблица 4
Значения коэффициентов корреляции Пирсона дыхания перитонеальных клеток (ПК) мыши и морской свинки с активностью АЛТ, АСТ и коэффициентом Де Ритиса в присутствии ЛПС P. aeruginosa
|
ПК мыши |
ПК морской свинки |
|
|
Корреляция с АЛТ |
+ 0,69 |
+ 0,67 |
|
Корреляция с АСТ |
+ 0,65 |
+ 0,70 |
|
Корреляция с коэффициентом Де Ритиса |
+ 0,60 |
+ 0,42 |
Примечание: жирным шрифтом выделены достоверные значения коэффициентов корреляции (p < 0.05).
В среде ДМЕМ отсутствовали специфические факторы регуляции активности перитонеальных клеток со стороны макроорганизма (комплемент, интерлейкины и т.д.), это означает, что действие трансаминаз на дыхание связано именно с катализируемыми трансаминазами биохимическими реакциями.
АЛТ катализирует обратимое превращение L-аланина и α-кетоглутарата в пируват и L-глутматат, АСТ стимулирует обратимое превращение L-аспартата и α-кетоглутарата в оксалоацетат и L-глутматат. Сопряженные реакции, катализируемые АЛТ и АСТ, способны поддерживать равновесную концентрацию кетокислот, причем повышенная активность АЛТ ведет к накоплению в среде пирувата, АСТ – к накоплению α-кетоглутарата, т.е. кетокислот, стимулирующих дыхание перитонеальных клеток (табл. 1). Таким образом, положительная связь дыхания перитонеальных клеток с активностью трансаминаз АЛТ и АСТ может объясняться поддержанием оптимальных для дыхательного метаболизма ПК концентраций кетокислот, в частности – пирувата и α-кетоглутарата.
Заключение
Pseudomonas aeruginosa способен стимулировать ответ перитонеальных клеток не только за счет своего эндотоксина – ЛПС, но также выделяемых из клеток бактерии трансаминаз АЛТ и АСТ. В действии АЛТ и АСТ на дыхание перитонеальных клеток проявляется стимулирующее влияние непосредственно на метаболический статус через концентрацию субстратов цикла Кребса – пирувата и α-кетоглутарата.

