В настоящее время строительные материалы с использованием серы находят все большее применение. Связано это с огромным количеством образующихся отходов нефтегазового комплекса и эксплуатационным преимуществом получаемых материалов по сравнению с традиционными [1]. Огромное значение для формирования свойств серобитумных композиционных материалов играет химическое взаимодействие между компонентами. Реакционная способность серы и механизм ее реакций с различными органическими соединениями – составными частями битума – зависит, прежде всего, от уникального электронного строения серы. Одновременное наличие вакантных d-орбиталей и неподеленных электронных пар в молекуле серы является определяющим в каждом отдельном случае.
Известен из практики факт устойчивости серы к воздействию большинства кислот и солей – акцепторам электронной пары [2]. Сера взаимодействует только с серной кислотой с концентрацией выше 70 %, с азотной кислотой с концентрацией выше 50 %, с хромовой и плавиковой кислотами. При этом сера взаимодействует не с протоном водорода, а с более сильным окислителями – анионами по схеме:
S + 6HNO3 = H2SO4 + 6NO2 + H2O
S + 2H2SO4 = 3SO2 + 2H2O
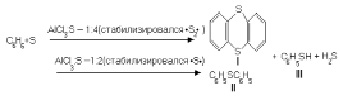
При прохождении реакции серы в присутствии более сильных акцепторов свойства конечного продукта реакции напрямую зависят от концентрации акцептора, чем больше его введено, тем более устойчивы более мелкие радикалы [3], а из бензола образуются тиантрен (I), дифенилсульфид (II), тиофен (III).
К щелочам – донорам электронной пары – сера не устойчива.
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O.
Причем доноры электронной пары могут и принимать участие в реакции серы, и просто ее активировать, например, жидкий аммиак, который прекрасно растворяет кристаллическую серу.
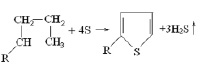
Обычно реакции серы с органическими веществами проходят по центрам напряжения в молекуле, двойным связям и более полярным связям. Так, при реакции с низшими алкенами реакция проходит не по менее прочной связи С – С (320 кДж/моль), а по связи С-Н более прочной (420 кДж/моль) и более полярной [3]:
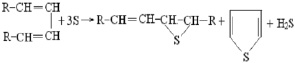
При реакции серы с алкадиенами, имеющими сопряжённую двойную связь, образуются циклосульфиды или тиокетоны. В последнем случае отщепляется сероводород. Реакция идёт за счёт замыкания тиофенового цикла. При этом одна или обе связи могут оказаться незатронутыми [3]:
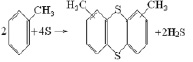
Отмечается, что при реакции с ароматическими углеводородами сера вообще не взаимодействует с π-облаками ароматического кольца, а только гидрогенизирует их с образованием тиофенолов, дисульфидов либо подобных тионтрену структур. Это связано с тем, что в ароматическом кольце электронная плотность равномерно распределена между атомами углерода и оттянута от водорода или имеющихся углеродных заместителей.
Для объяснения поведения серы при взаимодействии с электрофильными и нуклеофильными реагентами были проведены квантово-химические исследования с использованием программы B3LYP/6-311g(d,p) пакета программ Gaussian 98.
Как показали результаты исследований, высшая занятая молекулярная орбиталь (ВЗМО) молекулы S8 (рис. 1) обладает ярко выраженной связующей π-электронной частью по центральной линии, вдоль которой расположены атомы серы.
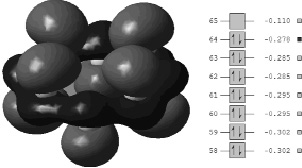
Рис. 1. Структура молекулы S8 при нормальных условиях
При взаимодействии с такими ярко выпаженными донорами электронной пары как ОН–, NH3, у молекулы будет заполняться низшая свободная молекулярная орбиталь (НСМО), характерная тем, что связыванию подвергаются независимо две половины молекулы (рис. 2).
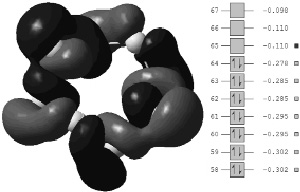
Рис. 2. Структура молекулы S8 при взаимодействии с донорами электронной пары
Соответственно, это будет способствовать ее разрыву по несвязанной области, и распаду молекулы на два независимых радикала S4.
При взаимодействии с акцепторами электронной пары определенную роль начинает играть орбиталь, расположенная под ВЗМО. Отщепление электронной пары также будет способствовать разрыву молекулы по несвязанной области и образованию радикалов (рис. 3).
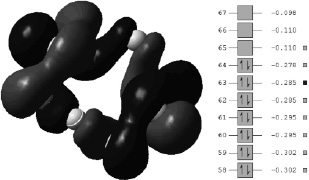
Рис. 3. Структура молекулы S8 при взаимодействии с акцепторами электронной пары
Установлено, что для разрыва молекулы S8 достаточно присоединение одной электронной пары. При удалении из молекулы серы электронов, благодаря наличию π-орбитали, процесс проходит более затруднительно и возможен только в присутствии сильных акцепторов, например, соединений алюминия.
Выводы
Таким образом, в реакциях серы с органическими веществами возможны два механизма взаимодействия – электрофильный и нуклеофильный, заключающиеся в ослаблении химической связи между атомами серы в молекуле, разрыву ее с образованием преимущественно четырехатомных радикалов. Нуклеофильная атака протекает довольно просто, электрофильный механизм затруднен наличием π-орбитали и требует присутствия сильных акцепторов электронной пары.

