Сульфанилзамещенные производные пятичленного гетероцикла 1,2,4- триазола известны своими ценными физиологическими – антибактериальными, антивирусными, противоопухолевыми и др. свойствами [3, 4], и поэтому исследования по созданию более эффективных представителей этого ряда все еще актуальны. Продолжая работы по изысканию биологически активных соединений среди новых производных 1,2,4- триазола [5, 6] в настоящей работе предпринят синтез 3,4,5 – три замещенных 4H- 1,2,4- триазолов, которые в отличие от предыдущих, в положении 3 гетероцикла содержат 3-хлор-4- изопропоксибензильную группу. Подобный выбор обусловлен тем, что 1,2,4 – триазолы, содержащие замещенные бензильные группы относительно мало изучены, а введение изопропильного заместителя по некоторым данным способствует понижению токсичности веществ [2]. Синтез намеченных соединений осуществлен по схеме.
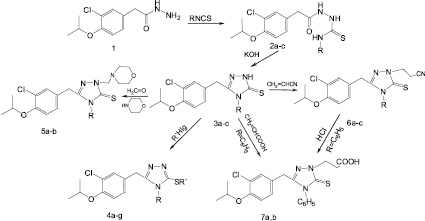
2,3 a-c. R=C6H5 (a), CH2C6H5 (b), CH2CH=CH2 (c).
4a-g. R=C6H5, R`=CH2COOH (a), R`=(CH2)2COOH (b), R=CH2C6H5, R`=CH2CONH2(c), R`=CH2COOC2H5 (d), R`=CH2CH2OH (e), R`=CH(CH3)COOH (f), R= CH2CH=CH2, R`=CH2CONH2 (g);
5,6 a-c. R=C6H5 (a), CH2C6H5 (b), CH2CH=CH2(c)
Обсуждение результатов
Как видно из схемы, ключевыми соединениями выбраны 1,4-дизамещенные тиосемикарбазиды 2а-с, синтезированные взаимодействием гидразида 3-хлор -4- изопропоксифенилуксусной кислоты (1) с фенил -, бензил – и аллилизотиоцианатами при кипячении в этаноле [1]. Внутримолекулярной циклизацией тиосемикарбазидов 2а-с в водно щелочной среде и последующим подкислением реакционной смеси ледяной уксусной кислотой были получены 3,4- дизамещенные 4H- 1,2,4- триазол- 5- тиолы 3а-с в виде безцветных кристаллических веществ.
С целью получения сульфанилзамещенных 4H- 1,2,4 -триазолов 4а-g с параллельным введением в молекулу эффективных фармакофорных групп, была исследована реакция SH-алкилирования триазолтиолов 3а-с различными галогенидами, содержащими карбоксильную, гидроксильную, карбоксамидную и др. группы в присутствии щелочи. Подобраны оптимальные условия реакции для каждого алкилирующего реагента, обеспечивающие хорошие выходы (60-80 %) соединений 4а-g. Установлено, что алкилирование галогенидами алифатических кислот протекает в водной среде при использовании трехкратного избытка KOH, а в случаях остальных алкилирующих реагентов, достаточно кипячение в спиртовой среде в присутствии эквимольного количества KOH. Отсутствие в ИК спектрах триазолов 4а-g SH – полосы поглощения в облости 2600-2500 см-1 и наличие сигналов протонов группы SCH2 в области 3.82-4.20 м.д. в спектрах ЯМР1H однозначно подтверждают протекание реакции алкилирования по SH тиольной группе триазолов 3a-c.
Для сравнения биологических свойств и выявления возможной связи химической структуры соединений с биологической активностью помимо S – замещенных триазолов 4a-g были получены также N -замещенные 1,2,4 -триазолы 5-6 реакциями аминометилирования и цианэтилирования исходных 1,2,4 – триазолов 3a-c.
Аминометилирование триазолов 3a-c, приведшее к соответствующим основаниям Манниха 5a-c, проводилось в метаноле с применением избытка вторичного амина морфолина и формалина при комнатной (20-25 °C) температуре. Полученные 1- N-морфолинометилен- 1,2,4- триазол- 5-тионы 5a-c представляют собой слегка желтоватые стабильные кристаллические вещества.
В ЯМР1H спектрах последних в отличие от сульфанилзамещенных триазолов 4a-g, наблюдаются слабопольныe двухпротонные синглетные сигналы NCH2 группы в области 5.02-5.05 м.д., подтверждающие протекание реакции аминометилиривания по N2- положению триазолов 3a-c, а в ИК спектрах присутствуют полосы поглощений в области 1572-1558см-1, соотвествующие колебаниям группы C=S в тиоамидах. Цианэтилирование триазолов 3a-c проводилось их нагреванием со свежеперегнанным акрилонитрилом в присутствии основного катализатора триэтиламина. При этом получились N-цианэтильные производнные 6а-с, строение которых подтверждено данными спекров ЯМР1H, а на примере соединения 6а (R=C6H5), еще и химическим превращением. Гидролизом триазола 6а соляной кислотой выделена кислота 7а, идентичная с кислотой 7b, полученной встречным синтезом- взаимодейстием триазола 3а с акриловой кислотой в присутствии триэтиламина. На идентичность указывают данные ИК спекртов, ЯМР1H и одинаковые значения Rf ТСХ. В спектрах ЯМР1H соединений 7а,b присутствуют двухпротонные сигналы NCH2- и -CH2COOH групп с химическими сдвигами 4.37 и 2.92 м.д. соответственно. В идентичных ИК спектрах триазолов 7а,7b отсутствуют полосы поглощений валентных и деформационных колебаний NH группы, но присутствуют сильные полосы поглощений колебаний -N-C=S группировки в области 1571 см-1. Для окончательной убежденности в протеканни реакции цианэтилирования по таутомерному N2H положению исходного триазола 3а, взаимодействием последного с 3-хлорпропионовой кислотой в присутствии едкого кали был синтезирован также S- замещенный изомер 4b, несоответствие которого с N -замещенными триазолами 7а и 7b установили методами ТСХ, ЯМР и ИК- спектроскопии. Значение Rf 0.42 S- замещенного триазола 4b значительно ниже одинаковых значений Rf 0.66 сооединений 7а, b в системе 1,4- диоксан-бензол, 1:2. В ИК спектре соединения 4b отсутствуют полосы поглощений NH, SH и C=S групп, но наблюдается полоса валентных колебаний связанной группы OH карбоксила в области 2680-2540 см-1 в виде нескольких мелких подмаксимумов и значительно более интенсивная полоса колебаний C=O карбонила с максимумом 1726 см-1, что указывает на образование S- алкилированной кислоты 4b. В то же время в спектре ЯМР1H соединения 4b сигнал протонов группы -CH2COOH, в отличие от 7а,7b, сдвинута в более сильное поле – в область 2.65 м.д., а двухпротонный триплет группы SCH2 – наблюдается при химическом сдвиге 3.30 м.д. К сожалению, все 3 соединения 4b, 7а,7b выделены в маслообразном состоянии, что не позволяет сравнивать их температуры плавления.
Выводы
Таким образом осуществлен синтез новых 3,4,5- тризамещенных 4H- 1,2,4- триазолов 3а-с, исследованы их реакции алкилирования, аминометилирования и цианэтилирования. Методами химических превращений, ТСХ, ЯМР1 H и ИК спектроскопии установлено, что алкилирование 4H- 1,2,4 -триазол- 5 -тиолов 3а-с в щелочной среде протекает по SH тиольной группе, а реакции аминометилирования и цианэтилирования-исключительно по N2 положению триазольного колца.
Эксперементальная часть
ИК-спектры зарегистрированы на спектрометре «Nicolet Avatar 330 FT-IR» в вазелиновом масле. Спектры ЯМР 1H сняты на приборе «Varian Mercury – 300» в DMCO-d6 с рабочей частотой 300МГц (внутренний стандарт-ТМС). Температуры плавления определены на микронагревательном столике « Boetius 72/2064». ТСХ проведена на пластинках Silufol UV-254, в системе диоксан–бензол, 1:2.
Данные элементного анализа соответствуют брутто-формулам. Физико-химические данные синтезированных соединений приведены в табл. 1, 2.
Таблица 1
Физико-химические характеристики соединениий 3-7
|
Соединение |
Выход, % |
Т. пл., °С |
Rf |
Брутто-формула |
|
3b |
97 |
143-145 |
0.68 |
C19H20ClN3OS |
|
4a |
83 |
134-135 |
0.60 |
C20H20ClN3O3S |
|
4b |
59 |
*) |
0.42 |
C21H22ClN3O3S |
|
4c |
91 |
142-143 |
0.48 |
C21H23ClN3O2S |
|
4d |
61 |
62-63 |
0.58 |
C23H26ClN3O3S |
|
4e |
57 |
82-84 |
0.65 |
C21H24ClN3O2S |
|
4f |
90 |
156-157 |
0.47 |
C22H24ClN3O3S |
|
4g |
79 |
105-106 |
0.46 |
C27H21ClN4O2S |
|
5a |
74 |
149-151 |
0.68 |
C23H27ClN4O2S |
|
5b |
85 |
78-80 |
0.61 |
C24H29ClN4O2S |
|
5c |
33 |
82-84 |
0.73 |
C20H27ClN4O2S |
|
6a |
92 |
88-90 |
0.76 |
C21H21ClN4OS |
|
6b |
68 |
*) |
0.72 |
C22H23ClN4OS |
|
7a |
73 |
*) |
0.66 |
C21H22ClN3O3S |
|
7b |
57 |
*) |
0.66 |
C21H22ClN3O3S |
Примечание. *) – маслообразное.
Таблица 2
Спектральная характеристика соединений 3-7
|
Соединение |
Спектр ЯМР1H, б,м.g., КССВ(J) Гц |
|
3b |
1.33д (6H, J 6.0, CH(CH3)2), 3.77 C(2H, CH2), 4.50 сп (1H, J 6.0, CH(CH3)2), 5.17 c (2H, NCH2), 6.81д (1H, J 8.5, C6H3), 6.85дд (1H, J1 8.5, J2 2.1, C6H3), 7.04д (1H, J 2.1, C6H3), 7.14-7.30м (5H C6H5), 13.59 C(1H, SH). |
|
4а |
1.32д (6H, J 6.0, CH(CH3)2), 3.87 c (2H, CH2), 3.88 c (2H, SCH2), 4.51 сп (1H, J 6.0, CH(CH3)2), 6.76-6.83м (2H, C6H3), 6.86д (1H, J 2.1, C6H3), 7.18-7.23м (2H) и 7.46-7.55м (3H, C6H5). |
|
4b |
1.32д (6H, J 6.0, CH(CH3)2), 2.72 т (2H, CH2COOH), 3.28 т (2H, J, 76.4, SCH2), 3.91C (2H, CH2), 4.50 сп (1H, J 6.0, CH(CH3)2), 6.71-6.81 м (3H, C6H3), 7.09-7.21 м (5H, C6H5), 10.45 шир. (1H, COOH). |
|
4c |
1.32д (6H, J 6.0, CH(CH3)2), 3.80 c (2H, CH2), 3.96c (2H, SCH2), 4.49 сп (1H, J. 6.0, CH(CH3)2), 5.11c (2H, NCH2), 6.81д (1H, J 8.5, C6H3), 6.89-6.97м (4H, NH2, C6H3, C6H5), 7.10д (1H, J 2.2, C6H3), 7.17-7.27 м (3H, C6H5), 7.53 уш, (2H, NH2). |
|
4d |
1.25т (3H, J 7.1, CH3), 1.32д (6H, J 6.0, CH(CH3)2), 3.95c (2H, CH2), 3.96c (2H, SCH2), 4.14k (2H, J 7.1, OCH2), 4.49 сп (1H, J 6.0, CH(CH3)2), 5.10 c (2H, NCH2), 6.81д (1H, J 8.5, C6H3), 6.90-6.97м (3H, C6H3 и C6H3), 7.09д (1H, J 2.2, C6H3), 7.18-7.28м (3H, C6H5). |
|
4e |
1.32д (6H, J 6.0, CH(CH3)2), 3.20т (2H, J 6.4, SCH2), 3.68тд (2H, J1 6.4, J2 5.7, CH2OH), 3.95c (2H, CH2), 4.49 сп (1H, J 6.0, CH(CH3)2), 4.75т (1H, J 5.7, OH), 5.07c (2H, NCH2), 6.81д ( 1H, J 8.5, C6H3), 6.88-6.94м (2H, C6H5), 6.95дд (1H, J1 8.5, J2 2.2, C6H3), 7.10д (1H, J 2.2, C6H3), 7.17-7.27м (3H, C6H5). |
|
4f |
1.32д (6H, J 6.0, CH(CH3)2), 1.54д (3H, J 7.1, CHCH3), 3.76 шир. (1H, COOH), 3.95c (2H, CH2), 4.11к (1H, J 7.1, CHCH3), 4.49 сп (1H, J 6.0, CH(CH3)2), 5.11c (2H, NCH2), 6.81д (1H, J 8.5, C6H3), 6.88-6.94м (3H, C6H3 и C6H5), 7.07д (1H, J 2.2 C6H3), 7.11-7.27м (3H, C6H3). |
|
4g |
1.34д (6H, J 6.0, CH(CH3)2), 3.78c (2H, CH2), 4.02c (2H, SCH2), 4.50дт (2H, J1 5.2, J2 1.6, NCH2), 4.55 сп (1H, J 6.0, CH(CH3)2), 4.88дтд (1H, J1 17.1, J2 1.6, J3 1.0, =CH2), 5.11дтд (1H, J1 10.04, J2 1.6, J3 1.0, =CH2), 5.68дтд (1H, J1 17.1, J2 10.4, J3 5.2, =CH), 6.91 шир. (1H) и 7.52 шир. (1H, NH2), 6.92д (1H, J 8.5, C6H3), 7.05дд (1H, J1 8.5, J2 2.2, C6H3), 7.24д (1H, J 2.2, C6H3). |
|
5a |
1.33д (6H, J 6.0, CH(CH3)2), 2.77-2.81м (4H) и 3.60-3.65м (4H, NC4H8O), 3.79c (2H, CH2), 4.52 сп (1H, J 6.0 CH(CH3)2), 5.05c (2H, NCH2), 6.75дд (1H, J1 8.5, J2 2.1,C6H3), 6.82д (1H, J 8.5, C6H3), 6.85д (1H, J=2.1, C6H3), 7.16-7.20м (2H) и 7.46-7.52м (3H, C6H5). |
|
5b |
1.34д (6H, J 6.0, CH(CH3)2), 2.72-2.77м (4H) и 3.57-3.63м (4H, NC4H8O), 3.84c (2H, CH2), 4.50 сп (1H, J 6.0, CH(CH3)2), 5.07c (2H, NCH2), 5.23c (2H, NCH2N), 6.81д (1H, J 8.5, C6H3), 6.88дд (1H, J1 8.5, J2 2.2, C6H3), 7.07д (1H, J 2.2, C6H3), 7.13-7.29м (5H, C6H5). |
|
5c |
1.35д (6H, J 6.0, CH(CH3)2), 2.68-2.73м (4H) и 3.56-3.61м (4H, NC4H8O), 3.98c (2H, CH2), 4.57сп (1H, J 6.0, CH(CH3)2), 4.58дт (2H, J1 5.2, J2 1.6, NCH2), 5.00c (2H, NCH2N), 5.04дк (1H, J1 17.2, J2 1.6, =CH2), 5.14дк (1H, J1 10.4, J2 1.6, =CH2), 5.76ддт (1H, J1 17.2, J2 10.4, J3 1.6, =CH), 6.95д (1H, 78.5, C6H3), 7.06дд (1H, C6H3), 7.29д (1H, J 72.2, C6H3). |
|
6a |
1.33д (6H, J 6.0, CH(CH3)2), 3.07т (2H, J 6.7, CH2CN), 9.82c (2H, CH2), 4.45т (2H, J 6.7, NCH2), 4.52сп (1H, J 6.0, CH(CH3)2), 6.76-6.81м (2H, м C6H3), 6.86д ( 1H, J 2.2, C6H3), 7.18-7.24м (2H) и 7.45-7.52м, (3H, C6H5). |
|
6b |
1.34д (6H, J 6.0, CH(CH3)2), 3.08т (2H, J 6.7, CH2CN), 3.84c (2H, CH2), 4.48т (2H, J 6.7, NCH2), 4.52сп (1H, J 6.0, CH(CH3)2), 5.08c (2H, NCH2), 6.78-6.83м (2H, C6H3), 6.88д (1H, J 2.2, C6H3), 7.21-7.27м (2H) и 7.47-7.54м (3H, C6H5). |
|
6c |
1.32д (6H, J 6.0, CH(CH3)2), 3.02т (2H, J 6.7, CH2CN), 3.99c (2H, CH2), 4.40т (2H, J 6.6, NCH2), 4.52дт (2H, J1 5.5, J2 1.5, NCH2), 4.57сп (1H, J 6.0, CH(CH3)2), 4.98дк (1H, J1 17.1, J2 1.5, =CH2), 5.09дк (1H, J1 10.3, J2 1.5, =CH2), 5.72ддт (1H, J1 17.1, J2 10.3, J3 5.5, =CH), 6.95д (1H, J 8.5, C6H3), 7.06дд (1H, J1 8.5, J2 2.2, C6H3), 7.29д (1H, J 2.2, C6H3). |
|
7a |
1.33д (6H, J 6.0, CH(CH3)2), 2.79т (2H, J 6.7, CH2COOH), 3.78c (2H, CH2), 4.35т (2H, NCH2), 4.51сп (1H, CH(CH3)2), 5.71-6.39м (3H, C6H3), 6.71-7.21м (5H, C6H5), 10.37 шир. (1H, COOH). |
|
7b |
1.31д (6H, J 6.0, CH(CH3)2), 2.79т (2H, J 6.7, CH2COOH), 3.76c (2H, CH2), 4.35т (2H, NCH2), 4.50сп (1H, J 6.0, CH(CH3)2), 6.59-6.85м (3H, C6H3), 7.09-7.55м (5H, C6H5), 10.35шир. (1H, COOH). |
1-(4-Изопропокси-3-хлорфенилацето) -4-фенил (бензил-, аллил-)-3-тиосемикарбазиды 2а-с и 5-(4-изопропокси -3- хлорбензил) 4- фенил (бензил-, аллил-)- 4H- 1,2,4- триазол -3-тиолы 3а-с получены по [1].
Алкилирование 4,5- дизамещенных 4H- 1,2,4 -триазол -5- тиолов (4а-g). Общая методика. Раствор 1 ммоля триазола 3а-с, 0.056 г (1 ммоль) KOH в 15 мл этанола кипятят 20-30 мин, прибавляют 1 ммоль соответствующего галогенида и продолжают кипячение 4-5 ч. В случае этиленхлоргидрина реакционную смесь оставляют стоять при комнатной температуре 10-12 ч. Затем отгоняют растворитель, к остатку прибавляют воду, выпавший осадок фильтруют, промывают водой и перекристаллизовывают из этанола. Алкилирование галогенидами алифатических кислот проводят 4-5 ч кипячением реагентов в 15 мл воды в присутствии трехкратного избытка KOH с последующим подкислением уксусной кислотой и обработкой описанной выше. ИК спектр 4 c, g, см-1 : 2680-2540 (OH), 1726 (C=O), 1613 (C=C), 1589 (C=N), 1380 (C-O), 940 (OH деф.).
Общая методика аминометилирования 4,5- дизамещенных 4H- 1,2,4 -триазол- 3 тиолов (5а-с). 1 Ммоль соответствующего триазола 3а-с растворяют в 8-10 мл метанола и прибавляют 0.11 г (1.2 ммоль) морфолина. Затем по каплям при комнатной температуре и перемешвании приливают 0.14 г (1.6 ммоль) формалина и продолжают перемешивание 10-12 ч. После завершения реакции прибавляют 15-20 мл ледяной воды, выпавший осадок отфильтровывают и перекристаллизовывают из этанола. ИК спектр 5a, g, см-1 : 1603 (C=C), 1558 (C=N), 1438 (N-C= S) ИК спектр 5b, g, см-1 : 1644 (C=C), 1542 (C=N), 1448 (-N-C=S). ИК спектр 5c, g, см-1: 1610 (C=C), 1562 (C=N), 1452 (-N-C=S).
Общая методика цианэтилирования 4,5- дизамещенных 4H-1,2,4- триазол-3- тиолов (6a-c). 1 Ммоль соответствующего триазола 3a-c кипятят с 1.6 г (30 ммоль) свежеперегнанного акрилонитрила в 4 мл воды в присутствии 3.0 г (30 ммолей) триэтиламина в течение 6-8 ч. Раствор выпаривают, маслообразный остаток кристаллизуют ледяной водой, отфильтровывают и перекристаллизовывают из этанола. Если остаток не кристаллизуется, то тщательно протирают диэтиловым эфиром и сушат на воздухе. ИК спектр 6a, g, см-1: 2242 (-CN), 1600 (C=C), 1571 (C=N), 1498(-N-C=S). ИК спектр 5b, g, см-1: 2258 (-CN), 1560 (C=N), 1441 (-N-C=S).
2-N -(2- Карбоксиэтил) -4 -фенил- 5-(4- изопропокси – 3-хлорбензил) -4H -1,2,4-триазол-3 -тион (7a,b). А. 0.4 г (1 ммоль) 6а в 2 мл концентрированной HCI нагревают на кипящей водяной бане 1 ч. Затем прибавляют 10-15 мл воды и оставляют на 10-12 ч. Маслообразный слой отделяют, промывают холодной водой, добавляют 10-15 мл этанола, отгоняют этанол, дважды тщательно протирают диэтиловым эфиром и сушат на воздухе. ИК спектр, g, см-1: 2674-2526 (OH), 1735(C=O), 1606 (C=C), 1580(C=N), 1478 (C=S), 943 (OH деф.).
Б. Раствор 0.4 г (1 ммоль) триазола 3а, 3 мл акриловой кислоты, 4 мл триэтиламина, 4 мл воды кипятят 10 ч. Раствор выпаривают, прибавляют 10 мл воды, маслянистый остаток обрабатывают как описано выше.

