Старение – биологический разрушительный процесс, который неминуемо развивается с возрастом и ведет к ограничению адаптационных возможностей организма, формированию возрастной патологии и к увеличению вероятности смерти. Такая идея впервые была высказана А. Вейсманом в 1891 г., который рассматривал смерть не как первичную необходимость, а как нечто приобретенное вторично в процессе адаптации, он также полагал, что жизнь имеет фиксированную продолжительность не потому, что по природе своей не может быть неограниченной, а потому, что неограниченное существование индивидуумов было бы роскошью без какой-либо проистекающей из него выгоды [10]. В 1903 году И.И. Мечников, предложив термин «геронтология», определял её как науку о причинах, механизмах и закономерностях старения, об изменениях в стареющем организме и влиянии этих изменений на жизнедеятельность и продолжительность жизни, о мерах по ее продлению [1]. Механизмы старения достаточно сложны и многообразны. Существует несколько альтернативных теорий, отчасти противоречащих друг другу, отчасти – дополняющих. Современная физико-химическая биология, уделяет проблеме старения очень большое внимание, и постоянно появляются новые факты, позволяющие глубже понять механизмы этого процесса.
Теории старения должны отвечать на ряд вопросов, в том числе: (1) почему организмы подвергаются прогрессирующему и необратимому уменьшению физиологических функций в последней части своей жизни; (2) почему ожидаемая продолжительность жизни или скорость старения различаются внутри одного вида и между видами; (3) почему и какие экспериментальные воздействия замедляют начало возрастных физиологических и патологических изменений; (4) влияют ли генетические факторы и факторы окружающей среды на старение и заболевания, связанные с ним, независимо друг от друга; (5) увеличивают ли возрастные изменения в организме подверженность болезням или заболевания развиваются независимо и лишь усугубляют проявления старения; (6) можем ли мы реально повлиять на снижение скорости старения человека? К сегодняшнему дню так и не создано единой теории старения. Существует несколько десятков теорий старения, и это само по себе говорит об отсутствии общепринятой концепции.
Попробуем подойти к рассмотрению механизмов старения, задав вопрос: «А что такое Жизнь?». В 1936 г. Г. Селье определил Жизнь как процесс постоянной адаптации к постоянно изменяющимся условиям среды. В свою очередь, старение и смерть Г. Селье связывал с истощением «адаптационной энергии» (АЭ), заданной при рождении, т.е. энергии, которую организм тратит для защиты от каждого стресса [9]. АЭ может быть восстановлена и «адаптационный щит» может сохраняться, если есть достаточно времени и резервов для его восстановления. Вместе с тем, представлять адаптационную энергию в буквальном физическом смысле, как физическую величину, вряд ли было возможно. Да и сам Г. Селье не указал, как её можно измерить непосредственно, а без измерения этот параметр было трудно использовать в науке.
И только в 2014-2015 гг. было найдено решение этой задачи [8]. Рассматривая АЭ, как некую внутреннюю координату на «доминантном пути» в модели адаптации, авторы работы полагают ее краеугольным камнем в подходах к моделированию процессов адаптации. В основу модели было положено утверждение, что АЭ может восстанавливаться и даже накапливаться в результате определенного «тренинга», т.е., что приспосабливаемость к действию стресс-факторов может расти, и подобная оптимизация влияет на распределение ресурсов, которые идут на нейтрализацию вредного воздействия. Анализ различных оптимальных стратегий позволил разработать теорию, с помощью которой можно предсказывать кризисы, случающиеся в процессе адаптации. Моделирование также показало, что при определенных условиях возникают динамические режимы, «осциллирующей смерти» и «осциллирующей ремиссии», которые образуют устойчивый цикл, причем их причиной является не изменения воздействий среды, а сам механизм адаптации (!)
С позиций нелинейной динамики систем такой вывод не является удивительным, поскольку не вызывает сомнений то, что организм и его субструктуры – это биологические самоорганизующиеся системы, поскольку являются сложными, открытыми, сильно удалены от состояния равновесия, и метаболические процессы, протекающие в них, нелинейны, т.к. катализируются ферментами [6]. Самоорганизующейся является и фрактально организованная сложная система, обеспечивающая процессы адаптации.
Одной из математических моделей описывающих динамику таких систем – модель брюсселятора, созданная И. Пригожиным для описания автокаталитических химических реакций (например, ферментативных) в открытой, сильно неравновесной системе в (например, в биохимической) [7]. Модель включает химическую реакцию A + B > D + E, протекающую в четыре стадии:
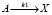 (1)
(1)
 – кросс-катализ (2)
– кросс-катализ (2)
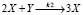 – автокатализ (3)
– автокатализ (3)
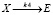 (4)
(4)
где «А» и «В» – исходные вещества; «Х» и «Y» – промежуточные соединения.
Кинетический расчет дифференциальных уравнений второго порядка, описывающих поведение этой системы, показывает существование пяти реально достигаемых областей в фазовом пространстве, две из которых (г и е; рис. 1) – области незатухающих автоколебаний с изменяемой амплитудой колебаний, не выходящей за пределы аттрактора – т.е. области самоорганизации (рис. 2).
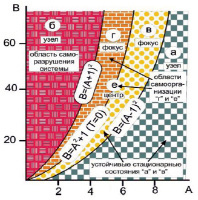
Рис. 1. Фазовый портрет системы автоколебательных ферментативных реакций в биологической системе в координатах «А» и «В», связанных с концентрациями исходных субстратов [А] и [В], и с каталитическими константами соответствующих энзимов (k1, k2, k3, k4), так как: A = k1[A]; B = k3[B]/k4
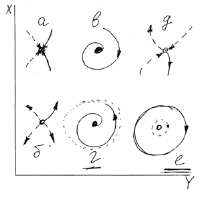
Рис. 2. Фазовый портрет системы в координатах (X, Y) с двумя степенями свободы, соответствующий различным видам отклонения от стационарного состояния и его различной устойчивости: а– устойчивый узел; б – неустойчивый узел; в – устойчивый фокус; г – неустойчивый фокус; д – недостижимая ситуация; е – устойчивый центр.
Анализ фазовых портретов приведенных на рис. 1 и 2 показывает, что как только величина «В» переходит некий критический порог и входит в диапазон (A2 + 1) < В < (A + 1)2 («фокус г») или В = A2 + 1 («кривая е»; см. рис. 1) стационарное состояние системы (X0 = A, Y0 = B/A) становится неустойчивым фокусом (либо центром), и система из этого фокуса выходит или «наматывается» на предельный цикл. Величины X и Y начинают колебаться с отчетливо выраженной периодичностью (см. рис. 2). Период колебаний зависит от: (1) концентраций веществ А, В, X и Y, точнее, от их соотношения, т.к. само их присутствие даже на уровне «флуктуаций» достаточно для запуска процесса «блуждания» системы по полю возможных траекторий; (2) свойств ферментов (k1÷k4), включая разнообразие каталитических параметров, определяемое структурным разнообразием изоформ энзимов и участков генома их кодирующих (локусность, аллельность, величина теломер и др.), а также от структурно-функционального разнообразия физиологически активных веществ (ФАВ), обладающих способностью модифицировать посттрансляционную конформацию и, следовательно, активность регуляторных энзимов; (3) внешних факторов, определяющих разнообразие граничных условий наложенных на всю систему (не только температуры, но и свойств других веществ, находящихся в сфере реакции, а также самой среды реакции.
Таким образом, за критическим порогом система под действием флуктуаций спонтанно покидает стационарное состояние и при любых начальных условиях стремится выйти на предельный цикл (странный аттрактор), периодическое движение по которому устойчиво, до тех пор, пока сохраняется условие A2 + 1 < В < (A + 1)2 или В = A2 + 1, т.е. в области фазового портрета «г» или на кривой «е» (см. рис. 1). Ширину этой области фазового пространства – гомеостатический интервал, определяющую способность системы сохраняться в состоянии саморегуляции (самоорганизации), по-видимому, можно считать её адаптивным потенциалом. При выходе параметров системы за пределы этого интервала она скачкообразно либо стремится к состоянию равновесия (состояния «а» или «в» (см. рис. 1 и 2) – термодинамическая смерть), либо входит в режим самовозбуждающихся апериодических колебаний, выходит из аттрактора, в котором система сохраняет способность саморегуляции (состояние «б»), т.е. саморазрушается (см. рис. 1 и 2).
Вышесказанное позволяет предположить, что эти критерии и являются количественной мерой адаптивного потенциала биосистемы, определяют её устойчивость не только при действии на них экстремальных факторов среды, но и в «спокойных» условиях, благодаря сохранению траекторий развития биосистемы в режиме самоорганизации. Вне этого режима биосистема, как самоорганизующуюся диссипативная система, существовать не может.
Приложение принципов нелинейной динамики позволяет по иному подойти к пониманию состояния здоровья, предболезни, болезни (рис. 3), а также определить гомеостаз – как динамическое автоколебательное (за счет отрицательных и положительных обратных связей) состояние организма, при котором амплитуды значений параметрических характеристик не выходят за пределы странного аттрактора, в котором организм сохраняет способность к самоорганизации [6]. Так как организм человека – это иерархия автономных самоорганизующихся диссипативных структур (ДС), между которыми (а также между его субструктурами) существуют нелинейные связи, то траектория его развития в понятиях «здоровье» – «болезнь» описывается спектром ключевых моментов – бифуркаций, в точках которых происходит стохастический выбор одной из устойчивых ветвей дальнейшего развития и по которой информация транслируется до следующей бифуркации (см. рис. 3).
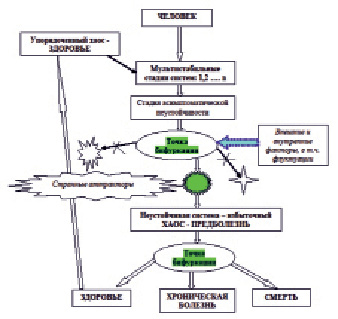
Рис. 3. Представление организма человека как иерархии автономных самоорганизующихся диссипативных систем
Точки бифуркации – переломные, критические моменты развития системы, отличаются принципиальной непредсказуемостью, т.к. при приближении к ним траектории развития системы в фазовом пространстве формируется режим «динамический хаос», в рамках которого происходит зарождение и нарастание флуктуаций – случайных отклонений мгновенных значений параметров системы от их средних значений. В этих критических областях достаточно слабых и сверхслабых воздействий на систему [3] для того, чтобы она скачком перешла из прежнего устойчивого состояния в состояние с другими параметрами. Этим можно объяснить развитие многих острых заболеваний: приступов бронхиальной астмы, острого отека легких, параксизмальных нарушений ритма, некоторых острых форм ишемической болезни сердца (внезапная смерь, острая коронарная недостаточность) и других ситуаций [8], для возникновения которых иногда бывает достаточно микроскопически, клинически не определяемой флуктуации системы, приводящей к лавинообразному нарастанию угрожающих жизни симптомов. В благоприятных случаях такие же флуктуации могут привести к возникновению новой, более упорядоченной структуры.
Любая патология характеризуется нарастанием степени «жесткости» во взаимодействии между подсистемами организма – развивается количественная ригидность, нарастающая в ряду от здоровья через предболезнь к клинически болезненному состоянию. По мере нарастания тяжести патологического процесса возникает более четкая периодичность и происходит утрата изменчивости: например, при инфаркте миокарда уменьшаются вариации частоты сердечных сокращений; у больных артериальной гипертензией повышение артериального давления становится более монотонным и снижается размах его суточных колебаний; у больных лейкозами менее изменчивым становится количество лейкоцитов. Эти конкретные клинические проявления отражают одну из принципиальных основ болезни – нарастание жесткости межструктурных взаимодействий. С позиций теории нелинейной динамики это означает, что снижается вероятность возникновения флуктуаций необходимых для эволюции системы через обязательный режим «динамический хаос» в состояние новой «диссипативной структуры», которая в функциональном отношении может обеспечить оптимальную адаптацию организма к изменяющимся условиям среды. Таким образом, здоровье – это балансирование между хаосом и порядком, поэтому теории хаоса и нелинейной динамики играют все большую роль в теории медицины и геронтологии, в том числе. Соответственно, нормальная эволюция возможна лишь при определенной мере хаотичности – наличии «люфта» на каждой стадии развития. Управление динамикой диссипативно-структуриро-ванных состояний может осуществляться с помощью слабых и сверхслабых внешних воздействий [3], переводящих с высокой вероятностью «патологическую» диссипативную структуру через хаотический режим на заданную ветвь бифуркационного дерева и далее – к «диссипативной структуре – здоровье» (см. рис. 3).
Далее попытаемся подойти к пониманию законов старения с позиций теории нелинейной динамики, так как биологическая система (в том числе организм человека), являясь сложной, иерархически структурно организованной, открытой, сильно неравновесной, нелинейной системой, развитие которой – это цепь трансформаций «диссипативных структур» через режимы «динамический хаос» и точки «бифуркации» (преобладают положительные обратные связи, приводящие к разрастанию одной из флуктуаций), после которых возникает новая динамическая «диссипативная структура» (существующая на определенном отрезке траектории развития за счет отрицательных обратных связей), является классической самоорганизующейся системой [6, 7]. В этой связи нелинейная динамика биологических систем находится в полном соответствии с теорией функциональных систем П.К. Анохина.
Вышеизложенное позволяет предположить, что старение – это процесс уменьшения адаптивного потенциала биосистемы, который может быть описан изменениями следующих интегральных характеристик:
1. Динамическая устойчивость – важнейшая характеристика системы, заключающаяся в способности автоматически восстанавливать свое состояние после внезапного нарушения последнего каким-нибудь внешним или внутренним фактором. С возрастом в организме происходит значительное падение динамической устойчивости по отношению к целому ряду возмущающих факторов, например, уменьшение толерантности к глюкозе.
2. Точность выполнения операций – качество приближения ее практического выполнения к оптимальному способу, отклонение от которого характеризует величину ошибки.
3. Лабильность – скорость перехода из состояния покоя в состояние возбуждения, выражаемая, как среднестатистическое число операций, выполняемых в единицу времени.
4. Скорость и сила – с возрастом в организме снижается скорость и сила многих процессов, например, уменьшается скорость распространения нервного импульса и сила мышечного сокращения.
5. Нагрузочная характеристика – параметр, характеризующий связь между величиной нагрузки и ответом системы. При старении снижается диапазон изменения ответа системы на стимул. В ответ на действие гормона ткани старого организма начинают реагировать при меньших его концентрациях, но величина максимального ответа при высоких концентрациях гормона у них понижена.
В 1978 г. Л.А. Гавриловым была выдвинута гипотеза о том, что старение организмов обусловлено «каскадом зависимых отказов», возникающих в результате случайного отказа одной из систем организма, заключающегося в выходе значений её параметрических характеристик за допустимые пределы [5]. Эта формулировка, в рамках понятий современной теории нелинейной динамики в биологических системах, означает десинхронизацию функциональной активности управляющих подсистем между собой и выход значений отдельных гомеостатических (управляющих) параметров организма и/или его субсистем за пределы аттрактора (гомеостатического интервала; адаптивного потенциала), в котором организм сохраняет свою способность к самоорганизации (рис. 4). Поскольку в биологических системах функционирование одних органов полностью зависит от нормального функционирования других, зависимые отказы имеют очень большое значение. Достаточно даже небольшого восстанавливаемого отказа в одной из систем организма (например, образования тромба в коронарном сосуде), чтобы вызвать целый каскад зависимых и невосстанавливаемых отказов всех остальных систем. Поэтому большинство систем организма является избыточным по числу функционирующих элементов. Такое резервирование обеспечивает нормальную работу системы в целом даже при временном отказе большой группы элементов. Однако, уменьшение числа элементов с возрастом (снижение кратности резервирования) ведет к резкому снижению надежности системы и увеличению вероятности смерти.
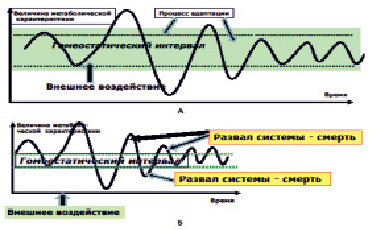
Рис. 4. Способность саморегулируемой биологической системы сохранять свои параметры в гомеостатическом интервале – это суть адаптации метаболизма к изменяющимся условиям внешней и внутренней среды – (А), а старение – это сужение гомеостатического интервала (Б). При этом даже относительно слабое внешнее воздействие может привести к выходу системы из зоны сохранения способности к самоорганизации, т.е. к гибели
Вышесказанное позволяет предположить, что в основе старения, от молекулярно-клеточного до организменного уровня (возможно, и на уровне популяции и социума) лежат различные по природе, но близкие по результату процессы, приводящие к снижению адаптивного потенциала биологической системы, т.е. к сужению области фазового пространства параметрических (гомеостатических) характеристик, в котором организм способен сохранять способность к самоорганизации (см. рис. 4).
Ширина этого интервала определяется активностью динамически функционирующих регуляторных систем: нервной, эндокринной, иммунной, прооксидантно-антиоксидантной, мутационно-репарационных и др., работающих по принципу «весы-противовесы» за счет отрицательных и положительных обратных связей, т.е. также являющихся саморегулируемыми подсистемами.
Следует также отметить, что известные в настоящее время теории молекулярно-клеточных механизмов старения, относящиеся к двум группам (генетические и свободно-радикальные) [1, 4] вписываются в вышеизложенную модель, так как, по сути, связаны с нарушением функционирования той или иной вышеприведенной регуляторной системы, приводящей к сужению гомеостатического интервала (адаптивного потенциала), в котором эта система и организм в целом способны сохранять способность к самоорганизации при действии раздражителей внешней/внутренней среды. Соответственно, оценка уровня адаптационных возможностей организма [2] позволит оценить степень его старения, а различного рода воздействия (физические, биохимические, психологические), обладающие адаптогенным действием, будут способствовать замедлению процессов старения, продлению периода активного долголетия.

