Одной из фундаментальных характеристик любой частицы и эритроцита, в частности, является коэффициент объемной поляризуемости (далее по тексту поляризуемость) (αкл).
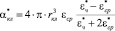 (1)
(1)
где 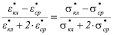 = К(f) – фактор Клаузиуса-Мосотти.
= К(f) – фактор Клаузиуса-Мосотти.
Он характеризует пространственное распределение электрических зарядов и энергию связей между ними в объеме клетки, способность атомов, ионов, молекул клетки формировать дипольный момент, а также ее химический состав. Поляризуемость не зависит от напряженности внешнего электрического поля [3, 10].
В неоднородном переменном электрическом поле (НПЭП) на поляризованный эритроцит действует сила, которая приводит его в поступательное движение. Фактор К(w) может принимать как положительные значения, если eкл > eср, так и отрицательные, если eкл < eср. Величина реальной части К(w) меньше нуля соответствуют отрицательному диэлектрофорезу (-ДЭФ). Здесь клетки выталкиваются в области с наименьшим градиентом напряженности электрического поля. Величина реальной части К(w) больше нуля соответствуют положительному диэлектрофорезу (+ДЭФ). Для этого случая характерно поступательное движение клеток в область с максимальным градиентом напряженности электрического поля. Частотные области отрицательного и положительного диэлектрофореза разделяет равновесная частота wр, (crossover frequency), на которой клетка неподвижна или испытывает вращение вокруг своей оси. На равновесной частоте выполняются равенства
tкл = tср; tкл = Rкл·Скл; tср = Rср·Сср; Rкл·Скл = Rср·Сср
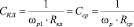
Известно, что множество факторов, pH среды, вирусы, токсины способны существенно изменять морфологию и функцию эритроцитов [3]. Реакция клетки, например, в ответ на взаимодействие с вирусом индивидуальна. Наблюдаются изменение вязкости мембраны и цитоплазмы; дисперсности коллоидов цитоплазмы, ядра; флюоресценции, изменение потенциала на мембране; увеличение ее электропроводности; выход ионов калия, метаболитов; увеличение объема (набухание) клеток; изменение внутриклеточной концентрации ионов кальция [2, 3]. Таким образом, совокупность изложенных обстоятельств позволяет характеризовать биологическую уникальность эритроцита по величине его объемного коэффициента поляризуемости и использовать данный параметр в диагностике целого ряда заболеваний [1, 6-9, 17, 25].
Цель исследования – определение пилотных референсных интервалов величины коэффициента объемной поляризуемости эритроцитов условно здоровых обследуемых с учетом половых и возрастных различий.
Материалы и методы исследования
В исследовании приняли участие жители Октябрьского района г. Новосибирска (347 мужчин и 453 женщины в возрасте от 25 до 44 лет; 45 детей в возрасте от 4 месяцев до 15 лет; взрослые, обследуемые в возрасте от 15 до 24 лет, и более 44 лет (120 человек), обратившиеся по поводу исследования показателей красной крови, гемостаза в «НИИТПМ». Исследования выполнялись в рамках темы «Мониторинг состояния здоровья и распространенности факторов риска терапевтических заболеваний, их прогнозирование и профилактика в Сибири» (Рег. № 01201282292), в период с февраля 2014 по июль 2016 г.
Критериями включения в данное исследование являлись: 1) лица, проходящие профилактический медицинский осмотр или диспансеризацию; 2) данные исследования эритроцитов методом диэлектрофореза, полного анализа крови. Критериями исключения были: 1) лица, проходящие повторное обследование за указанный период; 2) беременные женщины; 3) лица с манифестной патологией внутренних органов, цереброваскулярной, онкологической, системной, неврологической патологией.
Стандартизация преаналитического этапа была обеспечена подробной инструкцией для пациента по подготовке к анализу и инструкцией для медицинского персонала по проведению процедуры взятия крови.
Обследование выполнено с одобрения Комитета Биомедицинской Этики «НИИТПМ» (протокол от 28.10.2013).
Для проведения исследования эритроцитов методом диэлектрофореза в неоднородном переменном электрическом поле (НПЭП) клетки красной крови получали из цельной крови пациентов, взятой из вены. Подробно методика описана в монографии [3] В каждом образце крови определяли показатели поляризуемости на 4-х частотах исследуемого диапазона с помощью электрооптической системы детекции клеток – на низких (5×104 Гц, 105 Гц) и высоких (106 Гц, 5×105 Гц) частотах. Для компьютерной обработки данных использовался пакет оригинальных программ CELLFIND. Относительная погрешность измерения поляризуемости составляла не более – 17,4 %.
Величина поляризуемости сопоставлялась со средним объемом эритроцитов, определенным с помощью гематологического анализатора Hemolux 19 (ЛОТЕП/Mindray, КНР).
Статистическая обработка данных. Проведен статистический анализ оригинальных экспериментальных данных величины поляризуемости эритроцитов, полученных методом диэлектрофореза. Анализ выполнен с использованием программы SPSS, ver. 17. Тип распределения определялся по критерию Шапиро–Уилка (Shapiro–Wilk’sW-test). Этот критерий предпочтителен, так как является наиболее мощным, универсальным и наиболее «строгим» по сравнению с критериями Колмогорова–Смирнова и Лиллиефорса [12]. Для уменьшения или даже устранения маскирующего влияния аномальных значений выбросы определяли по методу Тьюки: из расчетов исключены данные, не входящие в интервал (Q1 – 1,5·IQR) – (Q3 + 1,5·IQR), рассчитанный для каждого параметра, где Q1 и Q3 – границы 1-го и 3-го квартилей, IQR = Q3 – Q1 – межквартильный размах [21]. Результаты представлялись как минимальные и максимальные значения показателя для данной группы.
Результаты исследования и их обсуждение
На основании анализа оригинальных данных величины поляризуемости эритроцитов, полученных методом диэлектрофореза и сопоставления со средним корпускулярным объемом эритроцитов, предложены пилотный референтный интервал поляризуемости эритроцитов в частотном диапазоне 0,05 – 1×106 Гц для условно здорового населения г. Новосибирска с учетом половых и возрастных различий (таблица).
Пилотные референтные значения поляризуемости эритроцитов для условно здорового населения Октябрьского района г. Новосибирска с учетом половых и возрастных различий
|
Возраст |
Средний корпускулярный объем Эр – MCV (fL) |
Поляризуемость 0,05×106 Гц [м3] min-max |
Поляризуемость 0,1×106 Гц [м3] min-max |
Поляризуемость 0,5×106 Гц [м3] min-max |
Поляризуе-мость 1×106 Гц [м3] min-max |
|
Дети – 4-12 месяцев |
72-87 |
-4,6E-16 -1,2E-15 |
-4,5E-16 -9,5E-16 |
7,7E-15 9,3E-15 |
8,1E-15 9,8E-15 |
|
10-13 лет |
77-93 |
-9,4E-16 -1,1E-15 |
-8,6E-16 -1,0E-15 |
8,2E-15 9,8E-15 |
8,7E-15 1,0E-14 |
|
13-15 лет |
80-94 |
-9,8E-16 -1,1E-15 |
-9,1E-16 -1,0E-15 |
8,5E-15 1,0E-14 |
9,0E-15 1,0E-14 |
|
Мужчины > 15 лет |
84-98 |
-1,0E-15 -1,2E-15 |
-9,4E-16 -1,1E-15 |
9,0E-15 1,0E-14 |
9,4E-15 1,1E-14 |
|
Женщины 15-50 лет |
82-99 |
-9,9E-16 -1,3E-15 |
-9,2E-16 -1,1E-15 |
8,7E-15 1,1E-14 |
9,3E-15 1,2E-14 |
|
Женщины > 50 лет |
85-97 |
-1,1E-15 -1,2E-15 |
-9,5E-16 -1,1E-15 |
9,1E-15 1,0E-14 |
9,6E-15 1,1E-14 |
Анализ данных, приведенных в таблице, показал, что величины поляризуемости нарастают с увеличением частоты во всех возрастных группах. Поляризуемость эритроцитов для детей и подростков на низких и высоких частотах ниже, чем для взрослых, что, вероятно, отражает особенности красного ростка крови. В данном пилотном исследовании гендерных различий параметра поляризуемости не выявлено.
Полученные экспериментальные данные хорошо согласуются с расчетными величинами поляризуемости согласно (1). Степень отклонения экспериментальных данных от расчетных не превышала ожидаемых 17,4 %.
Поскольку показатель поляризуемости отражает степень адаптации клеток к окружающим условиям, регенераторные возможности красного ростка крови, полученные данные по пилотным референтным значениям могут быть полезными в клинической практике для оценки состояния эритроцитов у пациентов с целым перечнем патологии внутренних органов, в том числе при диффузной патологии печени, цереброваскулярной патологии, анемиях, онкологических заболеваниях и др.
Исследование крови является самым частым видом лабораторного исследования, используемым для оценки общего состояния здоровья человека. Практическая медицина основана на сравнении, т.е. результат исследования всегда сравнивается с нормальными величинами, поэтому очень важно определить, что такое «норма» [11].
Наличие понятия «норма» дает возможность клиническим врачам разделять пациентов на «здоровых» и »больных». Однако в группе здоровых эти показатели варьируют, что может быть обусловлено меж – и внутри-индивидуальными особенностями. Термин «нормальные значения» в настоящее время заменен более корректным – «референсные значения» (или референсный интервал – referencerange – РИ), так как понятие «нормальный» зачастую имеет много противоречивых значений. Кроме того, термин «нормальное распределение вероятностей» подразумевает нормальное (гауссовское) распределение данных, что в действительности встречается редко [18]. Термин «референсный интервал» учитывает разные популяции обследуемых, т.е. РИ – это интервал значений, в который включены данные большинства пациентов с характеристиками, аналогичными таковым у референсной группы (группа лиц, при обследовании которой был рассчитан РИ), и исключены другие (с минимальным количеством ложноположительных и ложноотрицательных результатов [14]).
Расчет РИ для здоровых людей во многом зависит от определения понятия «здоровье», которое используется при отборе «референсной группы» для установления РИ. В 1981 г. R. Grasbeck дал такое определение: «Здоровье характеризуется минимумом субъективных ощущений и объективных признаков заболевания, оценивается в связи с социальной ситуацией человека и является предметом и целью медицинской деятельности». Таким образом, здоровье – состояние относительное, человек может быть признан как больным, так и здоровым. Такой подход дает значительную свободу в выборе референсной группы, так как при установлении РИ определение здоровья зависит от предполагаемого использования полученных эталонных значений [18].
Обычно РИ устанавливаются по результатам обследования «практически здоровых лиц». При этом лаборатории часто сталкиваются с данными, имеющими мультимодальное или асимметричное распределение, что может быть связано с высокой распространенностью субклинического проявления заболевания у выбранной группы лиц. Согласно концепции «практически здорового человека», обнаруженные отклонения от нормы, характерные для донозологических состояний, не влияют существенно на самочувствие и работоспособность человека, но одновременно являются одним из основных и распространенных факторов риска развития различных форм заболеваний [15]. В группу, по которой рассчитывается РИ, всегда входит часть «не нормальных» лиц, т.е. существует вероятность того, что пациент с результатами, не выходящими за РИ, может быть нездоров [19]. С другой стороны, важно учитывать, что РИ являются статистическими данными 95 % популяции, при этом у 5 % здоровых лиц обнаруживают «ненормальные» лабораторные показатели, поэтому не все значения, выходящие за область нормальных значений, являются патологическими [5]. В середине 1990-х годов Национальный комитет по клиническим лабораторным стандартам (NCCLS) опубликовал рекомендации по самостоятельному определению РИ в каждой клинической лаборатории для каждого теста, применяемого для обследования населения, которое она обслуживает. Использование полученных «локальных» РИ должно уменьшить частоту ложноположительных результатов и повысить раннее обнаружение патологии в обследуемой популяции [13, 23]. При установлении РИ для каждой индивидуальной категории (пол, возраст) с применением непараметрических методов статистики требуется минимум 120 наблюдений [15, 22].
В ряде публикаций отмечается, что в действительности даже в крупных лабораториях разработка собственных РИ для каждого вида анализа является очень трудоемким и дорогостоящим процессом [13, 14, 24, 26].
В зарубежной литературе описаны следующие способы установления РИ: 1) локальное установление РИ: а) классический (рекомендованный) подход – набор референсной группы с применением строгих критериев включения и исключения, обследование и расчет РИ, б) «апостериорный»/косвенный подход – использование для расчета РИ результатов ранее обследованных в данной лаборатории пациентов, хранящихся в базе данных лаборатории за определенный период времени; 2) установление РИ по результатам проведенного мультицентрового исследования (в исследовании принимают участие одновременно несколько лабораторий); 3) перенос данных (из справочной литературы, инструкций производителей реагентов и оборудования).
Большинство лабораторий во всем мире используют РИ, опубликованные в инструкциях к реагентам, анализаторам, в справочной литературе или полученные в другой лаборатории [22, 26]. При этом каждая лаборатория обязана проверить эти данные и убедиться в том, что характеристики референсной популяции и уровень выполнения аналитических процедур в лаборатории и в используемом источнике сопоставимы.
Процедура проверки РИ описана в ГОСТ Р 53022-3-2008 [4]. В реальности лаборатории часто используют опубликованные РИ, установленные на других измерительных системах и для другой популяции, что может привести к значительным ошибкам при интерпретации результатов исследования [22]. В инструкциях к гематологическим анализаторам, используемым в нашей стране, приведены РИ, полученные при обследовании населения тех стран (с его расовыми, этническими, географическими и другими особенностями), в которых они произведены, что обязывает нас в любом случае проводить проверку этих данных. Кроме того, полученные результаты могут различаться при использовании гематологических анализаторов, основанных на разных методиках подсчета и дифференцировки клеток крови. При продолжающемся совершенствовании измерительных приборов и внедрении новых методов необходимо обновление создания новых РИ, о чем говорится в стандарте ISO 15189 от 2003 г. [26]. Важно отметить, что Директива Евросоюза и Европарламента от 1998 г. (98/79 подраздел 8.7) гласит: «там, где это уместно, инструкции к эксплуатации должны содержать референсные значения для определяемых параметров для соответствующей популяции». Это подчеркивает необходимость совместной работы производителей и лаборатории для установления РИ [14, 16, 26].
Значение РИ зависит от: а) характеристик референсной группы; б) преаналитического этапа диагностики (условия подготовки пациента к обследованию, процедура взятия крови, хранение и транспортировка образца); в) аналитического этапа (используемый метод, аналитические возможности и корректная работа анализатора, статистические методы при обработке результатов).
Основные проблемы связаны с формированием референсной группы. Наиболее распространенный подход – получение РИ в популяции здоровых людей, но в данном случае определение «здоровья», действительно, проблематично не только из-за самого определения, которое является главным критерием включения в референсную группу, но также из-за вполне реальной возможности, что некоторые заболевания могут, по сути, иметь субклиническое, бессимптомное течение [15]. Состав референсной группы должен отражать состав популяции, для которой создается РИ [27]. При исследовании в естественной популяции может быть получено большое количество аномальных значений от нездоровых участников, что приводит к расширению референсного диапазона [29].
В настоящей работе для установления РИ был использован другой метод набора референсной группы – «косвенный» (апостериорный, ретроспективный). Достоинствами этого подхода, заключающегося в обработке результатов, уже собранных и сохраненных в базе данных лаборатории, являются доступность и значительное количество данных, экономия времени и средств. Кроме того, при использовании ретроспективного анализа данных для установления РИ устраняется основная проблема набора референсной группы для пожилых пациентов, для детей, беременных женщин и других относительно малочисленных групп. В ряде публикаций обсуждается этот подход, при использовании которого удалось получить клинически значимые РИ [13, 23,24]. При этом полученные РИ являются, так же как при прямом наборе группы, «локальными» и имеют перечисленные выше недостатки (зависят от индивидуальных характеристик обследуемой популяции, от используемых при анализе методик и др.). Настороженность в использовании косвенного метода установления РИ связана с тем, что полученные РИ могут быть слишком «широкими» из-за включения результатов от нездоровых обследованных [15, 20]. В нашей стране в последнее время в связи с расширением практики диспансеризации работающего населения и регулярного проведения периодических профилактических осмотров стало возможным обследование больших контингентов условно здорового взрослого населения [11]. Центры профилактической медицины (с возможностью оценки данных повторной диспансеризации пациентов для уточнения состояния их здоровья) весьма привлекательны для создания РИ ретроспективным путем [28]. Данная информация весьма важна как для верификации диагноза, так и для оценки эффективности проводимой терапии.
Заключение
Проведенное пилотное исследование позволило получить референтные интервалы поляризуемости эритроцитов, измеренной методом диэлектрофореза, с учетом возрастных и половых различий на примере населения Октябрьского района г. Новосибирска. Полученные экспериментально данные коэффициента объемной поляризуемости согласуются с величинами данного показателя, вычисленными теоретически. Необходимо продолжение исследований в данном направлении в связи с перспективностью данного параметра эритроцитов для клинической практики.

