Известно, что любое стрессорное воздействие сопровождается активацией гипоталамо-гипофизарно-адренокортикальной оси. Конечным этапом этой активации является секреция глюкокортикоидных гормонов из надпочечников (кортизола у человека и кортикостерона у грызунов). Кроме того, уровень глюкокортикоидных гормонов в крови является одним из немногих показателей, объективно характеризующих интенсивность (тяжесть) стрессорного воздействия (обзор: [8]).
Всасывание глюкозы в тонкой кишке относится к начальным этапам энергетического обмена и модулируется глюкокортикоидами [5, 6, 9, 11]. В большей части имеющихся работ показано, что глюкокортикоиды (экзогенные или секретируемые при стрессе в остром и хроническом вариантах), оказывают стимулирующее влияние на всасывание глюкозы в кишечнике [5, 9]. Такая реакция, по-видимому, является физиологической (адаптивной), поскольку она направлена на обеспечение быстрого пополнения энергетических запасов организма в условиях стресса. В данном случае эти запасы значительно истощены и в качестве источника энергии расходуются структурные белки, что при длительных стрессорных нагрузах может нанести вред здоровью. Вместе с тем в некоторых других работах сообщается об ингибирующем действии глюкокортикоидов в отношении всасывания глюкозы [5, 11]. Одним из возможных объяснений такого ответа может быть проявление дезадаптации. Для понимания причин и факторов, способствующих трансформации физиологической реакции системы всасывания глюкозы на стресс в патологическую, необходимы дальнейшие исследования, касающиеся, в частности, анализа связей между отдельными характеристиками стрессора (интенсивность, частота стрессорного воздействия) и всасыванием глюкозы в кишечнике.
Цель настоящей работы состояла в том, чтобы в опытах на крысах проанализировать действие ежедневных инъекций кортикостерона на всасывание глюкозы в тонкой кишке в зависимости от дозы гормона и длительности его введения (имитация хронического стрессорного воздействия различной степени тяжести и длительности).
Материалы и методы исследования
Эксперименты были выполнены на 30 взрослых крысах (Вистар, самцы, масса тела 180-220 г) в полном соответствии с Директивой Европейского Совета (The European Council Directive (86/609/EEC)) по соблюдению этических принципов в работе с лабораторными животными и одобрены Комиссией по контролю за содержанием и использованием лабораторных животных при Учреждении Российской академии наук Институт физиологии им. И.П. Павлова РАН.
Перед опытами и в ходе их проведения животные содержались в нормальных условиях в отношении температуры, освещения и рациона. Способность тонкой кишки к всасыванию глюкозы оценивалось с использованием разработанной нами ранее методики [1] по динамике свободного потребления голодавшими (18–24 ч) крысами 20 % раствора глюкозы. Согласно этой методике перед началом введения препаратов (гормона или его растворителя) у каждого из животных были определены исходные скорости свободного потребления концентрированного раствора глюкозы (в мкл/мин). Расчет этих скоростей проводился методом линейной регрессии с использованием программного ресурса «ORIGIN 7» (OriginLabCorporation, USA) во временном интервале от 60 до 300–360 мин от начала опыта с регистрацией потребления раствора глюкозы.
По результатам расчетов животные были разделены на три группы (N=10 в каждой группе) с близкими средними значениями скорости потребления раствора глюкозы. В контроле (группа 1) животным вводили подкожно растворитель гормона (пропиленгликоль) в объёме 0.2 мл, а в группах 2 и 3 вводили таким же способом кортикостерон соответственно в дозах 4 и 12 мг на кг массы тела. Введение препаратов осуществлялось ежедневно, как правило, в 18:00 ч, то есть перед началом активной фазы у крыс, и продолжалось в течение последующих 3 недель. Всасывательная способность тонкой кишки к глюкозе оценивалась через каждые 3-5 дней в светлое время суток (неактивная фаза у крыс) в промежутке между 10:00 и 15:00 ч. Однако в отдельном опыте она оценивалась также в вечернее время (активная фаза) в промежутке между 19:00 и 23:00 ч.
Доза гормона 4 мг/кг была выбрана как соответствующая физиологическому уровню эндогенного кортикостерона при умеренном стрессе [2, 7], а доза 12 мг/кг – как существенно более высокая по сравнению с дозой 4 мг/кг и в то же время незначительно отличающаяся от физиологических концентраций этого гормона в крови при сильном стрессе.
Статистическая обработка результатов проводилась с использованием t-критерия Стъюдента, в некоторых случаях использовались также непараметрические критерии. Достоверными считалась различия при P < 0.05.
Результаты исследования и их обсуждение
В ходе трёхнедельных инъекций кортикостерона снижался прирост массы тела крыс по сравнению с контрольными животными, которым вводился растворитель гормона –пропиленгликоль. К концу опытов прирост массы тела относительно исходного уровня составлял 18.1, 11.9 и 10.4 в группах 1 (контроль), 2 (доза 4 мг/кг) и 3 (доза 12 мг/кг) соответственно (рис. 1). Сходные изменения массы тела у крыс отмечали также другие исследователи при хронических инъекциях кортикостерона в дозах 5 и 40 мг/кг [7], или при получении этого гормона животными в составе питьевой воды в концентрациях 40 и 100 мкг/мл [4]. Предполагается, что такой ответ в отношении прироста массы тела животных обусловлен катаболическим действием высоких доз кортикостерона в отношении мышечной и жировой ткани [4].
В настоящей работе всасывание глюкозы в тонкой кишке впервые оценивалось по скорости свободного потребления животными концентрированного раствора глюкозы, что позволило исследовать этот процесс в условиях, максимально близких к естественным [1].
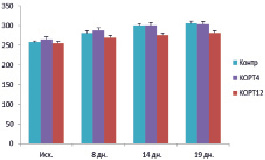
Рис. 1. Масса тела крыс в различные дни опытов в группах 1 (контроль, КОНТР), 2 (доза гормона 4 мг/кг, КОРТ4) и 3 (доза гормона 12 мг/кг, КОРТ12). По вертикали: масса тела крыс (г); по горизонтали: время от начала опытов (дни)
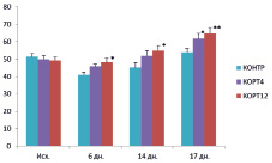
Рис. 2. Скорость свободного потребления 20 % раствора глюкозы в различные дни опытов в группах 1 (контроль, КОНТР), 2 (доза гормона 4 мг/кг, КОРТ4) и 3 (доза гормона 12 мг/кг, КОРТ12). По вертикали: скорость потребления глюкозы (мкл/мин); по горизонтали: время от начала опытов (дни). *P < 0.05; **P < 0.02 по отношению к контролю
Скорость свободного потребления 20 % раствора глюкозы во всех группах крыс не была постоянной на протяжении всей серии опытов (рис. 2). На шестой день опытов она была снижена относительно соответствующего исходного уровня (до начала инъекций) на 20 % (P < 0.05) в контрольной группе 1 или проявляла тенденцию к снижению в опытных группах 2 и 3. Однако в дальнейшем (через 14 и 17 дней опытов) скорость потребления раствора глюкозы во всех группах крыс постепенно повышалась и на 17-й день опыта восстанавливалась по сравнению с исходной в контрольной группе 1 или превышала её в опытных группах 2 и 3 (соответственно на 23 и 31 %, P < 0.05). Сходство в характере изменения во времени скорости потребления глюкозы в различных группах крыс позволяет думать, что эти изменения обусловлены действием одного и того же фактора, которым могло быть болевое ощущение от уколов при введении препаратов (гормон, растворитель). Основанием для такого предположения служат данные, полученные нами ранее в хронических опытах на крысах, свидетельствующие о торможении всасывания глюкозы под влиянием операционной травмы, вызванной лапаротомией. Действие этого фактора в отношении скорости потребления глюкозы было непродолжительным и не проявлялось через 17 дней опытов.
Несмотря на некоторую вариабельность скорости потребления глюкозы, у животных опытных групп 2 и 3 на каждом из анализируемых сроков она была заметно выше, чем в контрольной группе 1 (рис. 2). Этот эффект в каждой опытной группе варьировал незначительно на разных сроках применения гормона (в группе 2 в диапазоне 12 – 15 %, в группе 3 – в диапазоне 17 – 22 % от соответствующего контроля). Однако, прослеживалась тенденция к зависимости скорости потребления глюкозы от дозы гормона.
Следует отметить также, что наблюдавшиеся нами эффекты кортикостерона в отношении скорости потребления глюкозы в большинстве случаев регистрировались в дневное время (в неактивной фазе у крыс), спустя 16 ч после введения гормона, которое осуществлялось накануне вечером (перед началом активной фазы). Однако, при введении гормона в дневное время за 1 ч до опыта с потреблением раствора глюкозы (отдельный эксперимент) относительная величина наблюдавшихся эффектов практически не отличалась от аналогичных показателей через 16 ч после введения гормона: превышение скорости потребления глюкозы в группах 2 и 3 по сравнению с контролем составляло 14 и 20 % (P < 0.02) через 1 ч после введения гормона и 15 и 22 % (P < 0.05) через 16 ч.
Сходные закономерности в отношении действия кортикостерона на скорость потребления раствора глюкозы наблюдались и тогда, когда этот показатель оценивался в вечернее время (активная фаза) через 1 ч после введения гормона или растворителя. Отличие состояло лишь в том, что в этом случае скорость потребления глюкозы во всех группах крыс была существенно выше, чем в дневное время (в контрольной группе 1 скорость потребления глюкозы составляла 89.26 ± 3.41 мкл/мин в активной фазе, против 53.91 ± 2.17 мкл/мин в неактивной фазе, P < 0.01). Кроме того, эффекты кортикостерона в отношении скорости потребления глюкозы (в относительных, но не абсолютных единицах) были менее выраженными по сравнению с теми, которые имели место, когда этот показатель оценивался в дневное время. В вечернее время повышение скорости потребления глюкозы в группах 2 и 3 составляло 9.3 и 11 % (P < 0.05), а в дневное время – 15 и 22 % (P < 0.05) от соответствующего контроля. Этот результат согласуется с литературными данными, демонстрирующими более сильное влияние иммобилизационного стресса на метаболизм и энергетический баланс, когда это воздействие применяется в утренние, а не в вечерние часы [10].
Обнаруженный нами факт стимулирующего влияния кортикостерона (при его хроническом введении) на всасывание глюкозы перекликается с результатами ряда других исследований, в которых хроническое действие глюкокортикоидов (экзогенных или эндогенных, выделяющиеся при стрессе) анализировалось в опытах in vivo на анестезированных животных [5] или in vitro [9]. Полученные нами данные дополняют имеющиеся сведения, показывая, что в области физиологических концентраций кортикостерона в крови его эффект в отношении всасывания глюкозы проявляет тенденцию к зависимости от дозы гормона, но не от длительности его введения (по крайней мере при введении гормона в течение 3 недель).
Повышение всасывания глюкозы в тонкой кишке под влиянием глюкокортикоидов, имитирующих действие стресса, может рассматриваться как нормальный физиологический адаптивный ответ. В пользу такой точки зрения свидетельствует также тот факт, что при инфузиях глюкокортикоидов увеличивается потребление калорийной пищи у человека и животных [3]. Более того, в опытах на адреналэктомированных крысах с различным уровнем кортикостерона в крови показано, что эти животные не потребляют большего количества пищи, чем интактные животными, когда содержатся на стандартной диете, но в случае доступности сахарозы и (или) жиров, они потребляют эту пищу в прямой зависимости от концентрации циркулирующих глюкокортикоидов [3].
В рамках нашего исследования при варьировании таких параметров как доза гормона и длительность его введения (имитация интенсивности и частоты стрессорного воздействия) нам не удалось выявить изменений во всасывании глюкозы, которые могли бы свидетельствовать о наличии патологической (дезадаптивной) реакции. Частично это может быть связано с относительно непродолжительным (по срокам) введением гормона в наших опытах или с тем, что патологический ответ может формироваться в сочетании с другими характеристиками стрессора (например, природа стрессора, длительность действия глюкокортикоидов в организме при каждом отдельном акте стрессорной нагрузки).
Заключение
Таким образом, согласно полученным результатам, при хроническом введении крысам кортикостерона в дозах, обеспечивающих физиологические концентрации гормона в крови, несмотря на снижение прироста массы тела животных, происходит увеличение скорости свободного потребления ими концентрированного раствора глюкозы, что свидетельствует о повышении всасывания глюкозы в тонкой кишке. Оно зависит от дозы гормона, но не меняется при увеличении длительности его введения. Анализ полученных результатов в совокупности с данными литературы позволяет рассматривать такую реакцию всасывания глюкозы на глюкокортикоиды, экзогенные или секретируемые при стрессе, как нормальный физиологический адаптивный ответ. Для выявления факторов, способствующих трансформации физиологического ответа всасывания глюкозы в патологический (дезадаптивный), необходимы дальнейшие исследования, касающиеся, в частности, влияния специфических характеристик, присущих конкретным стрессорам.

