Исследовано анодное растворение, пассивация и депассивация кадмия в боратном буферном растворе в зависимости от концентрации борсодержащих анионов [1], органических и неорганических анионов [2, 3], а также ряда органических веществ: гидрохлорида акридина, 1,8-диметоксинафталина, 1-этил-2-(2,-фурил)фенантро-9,10-имидазола, 9-аминоакридина [4], бензотриазола (БТА) [5], вератровой и 3,4-диметилфенилантраниловой кислот [6]. Показано, что борсодержащие анионы принимают непосредственное участие в анодном растворении кадмия. С ростом их концентрации скорость анодного растворения кадмия увеличивается [1]. Установлено, что при фиксированной СА способность анионов вызывать депассивацию кадмия снижается в ряду SO42- > Cl- > NO3- [2, 3]. Введение в боратный раствор сульфата низких концентраций (до 0,5 мМ) хорошо ингибирует растворение кадмия по сравнению с гидрохлоридом акридина, 1,8-диметоксинафталином, 1-этил-2-(2,-фурил)фенантро-9,10-имидазолом и 9-аминоакридином, но с ростом концентрации он ускоряет растворение. В пассивной области органические добавки тормозят процесс растворения [4].
Установлено, что БТА, введенный в боратный буфер (рН 7,4), уменьшает скорость анодного растворения кадмия и затрудняет его переход в пассивное состояние. БТА препятствует хемосорбции кислорода и образованию оксидно-гидроксидной пассивной пленки. Показано, что при увеличении потенциала растет доля тока, которая расходуется на формирование оксида. БТА слабо тормозит анодное растворение кадмия и при росте потенциала наблюдается увеличение коэффициента торможения [5]. Установлено, что в боратном растворе вератровая кислота является более эффективным ингибитором коррозии и анодного растворения кадмия, чем 3,4-диметилфенилантраниловая [6]. Данных о влиянии других ароматических кислот на электрохимическое поведение кадмия в боратных растворах не обнаружено.
В связи с этим, целью данной работы являлось изучение влияния бензойной, 4-аминобензойной, 3-нитробензойной и 3-нитро-4-аминобензойной кислот в широком интервале концентраций на электрохимическое поведение кадмия в боратном буфере (рН 7,4).
Материалы и методы исследования
В работе использовали кадмий марки «ч.д.а.». Образец в форме цилиндра рабочей площадью 0,28 см2 армировали в эпоксидную смолу для поляризационных, потенциостатических и гальваностатических измерений. Перед измерениями электрод зачищали абразивной бумагой, полировали, обезжиривали этанолом и предварительно поляризовали в течение 1 мин при Е = – 1,2 В. Рабочим электролитом служил боратный буферный раствор (рН 7,4), а в качестве добавок исследовали бензойную (БК,1), 4-аминобензойную (4АБК, 2), 3-нитробензойную (3НБК, 3) и 3-нитро-4-аминобензойную (3Н4АБК,4) кислоты. Интервал исследованных концентраций С ароматических кислот 0,05 – 1 ммоль/л.
Поляризационные измерения проводили с помощью потенциостата ПИ-50.1.1 в трехэлектродной ячейке с разделенным катодным и анодным пространством. В качестве электрода сравнения использовали хлоридсеребряный электрод ЭВЛ-1М, противоэлектродом служила платина. Поляризационные кривые снимали ступенчато через 50 мВ с выдержкой при каждом заданном потенциале в течение одной минуты. Ток регистрировали с помощью универсального прибора В7-35.
Хроноамперограммы снимали при потенциале Е = – 0,6 В на предварительно активированном при Е = – 1,2 В в течение 3-х минут кадмиевом электроде. Хронопотенциограммы снимали после i, τ-кривых при плотности катодного тока iк = – 1,43 А/м2.
Результаты исследования и их обсуждение
На рис. 1 представлена поляризационная кривая Cd, полученная в исследованном растворе. Скорость катодного выделения водорода на кадмии несущественно зависит от потенциала и протекает в режиме, близком к предельному. На анодной кривой наблюдаются два пика, которым соответствуют токи iап,1 и iап,2. Первый пик четко выражен и начальное снижение тока обусловлено образованием пленки оксида/гидроксида кадмия. Пассивирующие свойства пленки малы и при потенциале Е = – 0,5 В реализуется рост тока. На кривой проявляется слабо выраженный второй анодный пик или ступень. В данной области потенциалов, очевидно, поры пленки заполняются малорастворимыми солями кадмия и она уплотняется. Следствием этого является уменьшение скорости процесса и Cd переходит в устойчивое пассивное состояние. Следует отметить, что ток в первом анодном пике и скорость процесса в области устойчивого пассивного состояния отличаются всего лишь в два раза. введение органических кислот меняет скорости катодной и анодной реакций на кадмиевом электроде за счет изменения строения двойного электрического слоя и состава анодных продуктов (рис. 1).
Скорость катодной реакции зависит от концентрации БК. Тормозящее действие на выделение водорода БК оказывает лишь при наименьшей концентрации. С ростом С наблюдается стимулирование процесса, очевидно обусловленное разрядом водорода из кислоты. БК не меняет потенциал коррозии Екор и при большинстве С тормозит анодное растворение кадмия. При С ≤ 10-4 моль/л БК снижает значения токов iап,1 и iап,2 при потенциалах первого Еап,1 и второго Еап,2 анодных пиков, табл. 1.
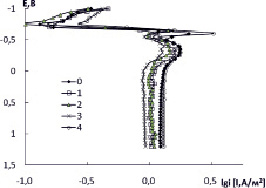
Рис. 1. Поляризационные кривые кадмия в боратном буфере (0) и в присутствии бензойной (1), 4-аминобензойной (2), 3-нитнобензойной (3) и 3-нитро-4-аминобензойной (4) кислот при С = 0,1 ммоль/л
Таблица 1
Некоторые параметры поляризационных кривых кадмия в боратном растворе без и при наличии ароматических кислот
|
параметр |
Значение параметра при С, ммоль/л |
|||||||
|
0 |
0,005 |
0,01 |
0,05 |
0,1 |
0,5 |
1 |
||
|
Бензойная кислота |
||||||||
|
iЕ = -0,9В, А/м2 |
0,24 |
- |
0,20 |
0,33 |
0,25 |
0,38 |
0,73 |
|
|
-Екор, В |
0,7 |
- |
0,7 |
0,7 |
0,7 |
0,7 |
0,7 |
|
|
-Еап,1,В |
0,6 |
- |
0,6 |
0,6 |
0,6 |
0,6 |
0,6 |
|
|
iап,1, А/м2 |
2,07 |
- |
1,26 |
1,09 |
1,16 |
2,02 |
1,99 |
|
|
-Еап2, В |
0,35 |
- |
0,4 |
0,4 |
0,35 |
- |
0,35 |
|
|
iап,2, А/м2 |
1,77 |
- |
1,55 |
1,42 |
1,61 |
- |
2,16 |
|
|
4-аминобензойная кислота |
||||||||
|
iЕ=-0,9В, А/м2 |
0,24 |
- |
0,19 |
0,16 |
0,19 |
0,20 |
0,22 |
|
|
-Екор, В |
0,7 |
- |
0,7 |
0,75 |
0,7 |
0,7 |
0,7 |
|
|
-Еап,1,В |
0,6 |
- |
0,6 |
0,65 |
0,65 |
0,6 |
0,6 |
|
|
iап,1, А/м2 |
2,07 |
- |
1,83 |
1,60 |
1,41 |
2,75 |
2,76 |
|
|
-Еап2, В |
0,35 |
- |
0,45 |
0,4 |
0,3 |
0,4 |
0,35 |
|
|
iап,2, А/м2 |
1,77 |
- |
1,55 |
1,46 |
1,46 |
1,74 |
1,89 |
|
|
3-нитробензойная кислота |
||||||||
|
i Е=-0,9В, А/м2 |
0,24 |
- |
0,17 |
0,37 |
0,25 |
0,70 |
1,03 |
|
|
-Екор, В |
0,7 |
- |
0,7 |
0,7 |
0,7 |
0,65 |
0,65 |
|
|
-Еап,1,В |
0,6 |
- |
0,6 |
0,65 |
0,65 |
0,65 |
0,3 |
|
|
i ап,1, А/м2 |
2,07 |
- |
1,25 |
1,47 |
1,51 |
0,94 |
1,60 |
|
|
-Еап2, В |
0,35 |
- |
0,4 |
0,4 |
0,4 |
0,35 |
- |
|
|
iап,2, А/м2 |
1,77 |
- |
1,36 |
1,40 |
1,31 |
1,49 |
- |
|
|
3-нитро-4-аминобензойная кислота |
||||||||
|
i Е=-0,9В, А/м2 |
0,24 |
0,23 |
0,28 |
0,35 |
0,37 |
0,63 |
- |
|
|
-Екор, В |
0,7 |
0,7 |
0,7 |
0,7 |
0,7 |
0,7 |
- |
|
|
-Еап,1,В |
0,6 |
0,6 |
0,6 |
0,6 |
0,6 |
0,6 |
- |
|
|
i ап,1, А/м2 |
2,07 |
2,46 |
2,51 |
3,77 |
3,28 |
1,58 |
- |
|
|
-Еап2, В |
0,35 |
0,4 |
- |
- |
0,4 |
0,25 |
- |
|
|
iап,2, А/м2 |
1,77 |
1,67 |
- |
- |
1,73 |
1,65 |
- |
|
При С = 1 ммоль/л добавка не влияет на потенциал и ток первого анодного пика, а при росте Е стимулирует растворение кадмия и способствует выходу из пассивного состояния. Введение заместителей в бензольное кольцо приводит к изменению действия производных бензойной кислоты как на скорость катодной, так и анодной реакций (рис. 1). 3НБК и 3Н4АБК практически при всех С в равной степени увеличивают, а 4АБК уменьшает скорость катодной реакции на кадмии. Чувствительность скорости катодного выделения водорода к С рассмотренных кислот различна. Скорость катодной реакции меньшей степени зависит от концентрации 4АБК, чем от концентрации 3НБК, табл. 1.
Отличается и действие замещенных бензойных кислот на анодное растворение кадмия. Так, 3-нитробензойная кислота при С ≤ 0,5 ммоль/л уменьшает Еап,1 и iап,1, а при С = 1 ммоль/л первый анодный пик не реализуется из-за роста потенциала коррозии. Практически при всех концентрациях 3НБК ингибирует анодное растворение кадмия, а ее эффективность снижается с ростом С. Введение в пара – положение аминогруппы ведет к изменению влияния на анодное растворение кадмия по сравнению с 3-нитробензойной кислотой. Так, отсутствует линейная зависимость iап,1 от С 3-нитро-4-аминобензойной кислоты. Данная зависимость напоминает  -образную: до С = 0,05 ммоль/л скорость процесса растет, а затем снижается и при С = 0,5 ммоль/л она меньше, чем в боратном растворе без добавки. Тормозящее действие 3Н4АБК при всех С ниже, чем 3-нитробензойной кислоты. В присутствии 4АБК при некоторых С наблюдается уменьшение Екор и Еап,1 и за счет этого проявляется кажущееся стимулирование активного растворения кадмия, хотя ток в пике меньше, чем в боратном растворе. При высоких концентрациях ток при Еап,1 и Еап,2 больше, чем в борате. При малых и средних С 4АБК по эффективности близка к БК.
-образную: до С = 0,05 ммоль/л скорость процесса растет, а затем снижается и при С = 0,5 ммоль/л она меньше, чем в боратном растворе без добавки. Тормозящее действие 3Н4АБК при всех С ниже, чем 3-нитробензойной кислоты. В присутствии 4АБК при некоторых С наблюдается уменьшение Екор и Еап,1 и за счет этого проявляется кажущееся стимулирование активного растворения кадмия, хотя ток в пике меньше, чем в боратном растворе. При высоких концентрациях ток при Еап,1 и Еап,2 больше, чем в борате. При малых и средних С 4АБК по эффективности близка к БК.
Анализ анодных хроноамперограмм кадмия, снятых при потенциале активного растворения (Е = – 0,6 В) в боратном буфере без и при наличии добавок (С = 0,5 ммоль/л), показывает, что в большинстве случаев кадмий растворяется в условиях смешанного контроля в соответствии с уравнением (1) и лишь в присутствии 3-нитро-4-аминобензойной кислоты в начальные промежутки времени лимитируется нестационарной жидкофазной диффузией (2).
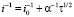 (1)
(1)
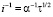 , (2)
, (2)
где i0 – скорость электрохимической стадии процесса, а α– параметр, определяемый коэффициентом жидкофазной диффузии, потенциалом и др. Он зависит от рассматриваемого временного интервала, табл. 2.
При активном растворении на поверхности начинает формироваться пассивирующая оксидная пленка, доказательством наличия которой является задержка потенциала на хронопотенциограммах, обусловленная восстановлением соединений кадмия (рис. 2).
По количеству электричества, пропущенного через систему при снятии хроноамперограмм и хронопотенциограмм, установлено, что доля тока, затраченная на формирование пассивирующей пленки, составляет 6 % в чистом буфере и 3 – 9 % в растворе с добавками. 4АБК препятствует образованию оксидной пленки, а 3НБК способствуют ее формированию. Влияние органических кислот может быть обусловлено их адсорбцией на поверхности и образованием основных или средних солей кадмия.
Таблица 2
Характеристики уравнений 1 и 2 в зависимости от природы добавки и интервала времени
|
Добавка |
Значения параметров уравнений (1) и ( 2) |
|||||||||||
|
τ, мин |
i0-1, A/м2 |
α-1 *103 |
R, % |
τ, мин |
i0-1, A/м2 |
α-1 *104 |
R, % |
τ, мин |
i0-1, A/м2 |
α-1 *104 |
R, % |
|
|
0 |
до 2,5 |
0,2 |
5 |
99 |
До 10 |
1,0 |
7 |
99 |
<30 |
1,4 |
1 |
99 |
|
1 |
до 0,5 |
0,3 |
10 |
99 |
до 7,5 |
0,7 |
6 |
99 |
<30 |
0,9 |
2 |
95 |
|
2 |
до 0,5 |
0,1 |
152 |
98 |
до 10 |
0,7 |
9 |
99 |
<30 |
1,3 |
1 |
99 |
|
3 |
до 0,5 |
0,1 |
29 |
98 |
до 0,5 |
-0,1 |
62 |
89 |
<30 |
1,5 |
8 |
99 |
|
4 |
до 0,7 |
- |
23 |
98 |
2,5-7,5 |
1,0 |
0,5 |
92 |
<30 |
1,3 |
4 |
93 |
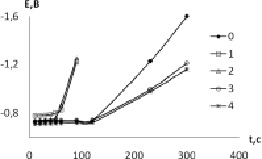
Рис. 2. Хронопотенциограммы кадмия, полученные в боратном растворе без (0) и при наличии органических кислот (1-4), iк= – 1,43 A/м2
Выводы
1. Большая часть изученных ароматических кислот стимулирует катодное выделение водорода на кадмии и ингибирует его анодное растворение.
2. Активное растворение кадмия в чистом боратном растворе и в присутствии исследованных кислот протекает в условиях диффузионно-кинетического контроля.
3. Доля тока активного растворения кадмия, расходуемая на формирование пассивирующей пленки в боратном растворе без и при наличии органических кислот, составляет менее десяти процентов.

