Актуальность вопроса
Злокачественная опухоль – это динамическая система, которую следует рассматривать в комплексе со всеми морфологическими составляющими, формирующими ее микроокружение: клетки стромы, клетки системы иммунитета, кровеносные, лимфатические сосуды и экстрацеллюлярный матрикс [1, 2].
Инфильтрирующие опухоль клетки иммунной системы в последнее время являются объектом пристального внимания ученых [3, 4, 5]. Им отводится ключевая роль в концепции «противоопухолевого иммунитета». Многообразие субпопуляций этих клеток, продуктов их синтеза и путей взаимодействия может объяснять их возможное диаметрально противоположное действие: от механизмов противоопухолевой защиты до стимуляции прогрессии канцерогенеза.
Хроническое воспаление, по данным литературы, повышает риск развития опухоли и потенциирует ее прогрессирование [6]. Однако, некоторые формы асептического воспаления могут быть факторами противоопухолевой защиты и индуцироваться в ответ на злокачественную инвазию. Основным участником воспаления являются нейтрофилы, которые в нашей работе оценивались количественно в строме опухоли и микроокружении.
Эозинофилы также оказывают разнонаправленное действие. С одной стороны они активно взаимодействуют с клетками в участках воспаления, с другой стороны появились данные, свидетельствующие, что активированные эозинофилы секретируют хемоаттрактанты, которые «дирижируют» Т-лимфоцитами, направляя их в опухоль, а также изменяют микроокружение путем поляризации макрофагов и способствуют нормализации васкуляризации [7, 8].
Роль натуральных киллеров в опухоли довольно широко изучена [9, 10, 11, 12]. Инфильтрация опухоли цитотоксическими Т-лимфоцитами в настоящее время является одним из ключевых факторов прогнозирования течения опухолевого процесса, а также рассматривается в качестве предиктора эффективности иммунотерапии [13].
Целью данной работы стало изучение количественных соотношений нейтрофилов, эозинофилов и цитотоксических Т-лимфоцитов в строме опухоли и ее ближайшем микроокружении в аденокарциномах желудочно-кишечного тракта и эпителиальных опухолях головы и шеи, корреляция их выявляемости с течением опухолевого процесса и эффективностью лечения.
Материалы и методы исследования
Под нашим наблюдение находилось 18 пациентов, проходивших лечение в СПб ГБУЗ «Городской клинически онкологический диспансер» с диагнозом: плоскоклеточный рак слизистой оболочки полости рта и орофарингеальной зоны. В исследовании приняли участие 8 женщин и 10 мужчин, в возрасте от 44 до 84 лет, медиана возраста составила 64 года (CI 95 % от 60,2325 до 71,8786, p < 0,0001).
У 7 пациентов первичный опухолевый очаг локализовался в области боковой поверхности передней или средней третей языка, у 4 пациентов первично была поражена задняя треть языка, 4 имели поражение слизистой оболочки дна полости рта, у 2 диагностировано поражение альвеолярной части нижней челюсти и 1 пациент страдал наличием опухоли в области слизистой оболочки крыло-челюстной складки.
После стандартного обследования и стадирования у 2 пациентов зарегистрирована I стадия заболевания (T1N0M0), у 3 пациентов – II стадия (T2N0M0), III стадия – у 2 пациентов (1 – T1N1M0, 1 – T2N1M0), у остальных 11 пациентов была зарегистрирована IV стадия опухолевого процесса (2 – T4N1M0, 9 – T4N2M0).
При морфологическом исследовании у 10 пациентов была выявлена высокая дифференцировка опухоли, у 3 она была умеренная, и у 2 – низкая; у 3 пациентов дифференцировка опухолевого процесса не была определена. У 11 больных были выявлены гистологические признаки ороговения, у 4 данных за наличие ороговения не получено и у 3 – данный показатель не определен.
15 из 18 пациентов было проведено исследование нативной опухолевой ткани на содержание в ней вирусной ДНК или РНК с помощью метода ПЦР. были определены следующие виды вирусов: HSV I и II типов, EBV, CMV, HPV 6,11 типов, HPV 16 типа и HPV 18 типа.
Ни в одном, из исследуемых образцов не были обнаружены следы HSV I и II типов, CMV, а также HPV 16 типа. У 4 пациентов было зарегистрировано наличие EBV, у 3 – HPV 6,11 типов и у 2 – HPV 18 типа. Причем у 1 пациента было выявлено наличие EBV и HPV 18 типа, и у 1 – HPV 6,11 типов и HPV 18 типа.
Результаты исследования и их обсуждение
Проведенное ИГХ-исследование иммунофенотипа опухоли и микроокружения показало следующие результаты.
Показатель нейтрофильного звена микроокружения варьировал в пределах от 5 до 1000 клеток в кв.мм. (8 стандартных полей зрения): средний показатель составил 266,0556 ± 67,6979 (95 % CI от 23,2255 до 308,8856; p < 0,0257); медиана количества нейтрофилов составила 34,5 кв.мм. (95 % CI от 18,7947 до 107, 6158).
Эозинофильный компонент варьировал в пределах от 0 до 872 клеток в кв.мм., причем только у 1 пациента от достиг максимального предела (872 клетки), у остальных 17 данный компонент значения распределись следующим образом: у 7 пациентов эозинофилы выявлены не были, у 2 пациентов были выявлены 3 и 4 клетки соответственно, у 2 пациентов количество эозинофилов составило 16 клеток, и у стальных больных зарегистрировано 29, 39, 48 и 53 клетки в 1 кв.мм. Средний показатель количества эозинофилов и его медиана были рассчитаны без учета экстремально высокого уровня клеток (872) и составили: среднее количество эозинофилов – 12,8824 ± 4,4108 клеток (95 % CI от 3,5319 до 22,2328; p = 0,01), медиана – 3 клетки (95 % CI от 0,0000 до 16,0000).
Экспрессия CD8 колебалась в пределах от 190 до 1380 клеток/кв.мм., средний показатель составил 551,2778 ± 80,7383 (95 % CI от 380,9349 до 721,6207; p < 0,0001), медиана – 542,5000 (95 % CI от 250,3315 до 763,1692).
Исследование корреляционных зависимостей позволило обнаружить следующие закономерности.
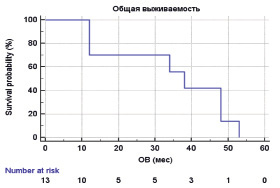
Рис. 1. Общая выживаемость (ОВ) пациентов в плоскоклеточным раком головы и шеи
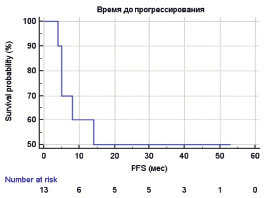
Рис. 2. Время без прогрессирования () пациентов в плоскоклеточным раком головы и шеи
Количество нейтрофилов обратно коррелирует с наличием ороговения опухоли, r = – 0,6327 (95 % CI от – 0,8647 до – 0,1783; p = 0,0114).
Количество эозинофилов в данной группе пациентов не показало корреляции с характеристиками опухолевого процесса пациентов.
Экспрессия CD8 обратно коррелировала с размером первичного опухолевого очага (критерий T), r = – 0,5332 (95 % CI от -0,8008 до -0,08836; p = 0,0227) и стадией опухолевого процесса, r = – 0,4756 (95 % CI от – 0,7712 to – 0,01118; p = 0,0461) и имела прямое корреляционное взаимоотношение с наличием ороговения опухоли r = 0,5368 (95 % CI от 0,03382 to 0,8228; p = 0,0391).
Сравнение показателей иммунофенотипа опухоли и ее микроокуржения между собой на данной выборке достоверных корреляционных зависимостей не выявило.
Нами была оценена общая и безрецидивная выживаемости пациентов с использованием модели Kaplan-Meier: медиана общей выживаемости составила 38 месяцев (95 % CI от 12,000 до 48,000); медиана времени до прогрессирования составила 14 месяцев (95 % CI от 5,000 до 14,000).
Также нами был проведен многофакторный (с использованием модели Кокса) анализ влияния количественных показателей наличия нейтрофилов, эозинофилов и экспрессии CD8 на общую выживаемость пациентов и на время до прогрессирования заболевания. Достоверных влияний пока не выявлено, что вероятнее всего связано с малым объемом выборки, однако о тенденции к влиянию на общую выживаемость говорить уверенно можно, что, безусловно подтверждает прогностическую ценность этих показателей.
На общую выживаемость вероятность влияния экспрессии CD8 составила p = 0,1655 (95 % CI of Exp(b) от 0,9794 до 1,0035), вероятность влияния нейтрофильного компонента – p = 0,1546 (95 % CI of Exp(b) от 0,9951 до 1,0008), а эозинофильного – p = 0,2242 (95 % CI of Exp(b) от 0,9972 до 1,0122). Общий уровень значимости модели Кокса составил p = 0,1368.
На время до прогрессирования вероятность влияния малозначительна: значимость экспрессии CD8 составила p = 0,6887 (95 % CI of Exp(b) от 0,9943 до 1,0038), вероятность влияния нейтрофильного компонента – p = 0,9759 (95 % CI of Exp(b) от 0,9963 до 1,0036), а эозинофильного – p = 0,4248 (95 % CI of Exp(b) от 0,8689 до 1,0607). Общий уровень значимости модели Кокса составил p = 0,4328.
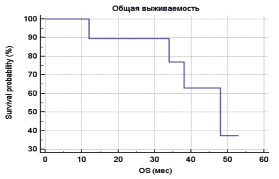
Рис. 3. Влияние экспрессии CD8, нейтрофильной и эозинофильной инфильтрации на общую выживаемость (модель Кокса)
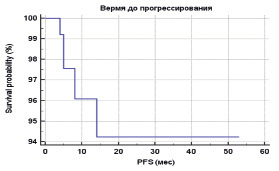
Рис. 4. Влияние экспрессии CD8, нейтрофильной и эозинофильной инфильтрации на время без прогрессирования (модель Кокса)
Заключение
Проведенное нами исследование позволяет сделать следующие выводы:
1. Анализ инфильтрирующих строму и микроокружение лимфоцитов показал, что плоскоклеточный рак головы и шеи являются весьма гетерогенными по данному признаку.
2. В плоскоклеточных эпителиальных опухолях головы и шеи количественный показатель инфильтрирующих лимфоцитов оказывает влияние на показатели общей и безрецидивной выживаемости пациентов.
3. Проведенный корреляционный анализ позволил выявить прогностическую и предиктивную ценность иммунологического микроокружения опухоли (особенно плоскоклеточного рака головы и шеи), поскольку уверенно показал влияние экспрессии CD8 Т-лимфоцитов, нейтрофилов и эозинофилов на клиническое течение заболевания и степень ответа на проводимую терапию.

