Клинико-диагностические данные морфологии биологических жидкостей позволяют выявлять патологические отклонения на разных этапах опухолевого роста, что расширяет представление о патогенезе онкозаболевания и характеризует эффективность проводимого лечения. Являясь частью внутренней среды, капля биожидкости (сыворотка крови, слюны, мочи, ликвора и др.) отражает основные черты самоорганизации всей сложной системы взаимосвязей в организме, хаоса и порядка, энтропии и негэнтропийных процессов, происходящих в результате патологических процессов в организме [1, 2, 3. 4, 5].
В связи с вышесказанным целью исследования явилось оценка структурных маркеров патологических процессов фации сыворотки крови больных раком полости рта (РПР) при лучевом лечении в сочетании с локальной сонодинамической химиотерапией.
Материалы и методы исследования
Пациенты местнораспространенным РПР Т2-4N0-2M0 были разделены в зависимости от варианта лечения на основную (31 больных) и контрольную (30 больных) группы. По возрасту и основным клиническим параметрам группы были сопоставимы. Больным обеих групп проводилась ДГТ с традиционно расщепленным курсом: разовая очаговая доза (РОД) в 2,4 Гр. по 1,2 Гр с интервалом между ними 5 часов. Пациентам основной группы при ДГТ в середине интервала между отдельными фракциями РОД на первичный очаг опухоли через день осуществлялась локальная сонодинамическая химиотерапия (СДХ) с использованием среднечастотного УЗВ (частота 0,88 МГц, I = 0,4-1,0 Вm/см2, время экспозиции 5-10 мин) с 5 мг сухого платидиама, смешанного «ex tempore» с 0,25 см3 стоматологического солкосерил-геля. На первичный очаг на 1 этапе подводилась суммарная очаговая доза 40 изоГр [6].
Оценивали особенности твердотельных образцов сыворотки крови (фации сыворотки крови) у 5 практически здоровых людей и больных РПР в зависимости от эффекта лечения. Для получения фации осуществляли забор венозной крови в объеме 2 см3, центрифугированием отделяли клеточные элементы и полученную биожидкость наносили на предметное стекло в объеме 10 мкл. Процесс дегидратации длился 18–22 часа при температуре 22–24 °С и влажность 65–70 % в открытых условиях без прямых потоков воздуха. Оценку морфоструктуры фации осуществляли с помощью микроскопа «Leica» DMLS2 с увеличением от х20 до х90.
Результаты исследования и их обсуждение
В норме определяются три зоны фации сыворотки: центральная, краевая и промежуточная. Причем, центральная выполнена дендритными структурами кристаллов солей, а краевая (белковая) аморфна с зернистыми кристаллическими вкраплениями и системой прикраевых трещин радиальной направленности с соединением в аркады. В условиях патологии появляются специфические изменения в физико-химическом составе и морфологической картине фации сыворотки [2]. Маркеры патологических процессов не были выявлены.
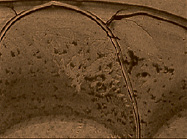
При изучении текстуры фаций сыворотки до начала лечения и в процессе роста опухоли в 100 % случаев установлено нарушение нормотипа структуропостроения. Краевая зона, как правило, была аморфизирована или с небольшим количеством хаотически расположенных тонких коротких трещин. В центральной зоне отмечалось резкое угнетение кристаллизации солей. Единичные кристаллы полностью утрачивали дендритную форму, имели линейный характер роста с образованием ветвей первого порядка. При краевой дегидратации выявлялись маркеры деструкции, которые представляли собой кристаллы высвобожденного холестерина. В отдельных фациях наблюдалось формирование наслаивающихся друг на друга ступенчатых прямоугольных пластин неправильной формы, была отмечена высокая концентрация токсических эндогенных белков, обусловливающая появление структур типа «морщин» и токсических «бляшек». По всей окружности краевой и промежуточной зоны отмечали присутствие маркеров воспалительных процессов в виде полей разветвлённых языков Арнольда и ковров Серпинского (рис. 1). Наблюдали растрескивание белковой краевой зоны и образование коротких циркулярных, а также лучевых трещин вокруг округлых белковых конгломератов высокой плотности. Ближе к центральной зоне были заметны структуры, демонстрирующие процессы подавления роста солей белками, которые оплавляли формирующиеся ветви солей и блокировали их надмолекулярную структуру. Промежуточная зона, как и краевая, отличалась высоким уровнем содержания гранул патологических белков, наличием аномальной формой жидких кристаллов, цветных включений с оттенками розового, малинового, желтого и коричневого цвета. Иными словами, избыток патогенных продуктов, главным образом воспалительных и токсических белков, а также холестерина, обуславливал сбой процессов самоорганизации, что выражалось нарушением ауторитмов кристаллизации белков и солей. Неравномерность слоев белка, отсутствие системы трещин краевой зоны, появление маркеров некробиотических и деструктивных изменений отражали картину патоморфологических изменений сыворотки крови больных РПР. Такая картина фации сохранялась у больных РПР в случаях когда не удавалось получить клинический эффект от химиолучевых воздействий. Присутствие в сыворотке крови большого количества белков воспаления обуславливало преобладание суммарной энергетической и аутоволновой активности токсических продуктов воспалительных реакций над энергетическим потенциалом физиологических молекул Доминирование патологически устойчивых изменений свидетельствовало о хроническом десинхронозе и глубоких нарушениях системных взаимосвязей в результате сохранения влияния опухоли и неэффективности противоопухолевых воздействий.
Можно полагать, что увеличение фракций патологических белков при отсутствии регресса и стабилизации местно-распространенного РПР, обусловливает возможность их внесистемной агрегации и включению механизмов фолдинга, что приводит к образованию визуализированных мультипленочных адгезивных структур кластерной природы с различной пространственной симметрией. Нами были морфологически идентифицированы скручивающиеся в трубки пленки с элементами доменной структуры. Известно, что чем выше онкотическая активность белка, тем плотнее он сжимает солевые структуры и тем меньше диаметр конкреции и более четко выражен окружающий по периметру белковый слой [2].


а б
в
Рис. 1. Фрагменты фаций сыворотки крови у больных РПР: а. при росте опухоли, б. стабилизация процесса с частичный регресс РПР. Маркеры воспаления – «языки Арнольда» и «поля Серпинского» (а, б, в); на фоне формирования системы радиальных трещин пигментные липидно-белковые когшломераты (в)
В случаях, когда при проведении комплексного лечения, включающего лекарственное, лучевое и локальное химиотерапевтическое воздействие с использованием ультразвука, наступала частичная регрессия опухоли (уменьшение объема более чем на 50 %), кристаллографическая картина сыворотки больных РПР менялась. При слабой регрессии и стабилизации роста опухоли ротовой полости была отмечена краевая кристаллизация воспалительных белков, проявившаяся в виде структурного рисунка известных «языков Арнольда» и «ковров Серпинского». В фациях РПР они формируются при наложении альтернативных волн соответствующей амплитуды и частоты и, по мнению В.Н. Шабалина и С.Н. Шатохиной [2], демонстрируют происходящие процессы аннигилляции с возникновением безритмического пространства. В данных наблюдениях при частичной регрессии опухоли можно отметить снижение онкотической активности белков основы фации и прочности белково-солевых агрегатов. Об этом свидетельствовали образованные концентрационные волны, формирование локальных внутрифрактальных волн и аннигиляций, которые были сформированы токсическими и воспалительными белками. Были выделены позитивные признаки самоорганизации в центральной зоне с преобладанием кристаллов солей крупных и средних размеров. Несмотря на доминирование линейного роста с ветвями I порядка, на препаратах фаций сыворотки выявлялись централизованные монокристаллы с ветвями II порядка. При более эффективном лечении рака слизистой полости рта под влиянием химиолучевой терапии с включением локальных воздействий лекарственного препарата и ультразвука наблюдалась сложная надмолекулярная перестройка компонентов сыворотки, наблюдалось ее очищение от патогенных включений и структурирование краевой зоны. Несмотря на восстановительный характер системной самоорганизации сыворотки крови больных при полной и частичной регрессии опухоли ротовой полости, можно было верифицировать морфологические маркеры сопутствующих патологических процессов. Помимо воспалительных реакций проявлялись признаки печеночной недостаточности. В центре фации кристаллизовались полидисперсные пигментированные конгломераты крупных и средних размеров, представляющие собой свободную форму продуктов незавершенного метаболизма печени с желчными пигментами. (Рис. 1). Насыщенность липопротеиновыми фракциями различной оптической плотности определялась по внутренней структуре отдельностей, особенно в краевой зоне. Однако, при полной регрессии опухоли, в фациях, наряду со специфическими воспалительными структурами, четко выявлялись мелкие и крупные темные конгломераты неопределенной формы – признаки деструктивных и некротических процессов. При частичной регрессии опухоли (полной и частичной) были также зафиксированы процессы «фолдинга» белка. При полной регрессии опухоли в фациях сыворотки крови также встречалась форма кристаллизации белка в виде «стекол» террасоподобной и трубчатой формы (рис. 2). Во всех случаях эффективного лечения также четко прослеживалась солевая кристаллизация в расширенной центральной зоне, заполнение промежуточной зоны мелкими белковыми гранулами, а также четкое структурирование краевой зоны с тенденцией нормотипу радиально-аркадных трещин. Доминирование синхронизированных ритмов комплементарных соединений белка (преимущественно, альбумина) и солей определило формирование полноценных радиальных трещин, равномерно делящих фацию на сектора.
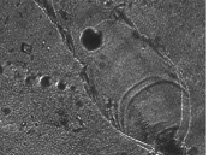
Рис. 2. Фрагменты фаций сыворотки крови у больных РПР: форма кристаллизации белка в виде «стекол»
В сыворотке крови было установлено восстановление системы радиальных трещин, соединяемых аркадами и образующими сектора, отдельности и конкреции, несмотря на присутствие морфологических маркеров сопутствующих патологических процессов и специфических аллотропных форм белка типа «стекол», оцениваемый в литературе как возможный маркер опухолевого процесса [1, 3]. Иными словами, при более эффективном лечении рака слизистой полости рта под влиянием химиолучевой терапии с включением локальных воздействий лекарственного препарата и ультразвука наблюдалась сложная надмолекулярная перестройка компонентов сыворотки крови. Она характеризовалась, с одной стороны, заметным упорядочиванием белково-солевых соотношений самой биожидкости с восстановлением зонального расположения кристаллизации солей и роста ветвей I и II порядка, обеспечивающих активизацию биоминерализации, как эффективного механизма обезвреживания влияния патогенных продуктов метаболизма. С другой стороны, фиксировалось усиление попадания в окружающую среду регрессирующей опухоли элементов некротических и деструктивных процессов, сопровождающих рассасывание опухолевого очага. Это было наглядно продемонстрировано образованием в фациях сыворотки «капсул» с оптически плотными белковыми конгломератами округлой и трубчатой форм, скоплением пигментированных липидно-белковых конгломератов.
Таким образом, было показано, что при развитии патологических процессов в фации сыворотки крови грубо нарушаются не только системные (трещины, сектора) и подсистемные признаки самоорганизации, но и появляются структурные маркеры патологических процессов: интоксикации – токсических белков в виде «морщин» и «бляшек», воспалительных белков – «языки Арнольда» и «поля Серпинского», кристаллов в виде «стекол».
Заключение
В фациях сыворотки крови больных РПСР обнаружена высокая распространенность маркеров патологических процессов типа «ковров Серпинского», токсических «бляшек», скоплений пигментированных липидно-белковых конгломератов. Можно предполагать, что одномоментно с полной регрессией опухоли на уровне организма не исчезают процессы десинхроноза и нарушения метаболизма внутренних органов, особенно проявления воспалительных и токсических реакций, а восстановление гомеостаза происходит постепенно. Таким образом, клинико-диагностические данные морфологии биологических жидкостей позволяют выявлять патологические отклонения на разных этапах опухолевого роста, что расширяет представление о патогенезе онкозаболевания и характеризует эффективность проводимого лечения.

