Наследственная предрасположенность к развитию мигрени хорошо известна и доказана эпидемиологическими генетическими исследованиями [6]. Изучение генома в семьях пациентов с гемиплегической мигренью позволило выявить пять типов мигрени с моногенным наследованием (семейная гемиплегическая мигрень I, II, III, IV, V). Однако эти формы встречаются исключительно редко, и в развитии обычной мигрени с аурой или без ауры участия не принимают [10]. Первое полногеномное исследование (GWAS) обычной мигрени было опубликовано в 2010 году [2]. В это исследование вошли почти 6 тысяч пациентов с мигренью с аурой или без ауры из различных стран Европы (Голландия, Дания, Финляндия, Германия, Исландия) и более 40 тысяч здоровых лиц. Исследование позволило выявить, что наличие минорного аллеля Т замены rs1835740 (XR_928434.1:n.1748 + 4013T > C) в локусе 8q22.1 повышает риск развития мигрени, в особенности мигрени с аурой. Однако, в исследовании «случай-контроль», проведённом в испанской популяции, включившем 1521 пациента с мигренью и 1379 здоровых, достоверных различий частот аллелей rs1835740 не было получено [9].
Замена rs1835740 находится между генами MTDH (metadherin) и PGCP, которые вовлечены в обмен глутамата. При количественном анализе транскрипционной активности гена MTDH в линии лимфобластоидных клеток было обнаружено, что уровень экспрессии имеет значительную корреляцию с данной заменой – минорный вариант Т ассоциирован с высоким уровнем транскрипционной активности гена [2]. В более ранних исследованиях было показано, что MTDH негативно регулирует уровень экспрессии гена SLC1A2 (известный также как EEAT1), кодирующего основной белок-переносчик глутамата [1]. Наличие аллеля Т rs1835740 ведет к накоплению внеклеточного глутамата, активирующего участвующие в центральной сенсибилизации НМДА-рецепторы, что снижает порог нейрональной возбудимости [8]. Кроме того, эта замена находится недалеко от гена PGCP, кодирующего глутамат-карбоксипептидазу – активатора активности астроцитов и, следовательно, происходит снижение порога возникновения распространяющейся корковой депрессии, основного патофизиологического коррелята ауры мигрени [2].
Можно предположить, что полиморфизм rs1835740 обуславливает более тяжелое течение мигрени. В исследовании Esserlind с соавторами [5], в которое вошли 691 пациент с мигренью с аурой, изучались детали клинических проявлений мигрени в зависимости от генотипа (42 % оказались носителями Т-аллеля). Носители Т-аллеля имели тенденцию к большей представленности симптомов во время ауры, а также к меньшей выраженности головной боли и представленности сопутствующих симптомов. У гомозигот ТТ эти клинические особенности не были более выражены. Авторами был сделан вывод, что Т-аллель замены rs1835740 увеличивает риск развития мигрени, но не влияет на симптомообразование мигрени с аурой.
В исследовании Christensen с соавторами [4] проводился фенотипический анализ носителей Т-аллеля rs1835740 среди пациентов с мигренью без ауры. Было включено 339 пациентов, 40 % были носителями T-аллеля. Не было получено достоверных различий по представленности характеристик и симптомов приступов мигрени, по наличию коморбидных расстройств, по представленности триггеров мигренозного приступа, по влиянию изменений гормонального фона (беременность, прием КОК, постменопауза) на частоту приступов мигрени, а также по эффективности триптанов и превентивной терапии.
Эти исследования не дают однозначный ответ о роли полиморфизма rs1835740 на клиническую картину различных форм мигрени. Целью нашего исследования было выяснить влияние однонуклеотидного полиморфизма rs1835740 на клиническую картину различных форм мигрени (эпизодическая и хроническая), а также выявить специфичность данного биомаркёра для мигрени по сравнению с другими формами головной боли (пучковая головная боль, хроническая головная боль напряжения).
Материалы и методы исследования
Пациенты. В исследование вошли 143 пациента с мигренью, средний возраст составил 41.6 ± 12.5 лет (67.8 % – с эпизодической мигренью, 32.2 % – хронической мигренью, 18.5 % – с мигренью с аурой, 31.9 % злоупотребляли обезболивающими средствами). Группы сравнения составили 9 пациентов с пучковой головной болью и 20 пациентов с хронической головной болью напряжения. Группу контроля составили 362 здоровых испытуемых. Пациенты основной группы, групп сравнения и контроля были сопоставимы по возрасту. Диагноз формы головной боли устанавливался на основании критериев Международной классификации головных болей III (2013). Пациентам проводилось клинико-неврологическое обследование и забор крови для генотипирование. Исследование одобрено локальным этическим комитетом, все испытуемые давали информированное согласие на участие в исследовании.
Молекулярно-генетическое исследование и анализ данных. Выделение ДНК проводили согласно протоколу к коммерческому набору ДНК MagnaTM DNA Prep 200 (ООО «Лаборатория ИзоГен», Москва). Оценку аллельных состояний изучаемых замен проводили методом ПЦР в реальном времени. Праймеры, флуоресцентные зонды к rs1835740, а также условия проведения ПЦР подобраны в ООО «ДНК-Синтез», Москва: F: CTGACGAATATACTTATATTCCTTTTACAT, R: CTTGCATATTTGAGCAGACTTTG, rs1835740-C: FAM-CCAATCTGCGTATGTAGA-BHQ2, rs1835740-T: VIC-CAATCTGTGTATGTAG-BHQ2. Для проведения ПЦР в реальном времени использовали коммерческий набор qPCR mix (ЗАО «Евроген», Москва). ПЦР проводили на приборе CFX96 («BioRad», США), используя allelic discrimination тест. Условия ПЦР: 95 °С – 3’, 40 циклов 95 °С – 30’’, 57 °C – 60’’, 72 °C – 30’’.
Статистическую обработку проводили с использованием параметрических и непараметрических методов исследования в пакете программы IBM SPSS Statistics 22. Соответствие равновесию Харди-Вайнберга и ассоциацию с заболеванием в целом рассчитывали с использованием критерия согласия Пирсона (Хи-квадрат).
Таблица 1
Частоты аллелей и генотипов проанализированных генов, соответствие равновесию Харди-Вайнберга (df = 1)
|
Частоты генотипов |
Частоты аллелей |
||||
|
CC |
CT |
TT |
C |
T |
|
|
Пациенты |
0,788 |
0,178 |
0,034 |
0,877 |
0,123 |
|
HWE |
0,769 |
0,216 |
0,015 |
||
|
χ2 = 4,53; p = 0,03 |
|||||
|
Контроль |
0,833 |
0,108 |
0,058 |
0,888 |
0,113 |
|
HWE |
0,788 |
0,200 |
0,013 |
||
|
χ2 = 75,35; p = 0 |
|||||
Таблица 2
Генотипы rs1835740 у пациентов с мигренью, пучковой головной болью и хронической головной болью напряжения
|
Генотип |
СС |
СТ |
ТТ |
|
Мигрень, n/ % |
112/78.3** |
4/44.4 |
100/20 |
|
Пучковая головная боль, n/ % |
29/20.3 |
2/22.2 |
0/0 |
|
Хроническая головная боль напряжения, n/ % |
2/1.4* |
3/33.3 |
0/0 |
Приммечание. * – мигрень vs пучковая головная боль, р = 0.001, ** – мигрень vs хроническая головная боль напряжения, р = 0.0001.
Таблица 3
Генотипы rs1835740 у пациентов с различными формами мигрени
|
Генотип |
СС |
СТ |
ТТ |
|
Эпизодическая мигрень (ЭМ), % |
78.5 |
20.3 |
1.3 |
|
Хроническая мигрень (ХМ), % |
79.6 |
20.5 |
0 |
|
ЭМ vs ХМ, p |
0.8 |
0.9 |
0.4 |
|
Мигрень с аурой (МА), % |
68.1 |
31.8 |
0 |
|
Мигрень без ауры (МбА), % |
82.1 |
16.8 |
1.2 |
|
МА vs МбА, p |
0.2 |
0.1 |
0.3 |
Результаты исследования и их обсуждение
Представленность частот генотипов и аллелей замены rs1835740 у пациентов с мигренью и контрольной выборкой представлена в таблице 1. Частоты генотипов не соответствуют равновесию Харди-Вайнберга. Поэтому для оценки связи с заболеванием мы использовали мультипликативную (частоты аллелей). Достоверных различий между пациентами с мигренью и здоровыми не получено (χ2 = 0.24, p = 0.63). В целом, распределение генотипов соответствует полученным другими авторами [2, 4].
При сравнении представленности генотипов rs1835740 среди пациентов с мигренью, пучковой (кластерной) головной болью и хронической головной болью напряжения (табл. 2) выявлено, что носительство Т-аллеля не характерно для пациентов с хронической головной болью напряжения, а представленность ТТ-генотипа наибольшая среди пациентов с кластерной головной болью.
Анализ генотипов rs1835740 среди различных форм мигрени (мигрень с аурой, мигрень без ауры, хроническая мигрень) различий не выявил (табл. 3).
При исследовании характеристик и симптомов мигрени у носителей и неносителей Т-аллеля rs1835740 не было выявлено статистически значимых различий по их представленности (табл. 4).
Как и в проводимых ранее исследованиях Christensen с соавторами [4] и Esserlind с соавторами [5] нами не получено статистически значимого влияния носительства минорного аллеля Т замены rs1835740 на формирование клинической картины мигрени с аурой и мигрени без ауры. Также нами показано, что полиморфизм rs1835740 не оказывает значимого влияния на развитие хронической мигрени.
Таблица 4
Представленность симптомов и клинических характеристик мигрени среди пациентов у носителей и неносителей Т-аллеля rs1835740
|
Симптом/клиническая характеристика |
Носители С-аллеля, |
Носители Т-аллеля |
Значение р |
|
Наличие мигрени у родственников, % |
69.8 % |
66.7 % |
0.8 |
|
Возраст дебюта мигрени, лет |
17.2 ± 8.5 |
20.2 ± 10.2 |
0.2 |
|
Продолжительность заболевания, лет |
23.9 ± 12.6 |
20.9 ± 11.8 |
0.3 |
|
Частота приступов мигрени в месяц |
9.0 ± 10.6 |
8.2 ± 8.3 |
0.7 |
|
Наличие ауры, % |
16.1 % |
29.2 % |
0.1 |
|
Продолжительность приступов, часы |
34.6 ± 25.2 |
36.5 ± 34.1 |
0.8 |
|
Интенсивность боли, баллы ВАШ |
8.3 ± 1.5 |
8.5 ± 1.2 |
0.4 |
|
Время, за которое боль достигает высокой интенсивности, минуты |
88.9 ± 71.8 |
115.9 ± 92.5 |
0.2 |
|
Пульсирующий характер боли |
78.9 % |
79.2 % |
0.9 |
|
Кожная аллодиния, % |
51.2 % |
34.8 % |
0.1 |
|
Возвраты головной боли, % |
42.3 % |
29.4 % |
0.3 |
|
Тошнота, % |
90.0 % |
87.5 % |
0.7 |
|
Рвота, % |
45.5 % |
50.0 % |
0.7 |
|
Фотофобия, % |
86.7 % |
87.5 % |
0.9 |
|
Фонофобия, % |
85.6 % |
83.3 % |
0.8 |
|
Осмофобия, % |
51.7 % |
60.9 % |
0.4 |
|
Наличие продромального периода, % |
31.7 % |
50.0 % |
0.1 |
|
Наличие постдромального периода, % |
29.5 % |
31.6 % |
0.8 |
|
Резистентность к стандартной терапии, % |
17.7 % |
4.0 % |
0.09 |
|
Наличие лекарственного абузуса |
36.7 % |
26.9 % |
0.3 |
|
Степень лекарственного абузуса (1 балл – легкая, до 30 разовых доз анальгетиков в месяц, 4 балла – тяжёлая – более 90 разовых доз анальгетиков в месяц) |
2.3 балла |
2.1 балла |
0.7 |
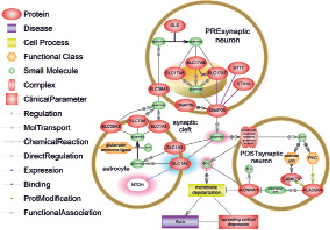
Роль Т-аллеля rs1835740 на «передозировку» глутамата в синаптической щели и возникновение РКД. Красным подсвечено патологическое увеличение количества молекул, синим – уменьшение. Выбелен белок MTDH. Подробное описние в тексте. Подготовлено в программе Pathway Studio 10.0 (Elsevier)
Проведённое нами исследование позволяет предположить, что носительство Т-аллеля rs1835740 является специфичным для пациентов с мигренью и пучковой головной болью, и не характерно для пациентов с хронической головной болью напряжения. Возможно, нарушение гомеостаза глутамата является общим звеном патогенеза для мигрени и кластерной головной боли, обеспечивающим формирование корковой нейрональной гипервозбудимости [3]. Влияние аллеля Т на сигнальные пути, приводящие к изменению в гомеостазе глутамата и, как следствие, к распространяющейся корковой депрессии (РКД) и ауре продемонстрировано на рисунке.
Белок MTDH является блокатором экспрессии одного из основных переносчиков глутамата из синаптического пространства в астроцит – SLC1A2. В астроците глутамат преобразуется в глутамин и передаётся в пресинаптический нейрон, где он снова конвертируется в глутамат. Аллель Т замены rs1835740 приводит к усиленной транскрипции гена MTDH, что приводит к снижению экспрессии SLC1A2. В результате глутамат накапливается синаптической щели и постоянно активирует NMDA рецепторы на постсинаптических нейронах, что приводит к выбросу калия на поверхность клетки из внутриклеточного пространства и входу кальция в клетку. Внеклеточный калий вызывает деполяризации мембраны. Гипердеполяризация является основой для возникновения РКД – распространяющейся деполяризации клеток мозга. Аура, предшествующая мигренозному приступу, является следствием РКД. Эффект деполяризации усиливается активацией фосфолипазы А (PLA2G4A) через кальций зависимые пути в постсинаптическом нейроне. Фосфолипаза синтезирует арахидоновую кислоту, которая блокирует калиевый канал и калий остаётся на поверхности мембраны.
Наличие распространяющейся корковой депрессии, и её клинического коррелята ауры, как правило, обсуждается в контексте нейрональной гипервозбудимости при мигрени. Однако до 23 % пациентов с пучковой головной болью могут отмечать типичную мигренозную ауру перед приступом головной боли [7], тогда как в основе развития хронической головной боли напряжения лежит в большей степени дефицит центральных противоболевых систем. Следовательно, аллель Т rs1835740, обуславливающий повышение уровня межклеточного глутамата, обеспечивает запуск РКД и начало приступа. Это предположение подтверждается данными геномного исследования Anttila с соавторами, где было показано большее влияние полиморфизма rs1835740 на развитие мигрени с аурой [2].
Выводы
Таким образом, полиморфизм rs1835740 является несомненным фактором риска развития мигрени, однако для возникновения заболевания и формирования клинической картины необходимы и другие внешние и внутренние, в том числе и другие генетические факторы, требующие дальнейшего изучения.

