Соединения, содержащие в своем составе несколько фармакофорных фрагментов, привлекают к себе внимание исследователей с позиций изучения их полезных свойств, и различных модификаций структуры данных соединений. К таким соединениям можно отнести арилметилиденовые производные 3Н-фуран-2-онов, содержащие в третьем положении хроменоновый фрагмент [1-3].
Данные соединения являются перспективными полифункциональными соединениями, имеющими несколько неэквивалентных реакционных центров, что делает их привлекательными субстратами для реакций с нуклеофильными реагентами. При этом маршруты данных превращений зависят от выбранного нуклеофильного реагента, а также от условий осуществления реакций [4-7].
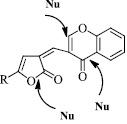
Взаимодействие 3-хроменилметилиден-3Н-фуран-2-ононов с аммиаком проводилось в спиртовом растворе, в качестве катализатора использовался поташ. Аммиак взят в трехкратном избытке. В результате реакции выделены (2-гидроксифенил)-2R-1Н-пирроло-[2,3-b]пиридин-5-ил)метаноны с выходами до 75 %.
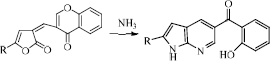
2 a) R = Ph, b) R = п-Tol, c) R = п-OCH3-C6H4
Состав и структура впервые полученных соединений доказаны с привлечением данных ЯМР1Н спектроскопии и физико-химических методов исследования.
Спектр ЯМР1Н (2-гидроксифенил)-2R-1Н-пирроло-[2,3-b]пиридин-5-ил)метанонов 2 a-c содержит синглет NH–группы пиррольного кольца при при 5.78 – 5.85 м.д., синглет протона пиррольного кольца при 7.05 – 7.12 м.д., два синглета протонов пиридинового цикла при 8.24 – 8.30 м.д. и 8.68 – 8.75 м.д., уширенный синглет протона ОН-группы при 8.44 – 8.51 м.д., серию сигналов ароматических протонов при 7.14-8.10 м.д.
В спектрах ЯМР13С соединений 2 а-с отмечены: серия сигналов sp2-гибридных атомов углерода при 102.3-157.6 м.д., атом углерода карбоксильной группы наблюдается при 167.4-168.9 м.д., атом углерода карбонильной группы наблюдается при 189.7 – 192.1 м.д.
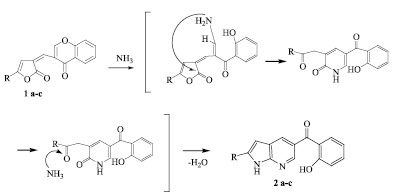
Вероятно, первоначально происходит атака аммиака по карбонильной группе хроменонового фрагмента, сопровождающаяся раскрытием цикла с образованием енаминового фрагмента, дальнейшая атака аминогруппы по С=О группе фуранонового кольца приводит к раскрытию последнего и образованием пиридинового цикла. Атака второй молекулы аммиака по экзоциклической оксогруппе приводит к образованию интермедиата, стабилизация которого происходит за счет дегидратации, с образованием конечного продукта.
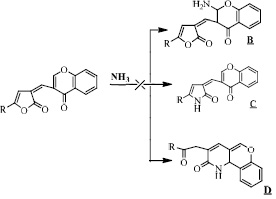
Не исключались и альтернативные пути протекания реакции: образование замещенной пиридин-2-оновой структуры, присоединение по Михаэлю молекулы аммиака (структура В), атака атома азота аммиака по электронодефицитному атому углерода фуранонового цикла, которая сопровождается раскрытием кольца и образованием нециклического интермедиата, стабилизация которого происходит за счет дегидратации (структура С), реакция присоединения-отщепления с участием карбонильной группы хроменонового фрагмента с образованием иминохроменового фрагмента и раскрытием лактонного кольца приводящая к структуре D. Однако спектральные данные позволили исключить данные направления реакции.
Спектры ЯМР1Н записаны на спектрометре Varian-400, при 20-25 °С в CDCl3, внутренний стандарт ТМС. Рабочая частота 400 МГц. ТСХ проводили на пластинах Silufol UV-254, элюент – гексан:этлацетат:хлороформ – 2:2:1, проявитель – пары йода. Температуры плавления определены в открытом капилляре. Элементный анализ проводили на CHNS- анализаторе Elementar модели «Vario Micro cube».
3-Хроменилметилиден-3Н-фуран-2-оны получены по известной ранее методике [8].
(2-гидроксифенил)-2R-1Н-пирроло-[2,3-b]пиридин-5-ил)метаноны (2). В круглодонную колбу на 100 мл, снабженную обратным холодильником, помещают 0,001 моль 5R-3-арилметилиден-3Н-фуран-2-она, 5 мл аммиака и 10 мл этанола кипятят в течение 30 минут, затем добавляют ещё 5 мл аммиака, кипятят 30 минут, добавляют 5 мл аммиака и 0,001 моль поташа, кипятят 30 минут. Полученные кристаллы отфильтровывают на фильтре Шотта, промывают большим количеством воды, перекристаллизовывают из пропанола-2.
(2-гидроксифенил)-2-фенил-1Н-пирроло-[2,3-b]пиридин-5-ил)метанон (2а). Выход 73 %, Т.пл. 158-160°С. ЯМР1Н, δ, м.д.: 5.85 с., (1Н, NH), 7.12 с., (1Н, Pirrol), 7.34 – 8.10 м., (9H, аром), 8.28 c., (1H), 8.51 уш.с., (1H, OH), 8.73 c., (1H). ЯМР13С, δ, м.д.: 103.5, 105.7, 112.4, 113.8, 115.7, 116.9, 118.2, 121.9, 122.5, 126.9, 128.3, 129.5, 131.8, 143.8, 153.9, 156.6, 168.3 (С-ОН), 192.1 (С=О). Найдено %: С 75.98; Н 4.98; N 8.56. С21H18N2O2. Вычислено %: С 76.34; Н 5.49; N 8.48.
(2-гидроксифенил)-2-(п-толил)-1Н-пирроло-[2,3-b]пиридин-5-ил)метанон (2b). Выход 68 %, Т.пл. 172-174 °С. ЯМР1Н, d, м.д.: 2.43 с., (3Н, СН3), 5.78 с., (1Н, NH), 7.05 с., (1Н, Pirrol), 7.24 д., (2Н, J 8.1, п-Tol), 7.35 д., (2Н, J 8.1, п-Tol), 7.47-7.67 м, (4Н, аром.), 8.24 c., (1H), 8.44 уш.с. (1Н, ОH), 8.68 c., (1H). ЯМР13С, δ, м.д.: 28.9, 102.3, 104.9, 108.5, 113.1, 113.9, 114.3, 116.1, 117.8, 120.1, 122.9, 125.3, 127.8, 129.2, 133.2, 145.6, 155.4, 157.5, 167.4 (С-ОН), 189.7 (С=О). Найдено %: С 77.03; Н 6.12; N 7.98. С22H20N2O2. Вычислено %: С 76.72; Н 5.85; N 8.13.
(2-гидроксифенил)-2-(4-метоксифенил)-1Н-пирроло-[2,3-b]пиридин-5-ил)метанон (2с). Выход 75 %, Т.пл. 198-200 °С. ЯМР1Н, d, м.д.: 3.63 с., (3Н, ОСН3), 5. 18 с., (1Н, NH), 7.11 с., (1Н, Pirrol), 7.14 д., (2Н, J 8.1, Ar), 7.28 д., (2Н, J 8.1, Ar), 7.33-7.74 м, (4Н, аром.), 8.30 c., (1H), 8.48 уш.с. (1Н, ОH), 8.75 c., (1H). ЯМР13С, δ, м.д.: 56.3, 104.9, 105.3, 112.1, 115.3, 117.9, 118.2, 120.1, 121.9, 122.6, 124.6, 125.2, 129.8, 135.6, 146.9, 156.2, 157.3, 168.9 (С-ОН), 190.6 (С=О). Найдено %: С 72.95; Н 5.12; N 7.48. С22H20N2O3. Вычислено %: С 73.32; Н 5.59; N 7.77.
Работа выполнена при финансовой поддержке РФФИ грант № 16-03-00530.

