Актуальность проблемы
Большинство пациентов с хроническими формами пародонтита хорошо поддаются стандартному лечению, т.е. снятию отложений и сглаживанию поверхности корня иногда с пародонтологическими операциями, а затем адекватной длительной поддерживающей терапией. Тем не менее, иногда (до 17 % пациентов) такое лечение неэффективно. Молекулярно-биологическими исследованиями выявлено, что стимулирование бактериальными агентами иммунных клеток приводит к выработке провоспалительных цитокинов интерлейкина-1b (ИЛ-1b) и фактора некроза опухоли-a (ФНОa), активизирующих фибробласты к синтезу коллагеназы и остеобласты к трансформации в остеокласты [1]. Сочетание этих двух факторов являются одной из основных причин деструкции пародонтальной связки и костной ткани альвеолярного отростка при быстропрогрессирующем пародонтите (БПП). Являясь инициаторами цитокинового каскада в тканях десны, ИЛ-1b и ФНОa, усиливают как собственную продукцию, так и синтез других провоспалительных цитокинов. При БПП локальный выброс ИЛ-1b и ФНОa становится неуправляемым [2].
По данным [3] иммуноцитокины ИЛ-1b и ФНОa относятся к основным генетическим факторам, определяющим особенности иммунного ответа и могут играть причинную или модифицирующую роль в развитии агрессивных форм пародонтита. Пациенты с генетическим полиморфизмом генов, отвечающих за выработку ИЛ-1b и ФНОa, были отнесены к генотип-положительным [4].
Иммунологические показатели больных с БПП позволяют рассматривать данную патологию как иммунодефицитное и аутоиммунное состояние, требующее иммунореабилитационных мероприятий [4]. Это привело к поиску новых лекарственных препаратов, способных подавлять инициацию провоспалительного цитокинового каскада. В стандарт пародонтологического лечения агрессивных форм пародонтита целесообразно ввести иммуноцитокинотерапию, способную блокировать цитокинез, ингибировать активность коллагеназы и подавлять активность остеокластов [5].
К противовоспалительным цитокинам относится Ронколейкин, представляющий собой новое поколение иммуномодуляторов. Это лекарственная форма рекомбинантного (т.е. полученного методами генной инженерии) дрожжевого интерлейкина-2 человека (рИЛ-2). Препарат разработан в биотехнологической Академии («БИОТЕХ», Санкт Петербург) в 1995 год, в Казахстане разрешен к применению Комитетом фармации МЗ с 2007года. Многогранность биологической активности рИЛ-2 позволяет применять его в комплексной терапии и монотерапии при декомпенсированном вторичном иммунодефиците бактериальных, вирусных, грибковых инфекций, онкозаболеваний, аллергических проявлений, в педиатрии. Основанием для выбора иммуномодулятора Ронколейкина при комплексной терапии БПП послужили сведения о его широкой фармакотерапевтической активности: иммунорегулирующей, противовоспалительной и регенерирующей. Кроме того, немаловажное значение имеет модификация рИЛ-2 таких системных факторов риска генерализованного пародонтита, как генетическая предрасположенность и системный остеопороз [6].
Одной из областей интенсивного развития нанобиотехнологии в приложении к биомедицине является разработка новых методов селективной внутриклеточной и внутритканевой доставки физиологически активных веществ. В 1986 году под руководством биохимика Леонарда Рома из Калифорнийского университета в живых клетках были открыты наноконтейнеры – липосомы и фосфолипиды. Исследование наноконтейнеров натолкнуло ученых на мысль об использовании этих природных нанокапсул в нанотехнологиях, для адресной доставки лекарств, молекул ДНК и РНК. Лекарства, упакованные в липосомы (рис. 1), становятся более эффективными и безопасными, точно попадают к органам-мишеням и позволяют снизить дозу. При применении липосомальной формы лекарственных препаратов эффективную дозу можно уменьшить до 10 раз, а продолжительность действия лекарства увеличивается в два-три раза.
Сотрудниками Института молекулярной биологии и биохимии им. М.А. Айтхожина под руководством академика НАН РК М.К. Гильманова впервые:
- Созданы универсальные наноконтейнеры размерами 0,3-0,5 мкм на основе липосом – мицелл. Благодаря наличию на их поверхностях отрицательного заряда, нанокапсулы, отталкиваясь друг от друга, исключают возможность агрегации и закупорки капилляров, легко проходят сквозь межклеточное пространство через слизистую оболочку, также имеющую слабо отрицательный заряд. Вещество, заключенное в липосомы, защищено от воздействия ферментов, что увеличивает эффективность препаратов, подверженных разрушению в биологических жидкостях. Данный аспект имеет немаловажное значение для применения лекарственных препаратов в полости рта.
- Отработан метод загрузки наноконтейнеров лекарственными препаратами. Для этого использовали их свойство открываться в гидрофобной фазе, а затем захватывать лекарства и захлопываться при переводе их в водную фазу.
- Загруженные Ронколейкиномнаноконтейнеры смешиваются с ланолином для приготовления мазевой лекарственной формы.
- После нанесения этой мази на десневой край или введения в пародонтальный карман наноконтейнеры, в виду малых размеров легко проходят через слизистую оболочку и сквозь межклеточное пространство через 15-20 мин создают депо лекарственного препарата в очагах воспалительного-деструктивного процесса тканей пародонта. Капилляры, снабжающие кровью эти области, как правило, сильно перфорированы, поэтому липосомы легко проникают через расширенные поры и накапливаются в ткани. Это явление получило название «Пассивного нацеливания» (рис. 2). Еще одно важное преимущество наночастиц как лекарственной формы – постепенное высвобождение заключенного в них лекарственного вещества, что увеличивает время его действия.
Цель исследования
Обосновать иммуноцитокинотерапию быстропрогрессирующего пародонтита и провести сравнительный анализ 2-х способов применения Ронколейкина: инъекционного и местного в виде наноконтейнерной технологии.
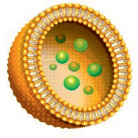
Рис. 1. Схематическое строение липосомы
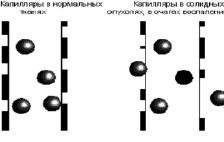
Рис. 2. Проникновение липосом через поры капилляров в область воспаления
Материалы и методы исследования
Дизайн настоящего исследования: рандомизированное клиническое контролируемое исследование с двумя основными группами лечения и одной группой сравнения. Под наблюдением находилось 70 пациентов с БПП в возрасте от 18 до 55 лет. Длительность заболевания составила от 3 до 20 лет. Пациентам кроме базового пародонтологического лечения (профессиональная гигиена полости рта; поддесневойскейлинг и детоксикация корня) назначали иммуноцитокинотерапию. В зависимости от применяемого метода иммунотерапии были выделены 3 группы пациентов с БПП: 1 подгруппа основной группы (n = 25) – иммунотерапия Ронколейкином в виде инъекционных введений; 2 подгруппа основной группы (n = 25) – иммунотерапия Ронколейкином в виде наноконтейнерной мази; 3 группа – сравнения (n = 20) – локальная иммунотерапия Имудоном. Для сравнительного анализа и определения значимости показателей ИЛ-1β и ФНО-α выделили 4 группу, в которую вошли 12 здоровых добровольца без клинически определяемой патологии пародонта, сопоставимых с больными по возрасту и полу.
Методика инъекционного применения ронколейкина (манипуляция очень болезненная): сухой ампулированныйРонколейкин, содержащий 0,5 мг (500 000 МЕ) растворяли в 5 мл раствора натрия хлорида. Пациенту после интрасептальной анестезии карпульными анестетиками в основание каждого десневого сосочка вводили раствор ронколейкина по 0,3 мл. Курс лечения составил от 2 до 3 инъекций с интервалом 2-3 дня. По показаниям Ронколейкин применяли 2 – 3 раза в год.
Методика применения липосомальной формы Ронколейкина: наконтейнерная мазь наносится на десневой край или вводится в пародонтальный карман от 3 до 5 раз с интервалом 2-3 дня. Курс лечения 3-4 раза в год.
Использовали следующие критерии оценки эффективности иммуноцитокинотерапии: индексная оценка пародонтального статуса; морфологическое исследование биопсийной ткани десны. Биоптаты фиксировали в 10 % растворе формалина. Гистологические срезы осуществляли на микротоме МС-2, окрашивали гематоксилин-эозином и исследовали под микроскопом фирмы «Leica» при увеличении окуляра ×50. Для изучения уровня цитокинов ФНОa и ИЛ-1b в сыворотке осуществляли забор крови из локтевой вены в количестве 5 ml. Смывы пародонтальных карманов получали после их двукратного промывания 0,9 %-м раствором хлорида натрия в количестве 5 ml. Забор материала (кровь и смывы пародонтальных карманов) проводили при идентичных условиях в утренние часы натощак. Уровень провоспалительных цитокинов определяли двухфазным иммуноферментным сэндвич-методом, используя наборы реактивов фирмы «BeringerManngeim» (Германия).
Полученные данные результатов исследования были статистически обработаны с помощью t критерия Стьюдента и программного пакета «Statistica-5», при этом различия считали достоверными при р < 0,05.
Результаты исследования и их обсуждение
Клинический эффект иммуноцитокинотерапии ронколейкином БПП заключался в быстром купировании признаков воспаления, уменьшении глубины пародонтальных карманов, сокращении сроков лечения по сравнению с группой сравнения более чем в 2 раза. Отмечалась стабилизация зубов и длительная ремиссия.
Морфологическое исследование биоптатов десны показало, что до лечения на сагиттальном срезе слизистой оболочки десны при БПП выявлялся отек эпителиальных клеток, полнокровие сосудов и стаз эритроцитов. Отмечалось наличие круглоклеточной инфильтрации в строме, дезорганизация коллагеновых волокон.
На 30-е сутки после применения Ронколейкина значительно улучшалась структура и архитектоника многослойного плоского эпителия. В соединительнотканной основе не обнаруживались обширные очаги воспалительной инфильтрации, а клеточный состав в основном состоял из клеток фибробластического ряда. Увеличивалось количество новообразованных сосудов, воспалительная инфильтрация менялась на макрофагально-фибробластическую. Отмечалась также высокая плотность новообразованной капиллярной сети в функционирующем состоянии, что указывает на активацию метаболических процессов.
С помощью иммуногистохимических исследований было выявлено, что до лечения отмечалось статистически достоверное повышение экспрессии в собственной пластинке слизистой оболочки десны ФНОa (39,9 %; р < 0,05). После лечения экспрессия ФНОa значительно снижалась. Через 14 суток цитокин выявлялся у 17,3 % (р < 0,05) а через 21 день у – 6,1 % (р < 0,05) . Спустя 30 суток этот фактор почти не выявлялся (4,1 %; р < 0,05).
По уровню содержания ИЛ-1b и ФНОa в смывах пародонтальных карманов эффективность лечения БПП с применением Ронколейкина оказалась выше в 2,5 (инъекционный метод введения) и 2,3 (наноконтейнеры) раза по сравнению с традиционным местным иммунокорректором Имудоном (р < 0,05).
Заключение
Таким образом, цитокинотерапия быстропрогрессирующего пародонтита Ронколейкином купирует основные симптомы заболевания, активирует процессы восстановления опорно-удерживающих структур зуба, значительно сокращает сроки лечения и способствует длительной ремиссии. Создание наноконтейнерных лекарственных форм препаратов не уступающих их традиционной форме, перспективно и позволит проводить эффективное лечение в пародонтологии без использования инъекционных форм лекарств.

