Все виды хрящевой ткани состоят из клеток и внеклеточного матрикса (ВКМ). ВКМ образован из коллагеновых фибрилл и протеогликанов. Механическая прочность матрикса хрящевой соединительной ткани определяется жесткой структурой молекул и фибрилл коллагена [1]. В хрящах преобладают молекулы коллагена типа II, а фибриллы формируются из комплексов коллагенов типа II и типов I, III, IX, X, XI, XII, XIV. Минорные фибриллы коллагена типа VI связывают основные фибриллы между собой. Разрушения матрикса хрящевой ткани возникают при остеоартрозе, ревматоидном артрите, полихондрии. Во всех суставах изменения при болезнях начинаются прежде всего в гиалиновых хрящах. Происходит истончение фибрилл коллагена, их разволокнение и потеря эластичности. Ослабление структуры фибрилл в суставах наблюдается также при наследственном заболевании гипермобильности суставов, которое сопровождается истончением кожи. Для образования прочных коллагеновых фибрилл и сохранения целостности ткани необходим специфический состав компонентов.
Формирование коллагеновых фибрилл хрящевой соединительной ткани в организме человека происходит из тех аминокислот, белков, гликозаминогликанов, витаминов, микро- и макроэлементов, которые поступают преимущественно с пищей. Полный набор коллагенов разного типа можно получить из аналогичных тканей здоровых сельскохозяйственных животных. Коллагеновые белки, предварительно денатурированные температурой и поступающие с пищей, под действием ферментов желудочно-кишечного тракта могут расщепляться до пептидов и аминокислот. Аминокислоты всасываются в кровь, а затем поступают в клетки матрикса соединительных тканей. Биодоступность коллагена и гликозаминогликанов для усвоения организмом является более высокой после ферментативного гидролиза in vitro.
Таблица 1
Параметры гомогенизации гиалиновых хрящей трахей крупного рогатого скота
|
Образец |
t (время гомогенизации), мин. |
P (давление), МПа |
T (температура), °С |
Средний диаметр частиц, унимодальный анализ (нм) |
|
A |
1 р – 10 мин. |
40 МПа |
30 °С |
380 |
|
2 р – 10 мин. |
60 МПа |
45 °С |
||
|
3 р – 30 мин. |
80 МПа |
60 °С |
||
|
B |
1 р – 10 мин. |
40 МПа |
30 °С |
374 |
|
2 р – 10 мин. |
60 МПа |
45 °С |
||
|
3 р – 10 мин. |
80 МПа |
60-65 °С |
||
|
C |
1 р – 15 мин. |
40 МПа |
30 °С |
300 |
|
2 р – 15 мин. |
60 МПа |
45 °С |
||
|
3 р – 15 мин. |
80 МПа |
65-70 °С |
||
|
E |
1 р – 15 мин. |
40 МПа |
30 °С |
319 |
|
2 р – 15 мин. |
60 МПа |
45 °С |
||
|
3 р – 35 мин. |
80 МПа |
70 °С |
||
|
F |
1 р – 15 мин. |
40 МПа |
30 °С |
393 |
|
2 р – 15 мин. |
60 МПа |
45 °С |
||
|
3 р – 15 мин. |
80 МПа |
70 °С |
||
|
4 р – 10 мин. |
100 МПа |
80-85 °С |
Во многих странах коллагеновые гидролизаты применяют в медицине с целью профилактики и лечения болезней человека, укрепления структуры фибрилл [2-4]. Например, клинические испытания показали, что состояние больных остеоартрозом облегчается в результате совместного действия гидролизованного коллагена и витамина С [2]. Коллагеновые гидролизаты после приёма в течение длительного времени улучшили функционирование коленного сустава у пациентов не только с облегчённой формой остеоартроза, но и с его сложной формой [4].
Целью данной работы является исследование протеолитического расщепления коллагенов хрящевой ткани и получение пептидов регулируемых размеров.
Материалы и методы исследования
Гиалиновые хрящи были выделены из трахей крупного рогатого скота. Биокаталитический метод способствует сохранению структуры ингредиентов матрикса. Для гидролиза белков, содержащихся в гомогенате хрящей, был использован комплекс ферментов (химопсин, панкреатин), действующий в слабощелочной среде. Был исследован протеолиз коллагеновых белков хрящевой ткани в зависимости от температуры, кислотности, концентрации ферментных препаратов и продолжительности процесса. Степень гидролиза (DH) является характеристикой глубины гидролиза. Индекс DH коррелирует с распределением длин молекулярных цепей и с молекулярной массой пептидов. Для оценок качественного состава гидролизатов мы использовали спектрофотометрию, ЯМР-спектроскопию и МАЛДИ масс-спектроскопию.
Результаты исследования и их обсуждение
Гиалиновые хрящи крупного рогатого скота были получены сразу же после забоя животных. Хрящи, очищенные от пленок, сначала были измельчены вручную до частиц размером 3–4 мм, затем были диспергированы и гомогенизированы в водной суспензии до размеров частиц размером 3–4 мкм в механическом гомогенизаторе тканей типа миксера Braun MQ 520. Затем были получены более мелкие размеры частиц менее 700-800 нм в гомогенизаторе высокого давления (ГВД) при давлении 20–60 МПа (~ 200-600 кгс/см2). ГВД «Донор-3» был разработан В.В. Капцовым в ИБК РАН, г. Пущино на базе ГВД «Донор-1». Еще меньше размеры частиц 300–400 нм были получены при дальнейшей гомогенизации суспензии хрящевых частиц в условиях последовательного повышения давления и температуры в течение 20–60 мин («тонкая гомогенизация»). Были исследованы образцы (A, B, C, E, F) со следующими параметрами «тонкой» гомогенизации (табл. 1).
Анализ размеров хрящевых частиц в водной суспензии проводился на фотонном допплеровском анализаторе частиц фирмы Beckman-Coulter N5 (США) двумя методами анализа. В основном измерялся средний диаметр хрящевых частиц при допущении их сферической формы по унимодальному анализу – определение среднего диаметра сферических частиц при нормальном логарифмическом распределении частиц без анализа возможности выявления нескольких пиков распределения частиц в водной суспензии гомогенизированных хрящей. На рис. 1 приведён график распределения частиц образца F в гомогенизированной хрящевой суспензии при унимодальном анализе.
Результаты унимодального распределения при угле 90 °
|
Угол |
Средний диаметр частицы (нм) |
Индекс поли-дисперсности |
Коэффициент диффузии (кв. м/сек.) |
Кол-во фотонов/сек. |
Ошибка базовой линии |
Переполнение |
|
90 ° |
393,6 |
0,743 |
1,25е-12 |
8,69е + 0,5 |
4,6 % |
0 |
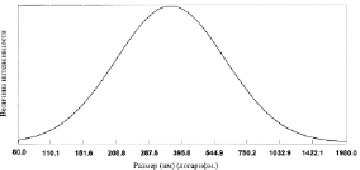
Рис. 1. Средний диаметр частиц гомогенизированной хрящевой суспензии (393,6 нм) измеренный на фотонном допплеровском анализаторе частиц фирмы Beckman-Coulter N5 (США) по унимодальному анализу (образец F)
Анализ распределения частиц по диаметрам при угле 90 °
|
Угол |
Диапазон распределения размеров (нм) |
Вычисленные результаты |
|||||
|
Размер частиц (нм) |
Кол-во % |
Стандартное отклонение |
Средний диаметр |
Среднее стандартное отклонение |
Пыль % |
||
|
90 ° |
2,0-8000,0 |
847,87 |
100,00 |
767,1 |
847,8 |
767,1 |
0 |
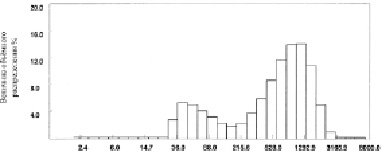
Рис. 2. Распределение частиц по диаметрам гомогенизированной хрящевой суспензии при измерении на фотонном допплеровском анализаторе частиц фирмы Beckman-Coulter N5 (США) по SDP анализу (образец F)
На рис. 2 приведён график распределения частиц образца F в гомогенизированной хрящевой суспензии при проведении SDP (size distribution processor) анализа, т.е. при измерении размеров частиц с анализом на мультимодальное (многопиковое) распределение. Сравнивая распределение хрящевых частиц в суспензии у различных образцов, следует отметить их приблизительно одинаковый характер для всех образцов «тонкой» гомогенизации.
Ферментативный гидролиз гиалиновых хрящей
Ферментативный гидролиз является предпочтительным для получения продуктов расщепления биополимеров соединительных тканей по сравнению с другими методами. В результате ферментативного гидролиза не нарушается структура аминокислот и их состав. Гидролизаты содержат комплекс аминокислот и пептидов, которые не требуют больших затрат энергии в процессе пищеварения и усвоения. Гидролиз гиалиновых хрящей проводили последовательными процедурами. Как правило, для гидролиза белков, содержащихся в соединительных тканях, используют не отдельные протеазы, а комплексы ферментов [5]. Эти ферменты обладают специфичным действием, разрывая определенные связи в белках. Мы изучали гидролиз белков хрящевой ткани, применяя химопсин и панкреатин. Оптимум рН для этих ферментов находится в интервале 7,5 – 9,0, т.е. в области рН, которая ниже рК (10,5) молекулы коллагена. Сравнительный анализ действия этих ферментов при одинаковых условиях рН (8,0), температуры (42 °С), концентрации фермента (1 %) и времени (4 час.) показал, что параметр DH больше в гидролизатах, полученных после действия панкреатина. Однако достоверной разницы между образцами мы не обнаружили. Относительно низкую степень гидролиза можно повысить как гомогенизацией хрящевой ткани, так и параметрами протеолиза.
Наши исследования были направлены на активизацию ферментативного гидролиза гомогената хрящей под действием химопсина. В процессе получения гомогенизированных образцов мы варьировали значения давления, температуры и времени, которые соответствовали параметрам табл. 1. Было проверено влияние химопсина на гомогенаты гиалиновых хрящей, полученные в разных условиях денатурирующего действия давления и температуры (образцы А, В, С, Е, F). Известно, что ферменты химотрипсин и трипсин, содержащиеся в химопсине, эффективно расщепляют полипептидные цепи тройной спирали молекулы коллагена после её денатурации.
Гидролиз проводили в K-Na фосфатном буфере при фиксированных значениях рН (8,0) и температуры (42 °С) в зависимости от концентрации фермента и времени. Гидролиз продолжался в течение 8 часов, но максимальная степень гидролиза наблюдалась после 5–6 часов. Данные по степени гидролиза в разных гомогенатах хрящевой ткани под действием химопсина приведены в табл. 2.
Таблица 2
Степень гидролиза ферментативных гидролизатов, полученных под влиянием химопсина на разные гомогенаты хрящевой ткани
|
Гомогенат |
Время гидролиза (час.) |
Степень гидролиза ( %) |
|
А |
1 2 3 4 5 6 |
5,2 5,6 5,8 5,9 6,3 6,4 |
|
B |
1 2 3 4 5 6 |
5,2 5,4 5,8 5,9 6,4 6,4 |
|
C |
1 2 3 4 5 6 |
5,6 5,9 6,2 6,4 6,9 7,0 |
|
E |
1 2 3 4 5 6 |
5,7 6,0 6,5 6,7 7,1 7,2 |
|
F |
1 2 3 4 5 6 |
5,8 5,9 6,4 6,5 6,8 6,8 |
Мы определили, что степень гидролиза гомогенизированных образцов С и Е повышается на 20 %, если сравнивать ее со степенью гидролиза гомогенатов А и В. При этом, более высокие значения условий денатурации гомогената F не способствовали активизации протеолиза химопсином до максимального уровня, что показывает более низкая степень гидролиза образца F по сравнению с образцами С и Е. Полученные на основе гомогената Е при температуре 42 °С в течение 5–6 часов гидролизаты содержали пептиды, состоящие из 10–30 аминокислотных остатков по данным ЯМР – спектрометрии, выполненной в ЦКП ИТЭБ РАН (рис. 3). Результаты масс-спектрометрии подтверждают эти результаты и показывают наличие пептидов молекулярной массы от 1000 до 6000 Да (рис. 4). Эти результаты дают основание отнести образец к средней степени гидролиза. Проведенные эксперименты также показали, что добавление фермента через 3 часа после начала гидролиза повышает степень гидролиза в 2-2,5 раза. Последовательное действие ферментов: пепсина (рН 3,0) в течение 3 часов, а затем добавление химопсина (рН 8,0) и протеолиз в течение 3 часов не повлияли на молекулярный состав пептидов.
Под влиянием химопсина получены пептиды, которые после расщепления до аминокислот в организме человека могут участвовать в образовании коллагеновых фибрилл. Кроме того, пептиды молекулярной массы 1000–2000 Да можно применять для снижения давления в крови [6]. Помимо этой функции пептиды коллагена могут иметь иммуномодулирующие, антиоксидантные и противовоспалительные свойства [7-9]. Таким образом, полученные под влиянием химопсина пептиды могут обладать полифармацевтическим действием, влияя как на структуру матрикса хрящевой ткани, так и на обмен веществ.
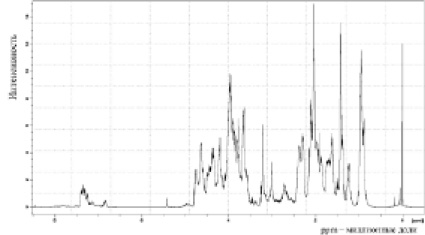
Рис. 3. Протонный ЯМР-спектр гидролизатов гиалиновых хрящей, полученных под влиянием химопсина (концентрация 1 %) в 33,4 mM K-Na фосфатном буфере, рН 8,0 при температуре 42 °С в течение 6 часов
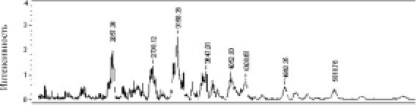
Рис. 4. Молекулярно-массовое распределение пептидов, образованных под влиянием химопсина (концентрация 1 %) в 33,4 mM K-Na фосфатном буфере, рН 8,0 при температуре 42 °С в течение 6 часов
Выводы
Мы определили, что процесс протеолиза регулируют температура, время гидролиза, концентрация ферментных препаратов. Исследованием протеолиза под влиянием химопсина мы показали, что гомогенизация в условиях повышенных значений давления и температуры в зависимости от времени активизирует последующий ферментативный гидролиз. Степень гидролиза гомогенизированных образцов С и Е возрастает на 20 % по сравнению со степенью гидролиза гомогенатов А и В. В результате действия химопсина получены гидролизаты средней степени гидролиза, а их молекулярные массы изменяются от 1000 до 6000 Да.

